多粘类芽孢杆菌HD-1产纤维素酶的条件优化
程爱芳,邓政东,陈 文,周念波,黄芳一
(武汉生物工程学院生命科学与技术学院,湖北武汉430415)
多粘类芽孢杆菌HD-1产纤维素酶的条件优化
程爱芳,邓政东*,陈文,周念波,黄芳一
(武汉生物工程学院生命科学与技术学院,湖北武汉430415)
采用DNS比色法,通过单因素实验和正交实验对多粘类芽孢杆菌HD-1产纤维素酶的培养基主要成分和培养条件进行优化。结果表明:该菌种产纤维素酶的最适培养基为麸皮0.5%、酵母膏1.25%、磷酸二氢钾0.04%、硫酸镁0.1%,培养基初始pH8.0;最适培养条件为接种量4%,培养温度35℃,培养时间51h。在此优化条件下,多粘类芽孢杆菌产纤维素酶活性可达88.3U/mL。
多粘类芽孢杆菌HD-1,纤维素酶,发酵条件,优化
纤维素是地球上最丰富的可再生资源[1]。我国的纤维素类资源极为丰富,农业生产中每年产生大量的皮壳和秸秆[2-3],这些原料大部分被烧掉,不仅能量利用率低,而且对生态平衡和环境污染产生了极为不利的影响[4-6]。纤维素被彻底分解且不造成污染的有效途径之一,就是利用纤维素酶的水解作用。纤维素酶(Cellulase)是一类能够降解纤维素生成葡萄糖的酶的总称。纤维素的有效利用依赖于人们对纤维素酶的发现和认识。目前,世界上许多国家正在积极探索如何转化这一巨大资源[7-8]。
多粘类芽孢杆菌是一类重要的植物生防细菌和根际促生菌,目前认为对人和动植物没有致病性[9]。2002年,美国环保署(EPA)将其列为可商业应用的微生物之一,我国农业部也将其列为免做安全鉴定的一级菌种[10]。多粘类芽孢杆菌可产生多种生物活性物质,如酶、抗菌物质、植物激素以及絮凝剂等,因此,多粘类芽孢杆菌是极具开发前景的生防细菌[11]。
目前对多粘类芽孢杆菌的研究,主要集中在其作为植物生防细菌和根际促生菌[12]、代谢活性物质的种类、抗菌机理、基因的克隆分析和表达[13]等方面,对其能产生多种水解酶的研究并不全面,尤其未见多粘类芽孢杆菌产纤维素酶的相关报道。
本实验以多粘类芽孢杆菌为生产菌株,通过单因素实验和正交实验对其产纤维素酶的培养基成分和培养条件进行优化设计,以提高其产酶活力,为多粘类芽孢杆菌后续的深度开发利用奠定基础。
1 材料与方法
1.1材料与仪器
多粘类芽孢杆菌HD-1(Paenibacillus polymyxa HD-1) 武汉生物工程学院发酵工程实验室分离保藏;硫酸镁、磷酸二氢钾、3,5—二硝基水杨酸(DNS)、氯化钠、羧甲基纤维素钠(CMC-Na)等均为分析纯购于天津市天新精细化工开发中心;琼脂、酵母提取物、酵母膏、蛋白胨、酵母粉等均为生化试剂购自北京奥博星生物技术有限责任公司;麸皮和稻草粉购于市场,粉碎并过80目筛。
pHS-3C酸度计上海雷磁仪器厂;SPX-250型生化培养箱上海跃进医疗器械厂;TU1800紫外可见分光光度计北京谱析通仪器有限公司;LDZX-40B型立式自控电热蒸汽灭菌器上海申安医疗器械厂。
1.2培养基
斜面活化培养基:牛肉膏3g、蛋白胨10g、氯化钠5g、琼脂20g、调节pH7.4,定容于1000mL蒸馏水中。
液体种子培养基:酵母提取物5g,胰蛋白胨10g,氯化钠5g,调节pH7.4,定容于1000mL蒸馏水中。
基础产酶培养基:CMC-Na 5g,蛋白胨10g,磷酸二氢钾0.2g,硫酸镁0.5g,调节pH8.0,定容于1000mL蒸馏水中。
1.3发酵方法
1.3.1斜面活化将保存的多粘类芽孢杆菌HD-1接种于斜面活化培养基上,35℃活化培养24h。
1.3.2液体种子制备取一环活化后的菌种HD-1,接入装有50mL液体种子培养基的250mL三角瓶中,200r/min、35℃恒温培养24h[14]。
1.3.3摇瓶发酵产酶实验以4%接种量将液体种子接入盛有50mL基础产酶培养基的250mL三角瓶中,200r/min、35℃恒温摇床振荡培养48h。
1.4酶活测定
1.4.1粗酶液制备将培养了48h的发酵液5000r/min冷冻离心5min,取上清液即为粗酶液,4℃保存[7]。
1.4.2纤维素酶活性的测定以酶活为指标,以CMC-Na为底物,采用DNS比色法测定发酵液中纤维素酶的活性。取0.9mL 1%的CMC-Na溶液,50℃水浴预热5min,然后加入经适当稀释的粗酶液0.1mL,50℃准确反应30min,立即加入1mL DNS试剂,沸水浴显色5min,冷却后,测定540nm处吸光度值。空白对照先加DNS试剂后加粗酶液[8]。在上述条件下,每分钟由底物释放1μmol还原糖(用葡萄糖作对照)所需的酶量定义为一个酶活单位(U/mL)[15]。
1.5培养基的优化
1.5.1碳源种类对发酵的影响将1.2的基础产酶培养基的碳源分别改变为CMC、可溶性淀粉、蔗糖、稻草粉、麸皮、稻草粉+麸皮(质量比4∶1),添加量均为0.5%,其他营养成分参照基础产酶培养基不变,按照1.3.3的方法进行发酵,取样测定酶活。
1.5.2碳源用量对发酵的影响最佳碳源种类确定后,改变碳源用量,分别设0.25%、0.5%、0.75%、1.0%、1.25%、1.5%共6个梯度,其他营养成分参照基础产酶培养基不变,按照1.3.3的方法进行发酵,取样测定酶活。
1.5.3氮源种类对发酵的影响将1.2的基础产酶培养基的氮源分别改变为酵母膏、酵母粉、蛋白胨、硫酸氨、硝酸氨和尿素,添加量均为1%,其他营养成分参照基础产酶培养基不变,按照1.3.3的方法进行发酵,取样测定酶活。
1.5.4氮源用量对发酵的影响最佳氮源种类确定后,改变氮源用量,分别设0.25%、0.5%、0.75%、1.0%、1.25%、1.5%共6个梯度,其他营养成分参照基础产酶培养基不变,按照1.3.3的方法进行发酵,取样测定酶活。
1.5.5正交实验优化培养基根据单因素实验结果及相关文献[5,16],取碳源、氮源、磷酸二氢钾及硫酸镁4个因素,每因素取3个水平,采用正交实验对产酶培养基进行优化。培养基优化的因素水平见表1。

表1 培养基正交实验因素水平Table 1 Factors and levels of orthogonal test for medium
1.6培养条件的优化
1.6.1培养基初始pH对发酵的影响调节基础产酶培养基初始pH分别为6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5,按照1.3.3的方法进行发酵,取样测定酶活。
1.6.2装液量对发酵的影响250mL三角瓶分别装入25、50、75、100mL的基础产酶培养基,按照1.3.3的方法进行发酵,取样测定酶活。
1.6.3接种量对发酵产酶的影响分别以2%、4%、6%、8%、10%的接种量,接种于基础产酶培养基中,按照1.3.3的方法进行发酵,取样测定酶活。
1.6.4温度对发酵产酶的影响设定揺瓶培养温度分别为28、30、33、35、37、40℃,按照1.3.3的方法进行发酵,取样测定酶活。
1.6.5揺瓶转速对发酵产酶的影响分别设定160、180、200、220、240、260r/min的转速,按照1.3.3的方法进行发酵,取样测定酶活。
1.6.6发酵时间对发酵产酶的影响按照1.3.3的方法进行发酵,每隔6h取样测定酶活。
1.6.7正交实验优化培养条件根据单因素实验结果,选取温度、初始pH、接种量及发酵时间4个因素,每因素取3个水平。培养条件优化的因素水平见表2。
仆人来不及查看钓竿,就发现地上有一支小巧的铜笛,沾着鲜血。确切地讲,那不是笛子,只不过模样像笛子,小得多,也短得多。就是这玩意,刚才砰的一下从钓竿握把底端射出,贯通李霸崖身体,洞穿其肝脏。

表2 培养条件正交实验因素水平表Table 2 Factors and levels of orthogonal test for culture conditions
1.7数据处理与统计分析
实验数据采用SPSS 16.0软件进行处理,采用Excel软件进行作图,每组实验均重复三次,显著性水平为p<0.05。
2 结果与分析
2.1培养基优化结果
2.1.1碳源种类对发酵的影响不同碳源对发酵产酶的影响结果如图1所示,多粘类芽孢杆菌产纤维素酶的最适碳源为麸皮,当以CMC为碳源时酶活较低,这可能是由于麸皮为植物性来源的材料,营养成分更全,而CMC为单一成分的化学试剂,在培养基中会造成发酵液比较粘稠,影响溶氧。

图1 不同碳源对产酶的影响Fig.1 Effect of carbon source on cellulase
2.1.2碳源用量对发酵的影响麸皮用量对发酵产酶的影响结果如图2所示,产纤维素酶的最适麸皮用量为0.5%,超过0.75%酶活力迅速下降,可能是因为麸皮不溶于培养基,浓度过大影响溶氧。

图2 麸皮浓度对产酶的影响Fig.2 Effect of bran on cellulase
2.1.3氮源种类对发酵的影响不同氮源对发酵产酶的影响结果如图3所示,在不同的氮源种类中,有机氮营养丰富,效果优于无机氮,其中酵母膏对产酶的促进作用最大,因此多粘类芽孢杆菌产纤维素酶的最适氮源为酵母膏。
2.1.4氮源用量对发酵的影响酵母膏用量对发酵产酶的影响结果如图4所示,酵母膏用量在0.25%~1%时,纤维素酶活力不断升高,1%时最佳,超过1%酶活迅速下降,因为氮源浓度过高会导致细胞脱水死亡,不利于代谢产物的积累;而氮源不足,菌体繁殖速度太慢,影响酶的产量。

图3 不同氮源对产酶的影响Fig.3 Effect of nitrogen source on cellulase

图4 酵母膏浓度对产酶的影响Fig.4 Effect of yeast extract on cellulase
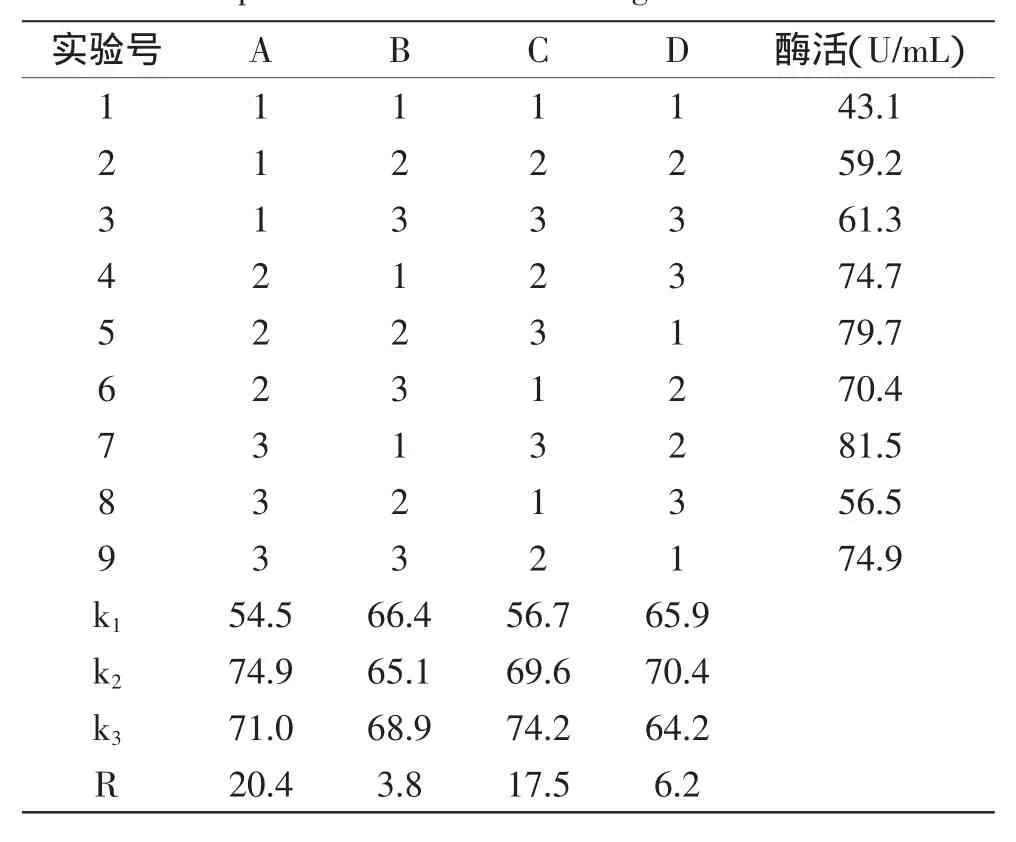
表3 培养基正交实验优化结果Table 3 Optimization results of orthogonal test for medium

表4 培养基优化结果方差分析Table 4 Variance analysis of orthogonal test
2.1.5培养基正交实验优化结果培养基成分正交实验优化的结果见表3,方差分析见表4。
由表3可知,影响多粘类芽孢杆菌HD-1产纤维素酶的培养基成分因素由大到小顺序为A>C>D>B,优组合为A2B3C3D2,即麸皮0.5%、酵母膏1.25%、磷酸二氢钾0.04%、硫酸镁0.1%。对优组合A2B3C3D2进行验证实验,纤维素酶活力可达84.3U/mL,高于正交表中的最大酶活81.5U/mL。由表4可知,因素A、C、B、D对实验结果影响极其显著,各因素显著程度为A>C>D>B,与极差分析结果一致。
2.2培养条件优化结果
2.2.1培养基初始pH对发酵的影响初始pH对菌株产酶的影响不仅表现在改变基质代谢速率,还表现在改变代谢途径及细胞形态等方面。不同培养基初始pH对发酵产酶的影响结果如图5所示,多粘类芽孢杆菌产纤维素酶的最适初始pH为9。

图5 初始pH对产酶的影响Fig.5 Effect of initial pH on cellulase
2.2.2装液量对发酵的影响不同装液量对发酵产酶的影响结果如图6所示,装液量主要影响发酵过程中的通气情况从而影响产酶,装液量过小导致培养基水分蒸发较快及代谢物浓度较大,溶氧下降;装液量过大导致振荡效果减弱,溶氧降低[16]。多粘类芽孢杆菌产纤维素酶的摇瓶发酵最适装液量为50mL。

图6 装液量对产酶的影响Fig.6 Effect of medium volume on cellulase
2.2.3接种量对发酵产酶的影响接种量对发酵产酶的影响结果如图7所示,多粘类芽孢杆菌产纤维素酶的最适接种量为6%。接种量过小菌体数量不够,接种量过大引起短时间内菌体大量生长繁殖,从而使溶氧不足,均不利于产酶。
2.2.4温度对发酵产酶的影响温度对发酵产酶的影响结果如图8所示,多粘类芽孢杆菌产纤维素酶的最适发酵温度为33℃。在30~35℃酶活都较高,温度过低不利于菌体生长,温度过高(>35℃)菌体衰老、酶活迅速下降。
2.2.5摇瓶转速对发酵产酶的影响摇瓶转速对发酵产酶的影响结果如图9所示,多粘类芽孢杆菌产纤维素酶的最适转速为220r/min。转速太小影响通气量从而影响溶氧,不利于产酶;转速太大气体停留时间缩短从而使得溶氧减低,同时剪切力过大,不利于产酶。

图7 接种量对发酵产酶的影响Fig.7 Effect of inoculation volume on cellulase

图8 温度对产酶的影响Fig.8 Effect of temperature on cellulase

图9 摇床转速对产酶的影响Fig.9 Effect of agitation speed on cellulase
2.2.6发酵时间对发酵产酶的影响发酵时间对产酶的影响结果如图10所示,多粘类芽孢杆菌产纤维素酶的最适发酵时间为48h。发酵时间过短,微生物没有充分生长导致产酶较少,时间过长微生物发生自溶,不利于产酶。
2.2.7培养条件正交实验结果培养条件正交实验优化的结果见表5,方差分析见表6。由表5可知,影响多粘类芽孢杆菌HD-1产纤维素酶的培养条件因素由大到小顺序为H>F>E>G,即发酵时间>培养基初始pH>温度>接种量;优组合为E3F2G1H3,即温度35℃、初始pH8.0、接种量4%、发酵时间51h。由表6可知,因素E、F、G、H对实验结果的影响均极显著,且显著程度为H>F>E>G,与极差分析结果一致。

图10 发酵时间对产酶的影响Fig.10 Effect of culturing length on cellulase

表5 培养条件优化正交实验结果Table 5 Optimization results of orthogonal test for culture conditions

表6 培养条件优化结果方差分析Table 6 Variance analysis of orthogonal test
3 结论与讨论
通过单因素和正交实验对多粘类芽孢杆菌HD-1的培养基成分和培养条件进行了优化,得到其产纤维素酶的最优发酵条件为麸皮0.5%、酵母膏1.25%、磷酸二氢钾0.04%、硫酸镁0.1%、培养基初始pH8.0,培养温度35℃、接种量4%、发酵时间51h。在此条件下,纤维素酶活力可达88.3U/mL。另外,从两个正交实验结果方差分析可以看出,麸皮用量、磷酸二氢钾用量及发酵时间长短对产酶影响极大,应严格控制以利于产酶。本实验首次研究了多粘类芽孢杆菌产纤维素酶的发酵工艺,为多粘类芽孢杆菌后续的深度开发利用提供一定的理论支持。目前由于菌种及发酵工艺的原因,其产生的纤维素酶活性并不太理想,还需进一步研究。多粘类芽孢杆菌HD-1产生的纤维素酶可用于饲料添加剂、造纸及洗涤工业中[3],在以后可研究合适的发酵条件,使得发酵后的多粘类芽孢杆菌菌体用于微生态制剂[11],发酵上清用于酶制剂生产[16]。
[1]赵琪,李亚兰,陈子欣,等.纤维素酶应用研究的最新进展[J].广州化工,2014,42(6):21-23.
[2]杨盛,侯红萍.纤维素酶及其研究进展[J].中国调味品,2008(11):27-30.
[3]熊立根,柴士名,李旺,等.纤维素酶及其应用研究进展[J].江西饲料,2008(4):23-27.
[4]王万能,张潇骏,吕婧,等.R2工程细菌纤维素酶酶活影响条件初探[J].湖北农业科学,2013,52(18):4486-4489.
[5]刘建国,韩梅.一株低温产纤维素酶细菌的筛选及其发酵产酶条件的优化[J].食品与发酵科技,2014,50(1):38-41.
[6]芦志龙,张穗生,吴仁智,等.产纤维素酶新菌株的筛选及其产酶特性研究[J].广西科学,2014,21(1):22-27.
[7]孟威.纤维素酶产生菌的诱变育种及发酵工艺的研究[D].长春:吉林大学,2008.
[8]祝小,王振华,潘康成,等.产纤维素酶芽孢杆菌筛选及发酵条件的初步研究[J].现代农业科技,2006(11):122-124.
[9]CHOONG-MIN R,JINWOOK,OKHEEC,et al.Improvement of biological control capaeity of Paenibacillus polymyxa E681 by seed pelleting on sesame[J].Biological Control,2006,39(3):282-289.
[10]韩俊华,陈大欢,黄继翔.响应面法优化多粘类芽孢杆菌HT16产生抗菌蛋白的培养基[J].食品工业科技,2014,35(13):262-266.
[11]杨少波,刘训理.多粘类芽孢杆菌及其产生的生物活性物质研究进展[J].微生物学通报,2008,35(10):1621-1625.
[12]Li B,Yu R R,Tang Q M,et al.Biofilm formation ability of PaenibacilluspoiymyxaandPaenibacillusmaceranstheir inhibitory effect against tomato bacterial wilt[J].African Journal of Microbiology Research,2011,5(25):4260-4266.
[13]Choi S K,Park S Y,Kim R,et al.Identification of a Polymyxin synthetase gene cluster of Paenibacillus polymyxa and heterologous expression of the gene in Bacillus subtilis[J]. Journal of Bacteriology,2009,191(10):3350-3358.
[14]王旭愿,张敏,李成涛,等.洋葱假单胞菌产脂肪酶条件的优化[J].湖北农业科学,2014,53(1):184-187.
[15]江国忠.高产纤维素酶枯草芽孢杆菌的筛选、应用及其产酶条件研究[D].南昌:南昌大学,2010.
[16]蒋红菊,许威震,朱春林,等.多粘类芽孢杆菌20185液态发酵产碱性果胶酶发酵条件的研究[J].中国酿造,2011(10):111-114.
Optimization of producing conditions of the cellulase from Paenibacillus polymyxa HD-1
CHENG Ai-fang,DENG Zheng-dong*,CHEN Wen,ZHOU Nian-bo,HUANG Fang-yi
(School of Life Science and Technology,Wuhan Institute of Bioengineering,Wuhan 430415,China)
In order to improve the production of cellulase,the fermentation medium and culture conditions for Paenibacillus polymyxa HD-1 were optimized by single factor test and orthogonal test.The results showed that the best compositions of fermentation medium were 0.5%of bran,1.25%of yeast extract,0.04%of KH2PO4·3H2O,0.1%of MgSO4·7H2O,with the initial pH of the medium was 8.0;and the best fermentation inoculum size was 4%,culture temperature at 35℃ and culture time for 51 hours.Under this optimal conditions,the activity of cellulase from Paenibacillus polymyxa HD-1 could reach 88.3U/mL.
Paenibacillus polymyxa HD-1;cellulase;fermentation conditions;optimization
TS202.3
A
1002-0306(2015)10-0173-05
10.13386/j.issn1002-0306.2015.10.027
2014-08-18
程爱芳(1980-),女,硕士,讲师,研究方向:食品生物技术及微生物发酵。
邓政东(1973-),男,硕士,讲师,研究方向:微生物发酵及产物提取。
武汉生物工程学院校级研究项目(2013JYI01)。

