柱前衍生化高效液相色谱法分析发菜胞外多糖的单糖组成
王贵春,陈雪峰,刘 宁,王 宁
(陕西科技大学生命科学与工程学院,陕西西安710021)
柱前衍生化高效液相色谱法分析发菜胞外多糖的单糖组成
王贵春,陈雪峰*,刘宁,王宁
(陕西科技大学生命科学与工程学院,陕西西安710021)
采用水溶醇沉法提取发菜多糖,通过三氟乙酸(TFA)将其水解成单糖,经1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化后,利用RP-HPLC分析其单糖组成。结果表明,发菜胞外多糖由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖组成,其摩尔比为0.71∶0.37∶0.44∶1.53∶1.03∶0.40。该方法具有操作简便、快捷,重现性良好等特点,可用于发菜胞外多糖中单糖组成的定性和定量分析。
发菜胞外多糖,单糖组成,柱前衍生化,高效液相色谱法
发菜(Nostoc Flagelliforme)是发状念珠蓝细菌的简称,主要生长在中国、蒙古、墨西哥等国[1],营养价值丰富。发菜在液体培养过程中向胞外分泌大量的多糖类物质[2],相关研究表明多糖是一类具有抗病毒、抗肿瘤、抗氧化、抗凝血及免疫促进等生物活性的生物大分子[3-5],而且多糖类化合物在生命活动中具有的生物活性作用与其分子结构存在密不可分的关系,单糖组成分析是多糖结构鉴定的基础。生物多糖的单糖组成分析常用的方法有气相色谱法、高效液相色谱法、薄层色谱法等[6],薄层色谱法样品处理繁琐、鉴别能力不强,已逐渐被仪器分析方法所代替;气相色谱法对中性糖的分离效果较好,对于糖醛酸含量较高的酸性多糖分离效果差,且前期处理较为复杂[7],而高效液相色谱法可以很好地将中性糖及糖醛酸进行分离鉴定。本文首次运用柱前衍生化高效液相色谱法对发菜胞外多糖的单糖组成进行分析。实验以1-苯基-3-甲基-5-吡唑啉酮(PMP)为衍生化试剂,在碱性条件下与多糖水解产物定量缩合生成单糖-PMP衍生物,采用HPLC法分析发菜胞外多糖的单糖组成,并测定了各单糖的组成比例。
1 材料与方法
1.1材料与仪器
1-苯基-3-甲基-5-吡唑啉酮(PMP)比利时Acros公司;三氟乙酸(TFA)上海科丰化学试剂有限公司;鼠李糖(Rha)、阿拉伯糖(Ara) 天津西玛科技有限公司;葡萄糖(Glc)、半乳糖(Gal)、甘露糖(Man)、木糖(Xyl)、葡萄糖醛酸(GlcU) 国药集团化学试剂有限公司;乙腈、氢氧化钠、磷酸氢二钠、磷酸二氢钾天津科密欧化学试剂有限公司。
PHSJ-4A型酸度计上海雷磁仪器厂;Waters Symmetry C18(4.6mm×250mm,5.0μm)色谱柱、Waters1525-2487型高效液相色谱系统美国Waters公司。
1.2实验方法
1.2.1发菜胞外多糖的提取参考陈雪峰等[8]的研究方法,发菜胞外多糖为水溶性多糖,采用乙醇沉淀的方法提取,分离培养液与发菜细胞,将培养液浓缩到一定程度,Sevag法脱除游离蛋白质、透析除去小分子盐,加入乙醇4℃下静置24h,离心取沉淀,冷冻干燥得发菜胞外粗多糖。
1.2.2混合单糖标准溶液的制备称取葡萄糖(Glc)、半乳糖(Gal)、甘露糖(Man)、鼠李糖(Rha)、阿拉伯糖(Ara)、木糖(Xyl)、葡萄糖醛酸(GlcU)标准品,用超纯水分别配制成2mmol/L的各单糖标准溶液。取每种单糖标准溶液混匀,配制成混合单糖标准溶液。
1.2.3发菜多糖的水解[9]称取发菜胞外多糖10.0mg,溶于2mL 2mol/L的TFA溶液中,于105℃烘箱中水解2h,冷却至室温后,10000r/min离心10min,取上清液,用0.3mol/L NaOH中和至pH7.0,得发菜胞外多糖水解产物。
1.2.4PMP衍生化标记[10]分别取混合单糖标准溶液和发菜胞外多糖水解液100μL,至于1.5mL离心管中,依次加入200μL 0.3mol/L NaOH溶液和200μL 0.5mol/L PMP甲醇溶液,涡旋混匀,于70℃水浴反应90min。冷却至室温后,加入200μL 0.3mol/L HCl中和,再加入等体积氯仿萃取,振荡、静置,弃去有机相,重复操作3次。上层水相经0.45μm微孔滤膜过滤后用于HPLC分析。
1.2.5色谱条件色谱柱:Waters Symmetry C18(4.6mm× 250mm,5.0μm);流动相:乙腈(A)-0.05mol/L磷酸盐缓冲液(pH6.9,由磷酸氢二钠与磷酸二氢钾配制)(B);洗脱模式:梯度洗脱,时间梯度为0min→10min→20min→35min→40min,对应流动相体积分数梯度20%→20%→23%→25%→20%(A);流速:1mL/min;柱温:30℃;检测波长:245nm;进样体积:20μL。
1.2.6流动相中乙腈比例的选择采用0.05mol/L pH6.9的磷酸盐缓冲液和乙腈作为流动相,进样混合单糖标准溶液,研究等度洗脱(乙腈比例分别20%、23%、25%)及梯度洗脱对分离效果的影响。
1.2.7方法学考察
1.2.7.1线性关系的考察取2mmol/L混合单糖标准溶液0.5、2.0、4.0、6.0、8.0mL,分别置于10mL容量瓶中,用超纯水稀释至刻度,摇匀,作为系列对照品混合溶液。按1.2.4进行衍生化处理,按1.2.5色谱条件进样分析,计算标准曲线、线性相关系数及线性范围。
1.2.7.2稳定性实验取衍生化后混合单糖标准溶液,按1.2.5色谱条件分别在0、3、6、9、12h进样测定,记录峰面积,计算各单糖12h内的相对标准偏差(RSD)。
1.2.7.3精密度实验取衍生化后混合单糖标准溶液,按1.2.5色谱条件进行测定,重复进样5次,记录峰面积,计算各单糖的RSD。
1.2.7.4重复性实验称取5份发菜多糖,每份10.0mg,按1.2.3方法进行多糖水解,再按1.2.4方法进行衍生化处理,按1.2.5色谱条件进行测定,记录峰面积,计算样品中单糖的RSD。
1.2.8发菜多糖样品分析取衍生化后多糖水解物,按1.2.5色谱条件进行测定,将样品色谱峰保留时间与混合单糖标准溶液色谱峰比对,计算样品单糖组成摩尔比。
2 结果与分析
2.1流动相的选择
在选定流动相类型、流速的情况下,考察不同流动相比例对7种单糖衍生物分离效果的差异,结果如图1所示。可以发现,等度模式下乙腈比例为20%时,Rha与GlcU分离效果差,未完全分离出现重合现象;等度模式下乙腈比例为23%和25%时,Xyl与Ara分离效果差,未完全分离出现重合;而在梯度模式下乙腈比例为20%→20%→23%→25%→20%,时间梯度为0min→10min→20min→35min→40min时,7种单糖峰型和分离效果均达最佳。
2.2方法学考察
2.2.1线性关系的考察通过实验结果计算得出各单糖标准曲线、线性相关系数及线性范围(表1)。由表1可知,各单糖在各自线性范围内有良好的线性关系,线性相关系数均在0.9912以上。

表1 7种单糖标准曲线和线性范围Table 1 The standard curves and linear range of seven standard monosaccharides
2.2.2稳定性实验计算混合单糖标准溶液在12h内各单糖衍生物峰面积的RSD,依次为Man 1.68%、Rha 0.88%、GlcU 1.08%、Glc 0.76%、Gal 0.89%、Xyl 0.63%、Ara 0.69%,表明在室温下样品溶液在12h内稳定。
2.2.3精密度实验计算各单糖衍生物峰面积的RSD,依次为Man 0.42%、Rha 0.40%、GlcU 0.58%、Glc 0.85%、Gal 0.66%、Xyl 0.60%、Ara0.55%,表明该仪器方法的精密性良好。
2.2.4重复性实验计算样品中各单糖衍生物峰面积的RSD,依次为Man 1.78%、Rha 1.56%、GlcU 1.62%、Glc 0.92%、Gal 1.35%、Xyl 1.26%,表明该方法的重复性良好。
2.3发菜多糖样品分析
通过对样品中色谱峰保留时间与混合标准单糖色谱峰保留时间的对比,如图2所示,可以确定发菜多糖由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖等单糖组成;由表1标准曲线计算可知,各种单糖对应摩尔比为0.71∶0.37∶0.44∶1.53∶1.03∶0.40。
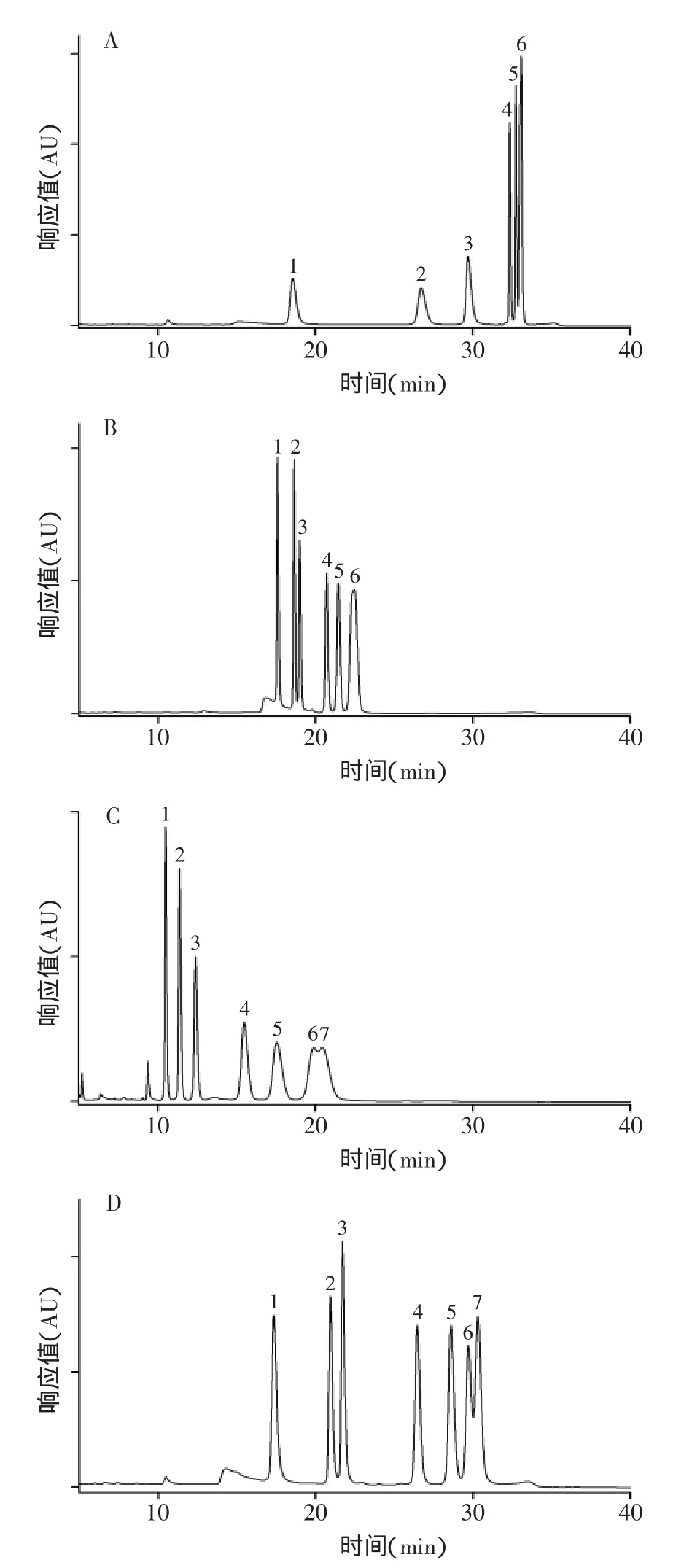
图1 不同乙腈比例对单糖衍生物分离效果影响Fig.1 Effect of acetonitrile proportion on the separation of monosaccharide derivatives
3 结论
通过柱前衍生化高效液相色谱法,建立了利用高效液相色谱-紫外检测器和反相C18柱分离分析发菜多糖的单糖组成的色谱条件。该方法操作简便、快捷,重现性好,可以使7种自然界常见单糖得到很好的分离,并可定性、定量分析发菜多糖的单糖组成及摩尔比。本实验结果对发菜多糖组成和结构研究具有一定的指导意义。

图2 混合标准单糖(A)和发菜多糖水解物(B)HPLC色谱图Fig.2 HPLC chromatograms of mixed standard monosaccharides and hydrolyzate polysaccharide
[1]张怀平.乌兰察布市野生发菜生长现状调查[J].内蒙古农业科技,2013(1):132-133.
[2]白雪娟.发状念珠蓝细菌多糖及其制品的初步研究[D].天津:天津科技大学,2005.
[3]Kanekiyo K,Lee JB,Hayashi K,et al.Isolation of an antiviral polysaccharide,Nostoflan,from a terrestrial cyanobacterium N.flagelliforme[J].J Nat Prod,2005,68(7):1037-1041.
[4]陈雪峰,贾士儒,王岳,等.发菜多糖的红外光谱分析与抗氧化活性的研究[J].食品与发酵工业,2009,35(7):133-137.
[5]宁书年,张桂.生物多糖类物质对人体的作用[J].食品科学,2005,26(9):613-614.
[6]周鹏,谢明勇,傅博强.多糖的结构研究[J].南昌大学学报:理科版,2001,25(2):197-203.
[7]李波,许时婴.气相色谱法测定多糖中的糖醛酸[J].色谱,2004,22(5):560.
[8]陈雪峰,李一当,贾士儒.发菜多糖的提取、纯化鉴定及理化特性研究[J].食品与发酵工业,2008,34(10):174-177.
[9]刘刚,王辉,周本宏,等.高效液相色谱法分析松茸多糖的单糖组成[J].中国医院药学杂志,2012,32(10):758-761.
[10]Chen Y,Mao WJ,Yang YP,et al.Structure and antioxidant activity of an extracellular polysaccharide fromcoral-associated fungus,Aspergillus versicolor LCJ-5-4[J].Carbohydrate Polymers,2012,87:218-226.
Analysis of monosaccharide compositions of Nostoc Flagelliforme extracellular polysaccharide by pre-column derivation HPLC
WANG Gui-chun,CHEN Xue-feng*,LIU Ning,WANG Ning
(College of Life Science and Engineering,Shaanxi University of Science and Technology,Xi’an 710021,China)
The polysaccharide was precipitated by ethanol,and hydrolyzed into monosaccharides by trifluoroacetic(TFA).The hydrolyzate was derivated with 1-phenyl-methyl-5-pyrazolone(PMP)and then the PMP derivates of monosaccharides were determined by RP-HPLC.The results showed that Nostoc Flagelliforme extracellular polysaccharide was composed of mannose,rhamnose,glucuronic acid,glucose,galactose,xylose,and the molar ratio of the six monosaccharides were 0.71∶0.37∶0.44∶1.53∶1.03∶0.40.The established HPLC method was simple,fast and good reproducibility,and could be used for the determination of monosaccharide compositions of Nostoc Flagelliforme extracellular polysaccharide.
Nostoc Flagelliforme extracellular polysaccharide;monosaccharide compositions;pre-column derivation;HPLC
TS207.3
A
1002-0306(2015)10-0059-03
10.13386/j.issn1002-0306.2015.10.003
2014-08-18
王贵春(1989-),男,在读硕士研究生,研究方向:微生物多糖功能与应用。
陈雪峰(1964-),男,博士,教授,研究方向:食品功能成分及生物技术。
国家青年科学基金项目(31401633);陕西科技大学后补助项目(2014XHBZ-10)。

