罗非鱼鱼肉及组分蛋白酶解产物的抗氧化特性
陈星星,胡 晓,李来好,*,杨贤庆,吴燕燕,林婉玲,陈胜军,郝淑贤,魏 涯
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州510300;2.上海海洋大学食品学院,上海201306)
罗非鱼鱼肉及组分蛋白酶解产物的抗氧化特性
陈星星1,2,胡晓1,李来好1,*,杨贤庆1,吴燕燕1,林婉玲1,陈胜军1,郝淑贤1,魏涯1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州510300;2.上海海洋大学食品学院,上海201306)
采用胃蛋白酶、中性蛋白酶、Alcalase2.4L碱性蛋白酶分别酶解罗非鱼肉蛋白,研究比较不同蛋白酶在1、2、4、6、8h对罗非鱼肉蛋白的酶解效果及产物的抗氧化活性,结果表明:3种酶的酶解产物都具有一定的抗氧化活性,中性蛋白酶酶解产物的水解度和蛋白回收率最高,胃蛋白酶酶解产物对DPPH自由基和羟自由基的清除效果最好;综合各项指标选择中性蛋白酶对罗非鱼肉的组分蛋白(肌原纤维蛋白、肌浆蛋白、基质蛋白)进行4h酶解,研究比较不同组分蛋白的酶解效果及产物的抗氧化活性,结果表明:组分蛋白中基质蛋白酶解产物的蛋白回收率最高,为89.8%,肌原纤维蛋白酶解产物的水解度最高,为10.1%,肌浆蛋白酶解产物的抗氧化活性最好,羟自由基和DPPH自由基的IC50值分别为12.352mg/mL和3.554mg/mL。
罗非鱼,组分蛋白,酶解,抗氧化活性
自由基是一种引起机体氧化的物质,会对组织和细胞产生严重的氧化损伤,导致各种疾病[1],而生物活性肽,尤其是抗氧化活性肽具有清除体内自由基和抑制生物大分子过氧化的作用。水产蛋白因其含量高和营养丰富等特点,近年来成为国内外制备抗氧化肽的热点之一[2-9]。
罗非鱼肉蛋白质含量高,达19%,且氨基酸种类齐全、比例合理,其中赖氨酸含量较高,是酶解制备具有一定生物活性肽很好的原料来源。我国是世界罗非鱼最大的养殖国家,但是当前罗非鱼肉的加工利用主要以冷冻罗非鱼片为主,产品的附加值低,蛋白利用率也不高,因此,研究罗非鱼肉的精深加工和高值化利用很有必要[10-12]。目前,以罗非鱼为原料,采用各种蛋白酶酶解制备抗氧化活性肽已有报道[13-15],但是分离提取罗非鱼肉的组分蛋白进行酶解,探求罗非鱼肉酶解机理的研究还未见报道,不同肌肉组分其水解产物活性可能存在较大差异,目前并未探明。因此,本实验分别研究胃蛋白酶、中性蛋白酶、Alcalase2.4L碱性蛋白酶酶解罗非鱼肉制备抗氧化活性肽,选取合适的蛋白酶和酶解时间,对分离提取的罗非鱼肉组分蛋白即基质蛋白、肌浆蛋白、肌原纤维蛋白分别进行酶解,测定产物的抗氧化活性和酶解效果,旨在探索罗非鱼肉酶解过程中各组分蛋白的酶解情况,为罗非鱼肉蛋白酶解机理提供参考,同时为罗非鱼肉的综合开发利用提供理论依据。
1 材料与方法
1.1材料与仪器
罗非鱼购于广州华润万家超市,取鱼肉,洗净沥干,绞肉机绞碎,置于聚乙烯袋中-20℃冻藏备用;胃蛋白酶、中性蛋白酶(10万U/g,食品级蛋白酶) 广州市齐云生物技术有限公司;Alcalase2.4L(20万U/g,食品级蛋白酶) 丹麦诺维信公司;DPPH(分析纯)美国Sigma公司;邻二氮菲(分析纯) 韶远化学科技(上海)有限公司;三氯乙酸、磷酸二氢钠、磷酸氢二钠、氯化钾均为分析纯。
Jeltec 2300蛋白自动分析仪丹麦FOSS公司;Metrohm809自动电位滴定仪瑞士万通公司;SUNRISE吸光酶标仪瑞士TECAN公司;3K30高速冷冻离心机德国Sigma公司;Delta320精密pH计梅特勒-托利多仪器(上海)有限公司;DK-S24型恒温水浴锅上海信森实验仪器厂有限公司;THZ-82型水浴恒温振荡器金坛精达仪器制造厂;T50型均质机德国IKA公司。
1.2实验方法
1.2.1罗非鱼肉组分蛋白的分离制备肌浆蛋白的提取:参照Hashimo[16]和Visessangua等[17]方法,有所修改。取绞碎的罗非鱼鱼糜60g与4倍体积磷酸缓冲液(0.05mol/L,pH7.5,4℃)混匀,冰浴条件下用高速组织匀浆机10000r/min间歇性匀浆1min,匀浆液4℃下10000r/min离心20min,收集上清液Ⅰ,将残渣Ⅰ再与4倍体积的磷酸缓冲液混匀,重复上述步骤,收集上清液Ⅱ。将上清液Ⅰ与Ⅱ混合,缓慢加入4倍体积5%的TCA溶液,室温静置1h后离心(10000r/min,20min,4℃),收集沉淀即为肌浆蛋白组分。
肌原纤维蛋白和基质蛋白的提取:参照Visessanguan[17]和Saito等[18]方法,有所修改。将提取肌浆蛋白后的残渣Ⅱ与4倍体积磷酸缓冲液(0.1mol/L, pH7.5,4℃,含1.1mol/L KCl)混合,冰浴条件下用高速组织匀浆机10000r/min间歇性匀浆1min,匀浆液4℃下10000r/min离心20min,收集上清液Ⅲ,将残渣Ⅲ再与4倍体积磷酸缓冲液混匀,重复上述步骤,收集上清液Ⅳ。将上清液Ⅲ与Ⅳ混合,即为肌原纤维蛋白组分,残渣Ⅳ即为基质蛋白组分。
将上述提取的各组分蛋白4℃透析24h后离心(10000r/min,10min,4℃),去掉上清液后于-20℃冻藏备用。
1.2.2罗非鱼肉及组分蛋白酶解产物的制备基于实验室以往的研究,将罗非鱼糜与蒸馏水以1∶2(m/V)比例混匀,在各酶最适的pH、温度下,按0.5%(酶与鱼糜质量比)的加酶量分别加入胃蛋白酶、中性蛋白酶、Alcalase2.4L,分别水浴振荡酶解1、2、4、6、8h。酶解结束时,置沸水中灭酶15min,冷却后离心(10000r/min,10min,4℃),取上清液抽滤,滤液即为罗非鱼肉蛋白酶解液。
将提取的各组分蛋白用蒸馏水(4℃)稀释成蛋白含量约4%(w/w)的蛋白溶液,匀浆后,将蛋白溶液pH调节至7.5,根据中性蛋白酶酶解鱼肉的加酶量,按照2.5%(酶与蛋白质量比)加入中性蛋白酶,45℃下恒温水浴振荡酶解4h。酶解至终点时于沸水中灭酶15min,冷却后离心(10000r/min,10min,4℃),取上清液抽滤,滤液即为组分蛋白酶解液。
1.2.3蛋白回收率和水解度的测定原料中总氮含量采用半微量凯氏定氮法测定[19];酶解液中总氮含量采用半微量凯氏定氮法测定[19];酶解液中氨基酸态氮含量采用甲醛电位滴定法测定[20]。蛋白回收率按照式(1)计算;水解度按式(2)计算。

1.2.4清除羟自由基能力的测定参照Jin等[21]方法,有所修改。取0.6mL 5mmol/L邻二氮菲的无水乙醇溶液,加入0.4mL 0.15mol/L pH7.4磷酸盐缓冲液混匀后加入0.6mL 0.75mmol/L的FeSO4溶液,摇匀后加入样品液2mL,再加入0.4mL体积分数0.1%的H2O2混匀,37℃水浴1h,取出在536nm处测吸光值为A样品;以去离子水代替样品液和H2O2溶液重复上述操作,测吸光值为A未损伤;以去离子水代替样品液重复以上操作,测得吸光值为A损伤。按公式(3)计算羟自由基的清除率:

式中:A样品为样品组的吸光度;A损伤为损伤管的吸光度;A未损伤为未损伤管的吸光度。
1.2.5清除DPPH自由基能力的测定参照Baea等[22]方法,有所修改。取2mL样液,加入2mL 0.15mmol/L DPPH溶液(用95%的乙醇溶解),混匀后在室温条件下避光反应30min,于517nm波长处测吸光度Ai,对照组为2mL 95%的乙醇溶液代替DPPH溶液,在517nm波长处测定吸光度Aj,空白组为2mL DPPH溶液加上2mL 95%的乙醇溶液,于517nm波长处测定吸光度A0。按式(4)计算DPPH自由基清除率。
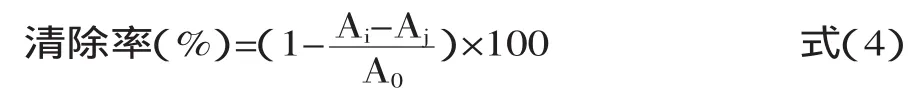
式中:A0为空白组吸光度;Ai为样品组吸光度;Aj为对照组吸光度。
1.2.6数据处理实验均平行测定三次,结果以平均值±标准差表示,采用Excel 2007对数据进行整理,SPSS 19.0软件进行数据统计分析。
2 结果与分析
2.1不同蛋白酶酶解过程的蛋白回收率和水解度

图1 不同蛋白酶蛋白回收率的比较Fig.1 Comparison of recovery rate of protein of hydrolysates by different protease
由图1可以看出,在整个酶解过程中,中性蛋白酶酶解液的蛋白回收率较其他蛋白酶要高,酶解8h时蛋白回收率达71.0%,Alcalase2.4L酶解液蛋白回收率次之,最高达61.7%(8h),胃蛋白酶酶解液回收率最高达38.9%(8h);这与赵珊珊等[14]研究的Alcalase2.4L比Neutrase 1.5MG蛋白回收率要高的结论稍有出入,可能与酶的来源、酶活以及酶解条件不同有关。从蛋白回收率来看,中性蛋白酶是酶解罗非鱼肉蛋白的最佳用酶。
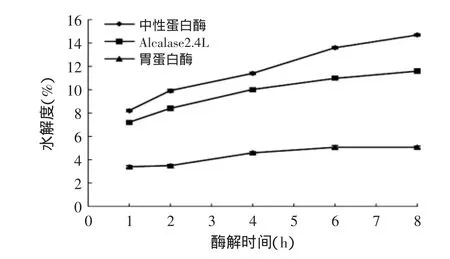
图2 不同蛋白酶的水解度比较Fig.2 Comparison of DH of hydrolysates by different proteases
从图2可知,在整个酶解过程中,酶解液水解度由高到低依次为中性蛋白酶、Alcalase2.4L、胃蛋白酶,酶解8h时分别达14.7%、11.6%、5.1%,研究结果与韩道财等[13]、朱志伟等[23]的研究一致,中性蛋白酶表现出了高水解度的特点;Alcalase2.4L是一种深度水解蛋白酶,但在酶解中并没有表现出很高的水解度,可能是其水解能力没有得到充分利用,与其他酶复合使用可能效果更好;胃蛋白酶酶解液水解度较低可能与酶解前进行的酸度调节使蛋白有了一定程度变性有关。
2.2不同蛋白酶酶解过程中羟自由基ⅠC50值

图3 不同蛋白酶酶解液清除羟自由基能力的比较Fig.3 Comparison of scavenging·OH abilities of hydrolysates by different proteases
·OH是危害性最大的一种活性氧分子,它能够氧化邻二氮菲-Fe2+成邻二氮菲-Fe3+,当有抗氧化物存在时,它的生成就会被抑制,从而产物在536nm处的吸收峰发生变化[24-25]。从图3可以看出,在整个酶解过程中,羟自由基IC50值由低到高分别为胃蛋白酶、中性蛋白酶、Alcalase2.4L,胃蛋白酶在酶解6h时羟自由基的清除能力最强,IC50值为1.691mg/mL,中性蛋白酶酶解液在4h时羟自由基的清除能力最强,IC50值为3.828mg/mL,Alcalase2.4L同样也是在酶解4h时达到最好的羟自由基清除效果,IC50值为18.951mg/mL;研究结果与马赛蕊等[15]研究得出胃蛋白酶酶解罗非鱼肉蛋白能够获得最强清除羟自由基能力酶解液的结论一致。
2.3不同蛋白酶酶解过程中DPPH自由基ⅠC50值

图4 不同蛋白酶酶解液清除DPPH自由基能力的比较Fig.4 Comparison of DPPH·scavenging activity of hydrolysates by different proteases
DPPH自由基在517nm处有最大的吸收值,自由基清除剂可以与其进行单电子配对而使吸光值下降,研究还表明,当清除剂有游离羟基存在时,能够极快降低DPPH自由基浓度[26-27]。如图4所示,胃蛋白酶酶解液清除DPPH自由基的能力比较强,在酶解6h时IC50值降至最低,为2.324mg/mL,中性蛋白酶在酶解4h时获得最强清除DPPH自由基的能力,IC50值为3.042mg/mL,Alcalase2.4L清除羟基自由基的能力较弱,在6h时IC50值最低,为8.491mg/mL;胃蛋白酶酶解液的蛋白回收率和水解度都较低,但其清除自由基的能力却最强,这与杨铭铎等[28]得出的结论一致,水解度和抗氧化活性不一定成正比;综合图3可知,胃蛋白酶和中性蛋白酶都分别在酶解6h和4h获得最强清除自由基的能力,Alcalase2.4L则分别在4、6h获得最强清除羟自由基、DPPH自由基的能力;结合蛋白回收率和水解度,选取中性蛋白酶酶解4h来获取抗氧化活性的酶解液。
2.4不同组分蛋白酶解液蛋白回收率和水解度

图5 不同组分蛋白蛋白回收率比较Fig.5 Comparison of recovery rate of protein of hydrolysates by different component proteins
选取中性蛋白酶酶解分离提取的罗非鱼肉3种组分蛋白(基质蛋白、肌浆蛋白、肌原纤维蛋白),得到酶解液的蛋白回收率如图5所示。其中基质蛋白酶解液的蛋白回收率最高,为89.8%,肌原纤维蛋白次之,为68.2%,肌浆蛋白最低,为40.1%;研究结果与任娇艳等[29]用Neutrase1.5MG酶解草鱼3种分离组分蛋白得出的蛋白回收率有些差异,这可能与酶的来源以及不同种类鱼的组分蛋白结构不同有关;通过比较各种组分蛋白的蛋白回收率可以推断出,在中性蛋白酶酶解罗非鱼肉蛋白时,基质蛋白组分对酶解的蛋白利用率贡献最大。

图6 不同组分蛋白的水解度比较Fig.6 Comparison of DH of hydrolysates by different component proteins
从图6可以看出,3种分离的组分蛋白中,肌原纤维蛋白酶解液的水解度最高,为10.1%,基质蛋白酶解液的水解度为8.3%,肌浆蛋白水解度最低,为4.7%,组分蛋白的水解度偏低可能与蛋白分离提取时使用的盐提取、酸沉淀导致蛋白结构改变、部分变性有关;从水解度的角度来看,肌原纤维蛋白组分在酶解中对水解度的影响最大。
2.5不同组分蛋白酶解液羟自由基ⅠC50值

图7 不同组分蛋白酶解液清除羟自由基能力的比较Fig.7 Comparison of scavenging·OH abilities of hydrolysates by different component proteins
由图7可知,3种组分蛋白中,肌浆蛋白酶解液清除羟自由基的能力最好,IC50值为12.352mg/mL,其次为基质蛋白酶解液,IC50值为14.986mg/mL,肌原纤维蛋白酶解液清除羟自由基的效果最差,IC50值为16.626mg/mL;这可能是木瓜蛋白酶的特异酶切位点作用于肌浆蛋白时能够生成较强抑制羟自由基的活性物质。从图7的比较中可以判断出,中性蛋白酶酶解罗非鱼肉蛋白时,肌浆蛋白组分是完整鱼肉蛋白中清除羟自由基最好的组分。
2.6不同蛋白组分酶解液DPPH自由基ⅠC50值

图8 不同组分蛋白酶解液清除DPPH自由基能力的比较Fig.8 Comparison of DPPH·scavenging activity of hydrolysates by different component proteins
对比各种不同蛋白组分酶解液DPPH自由基IC50值可以看出,肌浆蛋白组分清除DPPH自由基的能力最强,IC50值为3.554mg/mL,远低于基质蛋白、肌原纤维蛋白酶解液的IC50值,分别为13.389、14.886mg/mL;可以得知,罗非鱼肉蛋白在中性蛋白酶酶解4h时,完整鱼肉蛋白中清除DPPH自由基最好的组分是肌浆蛋白组分。
3 结论
3.1通过对比三种蛋白酶酶解罗非鱼肉蛋白酶解产物的各项指标可知,中性蛋白酶酶产物的蛋白回收率和水解度最好,远高于胃蛋白酶酶解液,而两者的抗氧化活性相差不大,并且胃蛋白酶酶解时需加酸调节pH,后续酶解液会有脱盐的问题,因此选取中性蛋白酶酶解罗非鱼肉蛋白,酶解时间4h。
3.2对比比较罗非鱼肉组分蛋白酶解液的各项指标可得,在中性蛋白酶酶解罗非鱼肉蛋白过程中,对蛋白回收率、水解度、清除羟自由基和DPPH自由基能力影响最大的组分分别为基质蛋白、肌原纤维蛋白、肌浆蛋白、肌浆蛋白,这为罗非鱼肉酶解机理的研究提供了一定的参考。
3.3对罗非鱼肉各组分蛋白进行了酶解,对酶解机理进行初步探索,当前这方面的研究还比较少;同时,相对用蛋白酶直接酶解罗非鱼肉蛋白,酶解组分蛋白得到的酶解产物可能更纯,这为后续酶解液的分离纯化提供了一些思路。
[1]Dai H N,Zhong JQ,Bomi R,et al.In vitro antioxidant activity of a peptide isolated from Nile tilapia(Oreochromis niloticus)scale gelatin in free radical-mediated oxidative systems[J].Journal of Functional Foods,2010,2(2):107-117.
[2]Samaranayakaa G P,Li-chan E C Y.Autolysis-assisted production of fish protein hydrolysates with antioxidant properties forms pacific hake(Merluccius productus)[J].Food Chemistry,2008,107:768-776.
[3]Da YZ,Tang Y,Zhu BW,et al.Antioxidant activity of hydrolysates obtained from scallop(Patinopecten yessoensis)and abalone(Haliotis discus hannai Ino)muscle[J].Food Chemistry,2012,132(2):815-822.
[4]You LJ,Zhao MM,Cui C,et al.Effect of degree of hydrolysis on the antioxidant activity of loach(Misgurnus anguillicaudatus)protein hydrolysates[J].Innovative Food Science and Emerging Technologies,2009,10(2):235-240.
[5]丁利君,何颖基,梁燕.非洲鲫鱼蛋白酶解物的抗氧化研究[J].食品研究与开发,2009,30(11):1-5.
[6]邓敏,朱志伟,欧善堂,等.利用响应面法优化酶解罗非鱼制备抗氧化肽的研究[J].现代食品科技,2011,27(10):1242-1245.
[7]尤娟,罗永康,沈慧星,等.酶法制备鲢鱼蛋白抗氧化肽研究[J].渔业现代化,2010,37(3):42-47.
[8]阎欲晓.罗非鱼活性肽分离及抗氧化能力研究[J].水产科学,2009,28(5):276-279.
[9]胡晓,孙恢礼,李来好,等.我国酶解法制备水产功能性肽的研究进展[J].食品工业科技,2012,33(24):410-413.
[10]陈胜军,李来好,杨贤庆,等.罗非鱼综合加工利用与质量安全控制技术研究进展[J].南方水产科学,2011,7(4):85-90.
[11]唐小丹,周春霞,洪鹏志,等.罗非鱼肉蛋白的分离及其性质研究[J].食品科技,2011,36(6):156-159,166.
[12]刘在军,岑剑伟,李来好,等.罗非鱼血液综合利用的研究思路及展望[J].南方水产科学,2012,8(2):76-80.
[13]韩道财,洪鹏志,杨萍.均匀设计法优化罗非鱼肉富肽酶解液制备工艺[J].食品研究与开发,2012,33(1):155-158.
[14]赵珊珊,朱志伟,曾庆孝,等.不同蛋白酶酶解罗非鱼肉制备蛋白水解液的过程变化规律研究[J].现代食品科技,2008,24(2):115-119.
[15]马赛蕊,胡晓,吴燕燕,等.罗非鱼肉蛋白酶解液的抗氧化活性[J].食品科学,2012,33(19):52-56.
[16]Hashimoto K,Watabe S,Kono M,et al.Muscle protein composition of sardine and mackerel[J].Bull Jpn Soc Sci Fish,1979,45:1435-1441.
[17]Visessanguan W,Benjakul S,Riebroy S,et al.Changes in composition and functional properties of proteins and their contributions to Nham characteristics[J].Meat Sci,2004,66:579-588.
[18]Saito T.Effect of thermal on extraction of proteins from meats[J].Bull Jpn Soc Sci Fish,1983,46:1569-1597.
[19]张意静.食品分析技术[M].北京:中国轻工业出版社,2001:186-194.
[20]朱俭.生物化学实验[M].上海:上海科学技术出版社,1987:100-159.
[21]Jin M,Cai YX,Li JR,et al.1,10-Phenanthroline-Fe2+oxidative assay of hydroxyl radical produced by H2O2/Fe2+[J]. Progress in Biochemistry and Biophysics,1996,23(6):553-555.
[22]Baea S H,Suh H J.Antioxidant activities of five different mulberrycultivarsinKorea[J].LWT-FoodScienceand Technology,2006,40(3):955-962.
[23]朱志伟,曾庆孝,林奕封.采用控制酶解法从罗非鱼肉中制备血管紧张素转化酶抑制肽[J].食品与发酵工业,2004,30(12):71-76.
[24]何婷.蓝园鲹蛋白控制酶解及酶解物抗氧化特性研究[D].广州:华南理工大学,2008.
[25]李琳,赵谋明.鳙鱼蛋白酶解液清除自由基的研究[J].水产科学,2005,24(10):15-18.
[26]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrinemulsion[J].JournalofAgriculturalandFood Chemistry,1992,40(6):945-948.
[27]Bondet V,Brand W W,Berset C.Kinetics and mechanisms of antioxidant activity using the DPPH·free radical method[J]. Food Science and Technology,1997,30(6):609-615.
[28]杨铭铎,吴莹莹,张洪微.不同酶解法水解黑龙江小麦麦胚蛋白的抗氧化功能比较研究[J].食品科学,2011,32(2):124-126.
[29]任娇艳.草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D].广州:华南理工大学,2008.
Antioxidant activities of tilapia(Oreochromis niloticus)protein and component proteins hydrolysates
CHEN Xing-xing1,2,HU Xiao1,LI Lai-hao1,*,YANG Xian-qing1,WU Yan-yan1,LIN Wan-ling1,CHEN Sheng-jun1,HAO Shu-xian1,WEI Ya1
(1.KeyLaboratoryofAquaticProductProcessing,MinistryofAgriculture,NationalR&DCenterforAquatic,ProductProcessing,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China;2.College of Food Science and Technology,Shanghai Ocean University,Shanghai 201306,China)
Pepsin,neutral protease,Alcalase2.4L were used to hydrolyse the tilapia protein,respectively.The effect of hydrolysis and antioxidant activities including 1,1-diphenyl-2-picrylhydrazine(DPPH·)and hydroxyl radical(·OH)of hydrolysates hydrolysed by different proteases for 1,2,4,6,8h were studied and compared,the results showed that the hydrolysates of three proteases all had antioxidant activities,the hydrolysate of neutral protease had the highest degree of hydrolysis(DH)and the recovery rate of protein,the hydrolysate of pepsin had the minimum IC50value of DPPH·and·OH scavenging ability.Neutral protease was selected to hydrolyse sarcoplasmic protein,myofibrillar protein and stroma protein for 4h,the effect of hydrolysis and antioxidant activities of hydrolysates were studied and compared.The results indicated that the hydrolysate of stroma protein had the highest recovery rate of protein that was 89.8%,the hydrolysate of myofibrillar protein had the highest DH that was 10.1%,the hydrolysate of sarcoplasmic protein had the minimum IC50value of·OH and DPPH·scavenging ability that were 12.352mg/mL and 3.554mg/mL.
tilapia;component protein;hydrolysis;antioxidant activity
TS254.1
A
1002-0306(2015)10-0105-05
10.13386/j.issn1002-0306.2015.10.013
2014-08-14
陈星星(1990-),女,在读硕士研究生,研究方向:水产品加工和质量安全。
李来好(1963-),男,博士,研究员,研究方向:水产品加工和质量安全。
国家现代农业产业技术体系(CARS-49);国家海洋公益性项目(201305018);国家自然科学基金项目(31301454);广东省科技计划重点项目(2011A020102005)。

