红曲霉液态发酵生产红曲色素的工艺优化
张锐
(包头轻工职业技术学院,包头 014035)
红曲霉液态发酵生产红曲色素的工艺优化
张锐
(包头轻工职业技术学院,包头 014035)
为提高红曲色素的液态发酵水平,降低生产成本,采用Plackett-Burman试验与Box- Benhnken试验对红曲霉MY-03液态发酵生产红曲色素的工艺条件进行了优化,获得了最佳工艺条件:葡萄糖50 g/L、蛋白胨58.07 g/L、MgSO42 g/L、NaNO32 g/L、MnSO40.3 g/L、ZnSO40.1 g/L、装瓶量50.8 mL、接种量10.0%(V/V),于150 r/min、30℃恒温培养7 d,红曲色素色价可达342.24±2.88 U/mL,比基础培养基提高了86.9%。
红曲霉;液态发酵;红曲色素;响应面法
红曲色素是红曲霉生长过程中产生的次级代谢产物,主要有3类6种,即:红色素Monascorubramine与Rubropunctamine、橙色素Monascorubin与Rubropunctatin、黄色素Ankaflavin与Monascin[1]。红曲色素具有较强的耐光性与耐热性,对酸、碱、氧化剂与还原剂均较稳定,有着色、防腐、保健和药用等价值,是安全性最高的食用色素之一,广泛地应用于食品、饲料和医药等领域[2-4]。此外,红曲霉在产生色素的同时,还能产生莫纳可林K与γ-氨基丁酸等具有降血压、降胆固醇和降血脂作用的多种次级代谢产物[5,6],红曲色素类产品也因含有这些功能性成分而具有一定的保健价值,深受消费者欢迎,市场需求日益增加,应用领域不断扩展。
红曲色素的生产方式主要有固态发酵和液态发酵两种。固态发酵是传统生产方式,也是目前最主要的生产方式,但生产效率低、发酵条件不容易控制、易污染,不适合大规模的工业化生产[7-10]。相比较而言,液态发酵不易污染、培养条件易控制、生产效率高,更适合大规模工业化生产,但红曲霉在液态发酵时产红曲色素的能力较低,仅仅为固态发酵时的10%-20%,这严重制约着液态发酵的推广与应用[4,11-13]。因此,选育适于液态发酵产红曲色素的高产菌株、优化液态发酵工艺、提高发酵水平,已成为国内外研究的热点[14,15]。
响应面方法(Response surface methodology,RSM)是一系列统计技术的合称,包括试验设计、建模、因子效应评估以及寻求因子最佳操作条件,已成功地应用于多种产品的发酵工艺优化,其中包括红曲色素的固态发酵工艺[4],但用于红曲色素液态发酵工艺优化的报道较少[16]。本研究采用响应面法对实验室选育的红曲色素高产菌株紫色红曲霉MY-03的液态发酵工艺进行优化,研究影响液态发酵时红曲色素产量的主要因素并确定其最佳水平,旨在提高红曲色素产量,为工业化生产做好技术储备。
1 材料与方法
1.1 材料
1.1.1 菌种 紫色红曲霉MY-03(Monascus purpureus MY-03),由包头轻工职业技术学院生物工程与技术实验中心选育保存。
1.1.2 培养基 菌种保藏培养基:马铃薯葡萄糖琼脂培养基(PDA);种子培养基(g/L):葡萄糖30、蛋白胨20、KH2PO41、MgSO41、pH值自然;基础发酵培养基:葡萄糖60、蛋白胨20、MgSO41、NaNO32、MnSO40.1、ZnSO40.1、pH自然。
1.1.3 主要仪器和试剂 752型紫外分光光度计:上海菁华科技仪器有限公司;台式低速离心机:上海安亭科学仪器厂;HH-4型数显恒温水浴锅:龙口市先科仪器公司;DHZ-D大容量全温振荡器:太仓市实验设备厂;HJ-CF-2D型双人净化工作台:上海苏净实业有限公司;葡萄糖,麦芽糖,甘油,蔗糖,蛋白胨,无水乙醇,无机盐等试剂均为国产分析纯。
1.2 方法
1.2.1 培养方法 试管菌种培养:挑取1环紫色红曲霉MY-03菌种接种于PDA斜面培养基中,于30℃恒温培养7 d,置于4℃冰箱中保存备用。三角瓶种子培养:向已培养好的试管斜面菌种中注入5 mL无菌水,刮取孢子,制成孢子悬液,吸取1 mL接种于装有100 mL种子培养基的250 mL三角瓶中,于150 r/min、30℃恒温培养48 h。液态发酵:将种子液按照一定的接种量接入装有100 mL发酵培养基的250 mL三角瓶中,于150 r/min、30℃恒温培养7 d。
1.2.2 红曲色素的提取与色价测定 取10 mL发酵液,于4 000 r/min离心15 min,取上清液1 mL,加入70%的乙醇9 mL,于60℃保温1 h,用70%的乙醇进行适当稀释后按照GB4926-2008《中华人民共和国国家标准—食品添加剂 红曲米(粉)》规定的方法测定色价[17,18]。
1.2.3 红曲霉液态发酵产红曲色素的工艺优化单因素试验设计 以1.2.1中的液态基础发酵培养基为基础,考察不同碳源、氮源、无机盐、微量元素、装瓶量、接种量等因素对发酵产红曲色素的影响。
1.2.4 Plackett-Burman试验 在单因素试验的基础上,采用8因素的Plackett-Burman试验设计考察碳源、氮源、无机盐、装瓶量和接种量等因素对红曲色素产量的影响,以评价各因素的影响显著性程度。各因素及其水平见表1,试验设计与数据分析均采用 Design Expert 7.1(Stat-Ease Corp.,Minneapolis,MN,USA)。

表1 Plackett-Burman试验设计的因素和水平
1.2.5 Box-Behnken试验设计 对Plackett-Burman试验中影响显著的3个因素(蛋白胨、装瓶量与接种量)设计Box-Behnken中心组合试验,其因素与水平见表2。为使拟合方程具有旋转型和通用性,中心点重复5次。试验数据采用Design Expert 7.1(Stat-Ease Corp.,Minneapolis,MN,USA)进行多元回归分析并构建二次多项式数学模型:
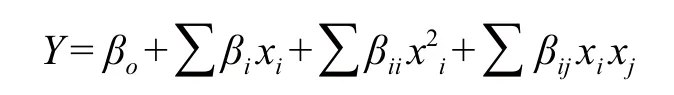
式中,Y为红曲色素色价(U/mL),xi、xj为自变量编码值,βo为常系数,βi为线性系数,βii为二次项系数,βij为交互项系数。

表2 Box-Behnken中心组合试验的因素和水平
2 结果
2.1 碳源种类及其添加量对红曲色素产量的影响
碳源是微生物生长代谢最重要的营养物质之一。碳源物质用来供给菌体生命活动所必需的能量和构成菌体细胞及各种代谢产物。常用的碳源包括各种能迅速利用的单糖(如葡萄糖、果糖等)、双糖(如蔗糖、麦芽糖等)和缓慢利用的淀粉等多糖。
分别以60 g/L的葡萄糖、蔗糖、麦芽糖、甘油、可溶性淀粉、大米粉、玉米粉为碳源,其它成分同液态基础发酵培养基(1.2.1)。进行液态发酵后,根据发酵液的色价确定最适碳源。试验结果见表3和图1。

表3 不同碳源发酵液的形态和菌丝体干重量

图1 碳源对红曲色素产量的影响
根据上述试验确立的最适碳源基础上进行碳源含量优化试验。分别取碳源含量20、40、60、80、100和120 g/L 6个水平。进行液态发酵后,根据发酵液的色价确定最佳碳源的含量。试验结果见图1。
不同碳源对红曲色素产量的影响(图2)显示,葡萄糖作为碳源时,红曲色素的产量最高,与淀粉、甘油、大米粉、蔗糖、麦芽糖等其它原料作碳源时的发酵水平有极显著差异(P<0.01)。因此,葡萄糖是紫色红曲霉MY-03液态发酵生产红曲色素的最适碳源。

图2 葡萄糖含量对红曲色素产量的影响
由图2所示,葡萄糖含量过高或过低都不利于代谢产物红曲色素的产生,葡萄糖过少,不能给菌株提供充足的能源,不利于产生更多的红曲色素;葡萄糖过多,使菌种一直处于优越的环境,菌丝体繁殖旺盛,但不利于红曲色素的产生。当葡萄糖含量为60 g/L时,红曲色素的产量最高,为200.56 U/mL。
2.2 氮源种类及其添加量对红曲色素产量的影响
氮是构成微生物细胞蛋白质和核酸的主要元素,因此是菌体生长以及代谢产物形成所必需的。为探索出紫色红曲霉液态发酵产红曲色素的最佳氮源,本试验在加有最适含量碳源的基础培养基中分别加入25 g/L的蛋白胨、酵母浸膏、豆粕、尿素、硝酸铵、硫酸铵、氯化铵,其它成分同基础发酵培养基(加有60 g/L的葡萄糖)。进行液态发酵后,根据发酵液的色价确定最适氮源。试验结果见表4和图3。

表4 不同氮源发酵液的形态和菌丝体干重量
根据上述试验确立的最适氮源基础上进行碳源含量优化试验。分别取氮源含量10、15、20、25、30、40、45和50 g/L 8个水平。进行液态发酵后,根据发酵液的色价确定最佳氮源的含量。试验结果(图4)显示,不同的氮源对其红曲色素的影响很大,尤其是对其色调的影响。通过试验发现硝酸铵、氯化铵为氮源时,发酵液为橘黄色,其原因可能是二者中的NH4+能抑制红曲红色素的合成与分泌,从而使其黄色素占有较大比重。不同氮源对红曲色素产量的影响(图3)显示,蛋白胨作为氮源时,红曲色素的产量远高于酵母膏、豆粕、尿素和无机氮等作为氮源的产量,达到了极显着水平(P<0.01)。因此,在所考察的这6种氮源中,宜选择蛋白胨为紫色红曲霉MY-03液态发酵产红曲色素的最适氮源。

图3 氮源对红曲色素产量的影响
由图4所示,蛋白胨含量过多或过少都不利于代谢产物红曲色素的产生,蛋白胨过少,不能给菌株供充足的氮源,C/N比过高,导致菌体过速生长,不能产生更多的红曲色素;蛋白胨过多,使菌丝体生长不好,不利于红曲色素的产生。当蛋白胨含量为40 g/L与45 g/L时,红曲色素的色价分别为294.88 U/mL与299.06 U/mL,色价相差不大,而为减少成本,固选用蛋白胨的含量为40 g/L,此时C/N比为1.5。

图4 蛋白胨含量对红曲色素产量的影响
2.3 装瓶量对红曲色素产量的影响
装瓶量是影响液态发酵的一个重要因素,因为本试验液态发酵是好氧发酵,溶氧的多少直接影响到发酵状态,然而装瓶量又与溶氧呈正相关,所以装瓶量对红曲霉液态发酵产红曲色素有很大的影响。本试验分别加入25、50、75、100、125、150和175 mL带有最适碳源和氮源的液态基础发酵培养基于250 mL的三角瓶中。进行液态发酵后,根据发酵液的色价确定最适装瓶量。结果(图5)显示,装瓶量较少(≤25 mL)或较多(≥75 mL)时,红曲色素的产量均较低,当装瓶量为50 mL时,红曲色素的产量最高,为320.67 U/mL。固装瓶量为50 mL最为适宜,说明此时的溶氧效果较好。
2.4 接种量对红曲色素产量的影响
配制含有最适碳源和氮源的液态基础发酵培养基数瓶,分别以2%、4%、6%、8%、10%、12%、14%和16%(V/V)的接种量接种。进行液态发酵后,根据发酵液的色价确定最适接种量。结果(图6)显示,接种量的大小明显影响红曲色素的产量。接种量过少,菌体生长缓慢,发酵时间长,色素产量低;接种量过多,菌丝体大量繁殖,使单位体积内的养料和溶氧不足,影响红曲色素的产量。当接种量为8%时,红曲色素的色价最高,为300.73 U/mL。因此,接种量为8%时最为适宜。
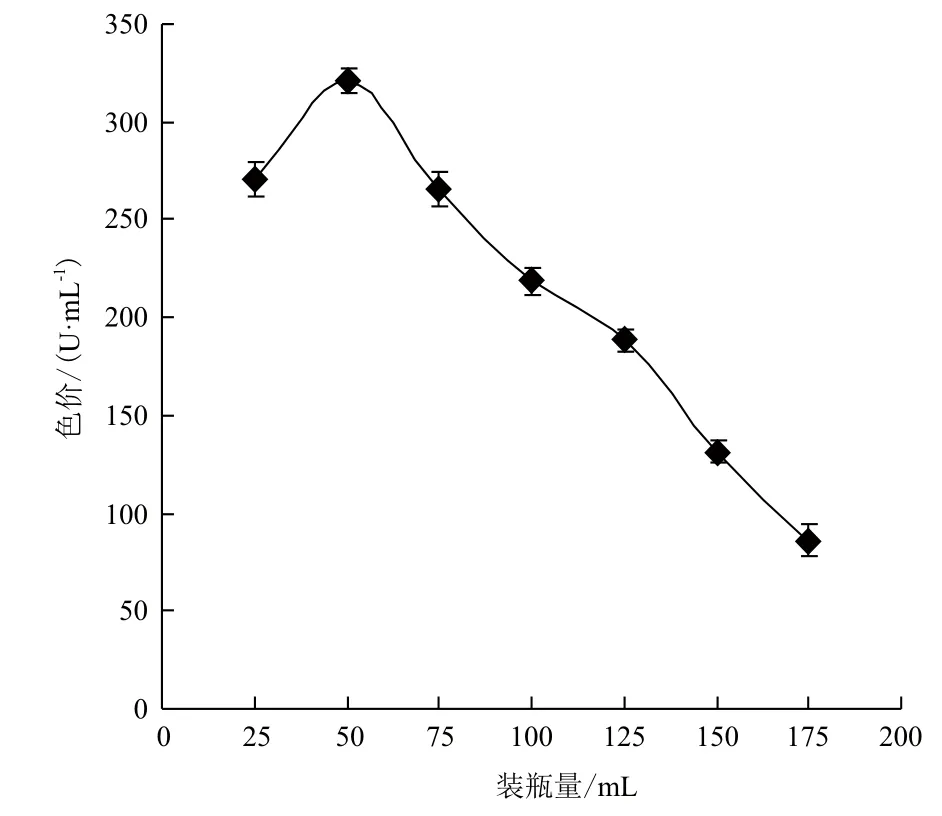
图5 装瓶量对红曲色素产量的影响
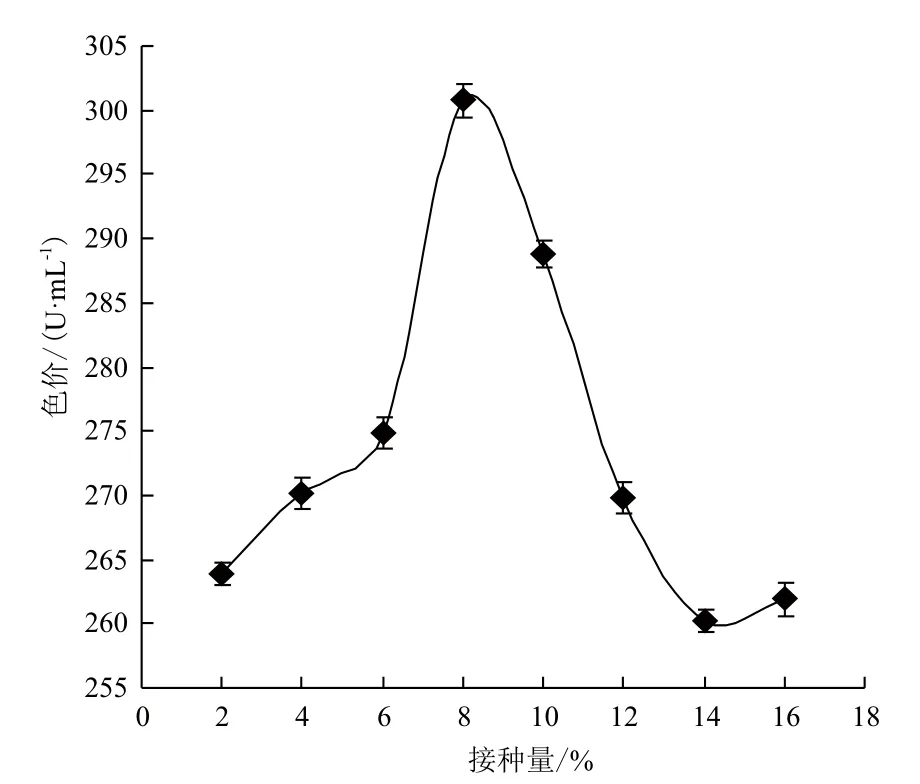
图6 接种量对红曲色素产量的影响
2.5 无机盐对红曲色素产量的影响
分别加入0、1、2、3、4、5和6 g/L的NaNO3及0、0.5、1、2、3、4和5 g/L的MgSO4,其它成分同液态基础发酵培养基(见1.2.1,另加入最适碳源和氮源)。进行液态发酵后,以考察无机盐(NaNO3和MgSO4)对红曲色素产量的影响。结果(图7)显示,无机盐(NaNO3和MgSO4)对红曲色素的产量有一定的影响,总体来说,影响不大。NaNO3对红曲色素产量的影响(图7-A)表明,当NaNO3的含量为4 g/L时,红曲色素的色价最高,为285.60 U/mL;MgSO4对红曲色素产量的影响(图7-B)显示,当MgSO4的含量为3 g/L时,红曲色素的色价最高,为291.63 U/mL。因此,NaNO3和MgSO4的最适宜量分别为4 g/L与3 g/L。
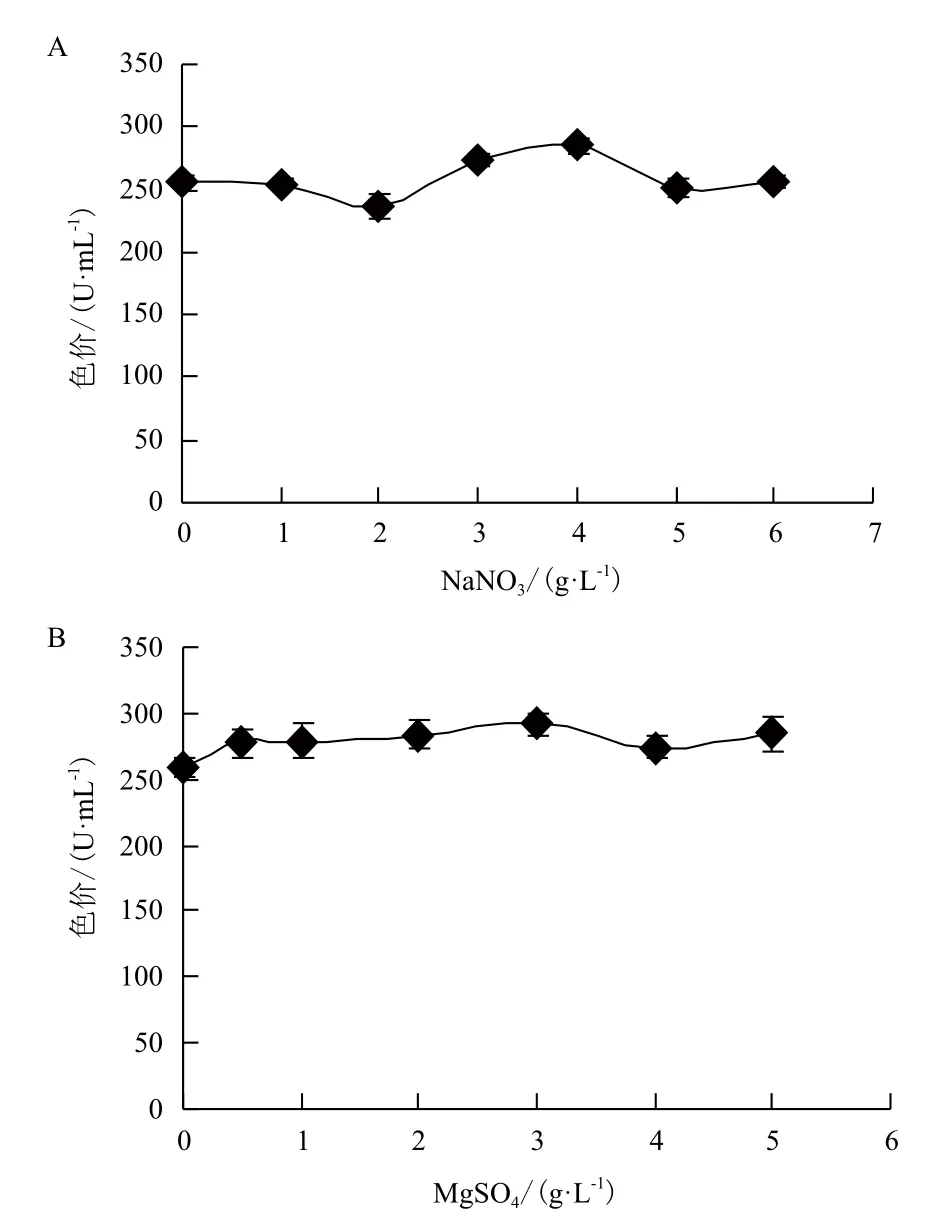
图7 无机盐NaNO3(A)及MgSO4(B)对红曲色素产量的影响
2.6 微量元素对红曲色素产量的影响
分别加入0、0.1、0.2、0.3、0.4、0.5、0.6 g/L的 ZnSO4和0、0.1、0.2、0.3、0.4、0.5、0.6 g/L的MnSO4,其它成分同液态基础发酵培养基(见1.2.1,另加入最适碳源和氮源)。进行液态发酵后,以考察无机盐(Zn和Mn)对红曲色素产量的影响。结果(图8)表明,微量元素对红曲霉液态发酵产红曲色素有一定的影响。ZnSO4,即微量元素Zn对红曲色素产量的影响(图8-A)显示,当ZnSO4的含量为0.1 g/L时,红曲色素的色价最高,为301.95 U/mL;MnSO4,即微量元素Mn对红曲色素产量的影响(图8-B)显示,当MnSO4的含量为0.4 g/L时,红曲色素的色价最高,为312.75 U/mL。因此,ZnSO4和MnSO4的最适宜量分别为0.1 g/L与0.4 g/L。
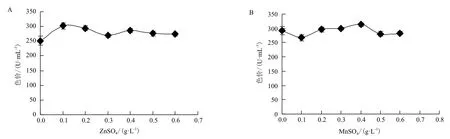
图8 微量元素Zn(A)和Mn(B)对红曲色素产量的影响
2.3 Plackett-Burman试验结果
Plackett-Burman试验结果如表5所示,采用Design Expert 7.1软件对试验数据进行一次多项回归拟合,获得红曲色素色价Y对X1-X8等8个因素的一次回归方程:
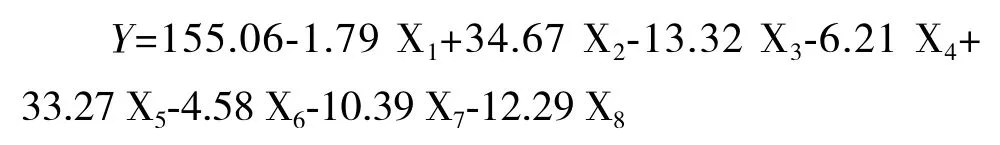
式中,Y为红曲色素色价(U/mL),X1-X8为自变量的编码值。该回归模型极显著(P<0.01),失拟项不显著(P>0.05),相关系数R2=0.960 4,这表明回归方程的拟合度和可信度均较高,试验中96.04%的变异可由该模型进行解释。

表5 Plackett-Burman试验设计与结果
方程系数的方差分析结果(表6)显示,蛋白胨(X2)与接种量(X5)对红曲色素产量的影响达到了极显著水平(P<0.01),为正效应,装瓶量(X3)为显著水平(P<0.05),为负效应;但其它各因素的影响均不显著(P>0.05)。显著性因素(X2、X3与X5等)将采用响应面法进一步优化。X1、X4、X6、X7和X8等非显著性因素由于均为负效应,后续试验直接采用Plackett-Burman设计中的低水平为最佳水平,即葡萄糖50 g/L、MgSO42 g/L、NaNO32 g/L、ZnSO40.1 g/L、MnSO40.3 g/L。
2.4 Box-Behnken中心组合试验
Box-Behnken结果如表7所示,采用Design Ex-pert 7.1软件对试验数据进行二次多项回归拟合,获得红曲色素色价Y对蛋白胨(X2)、装瓶量(X3)和接种量(X5)3个因素的回归方程:
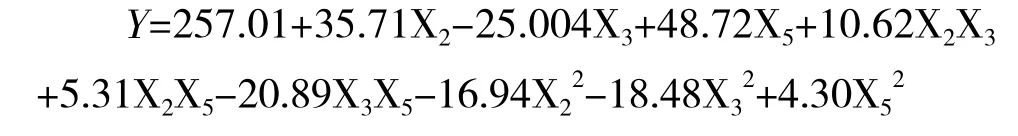
式中,Y为红曲色素色价(U/mL),X2、X3与X5为自变量的编码值。
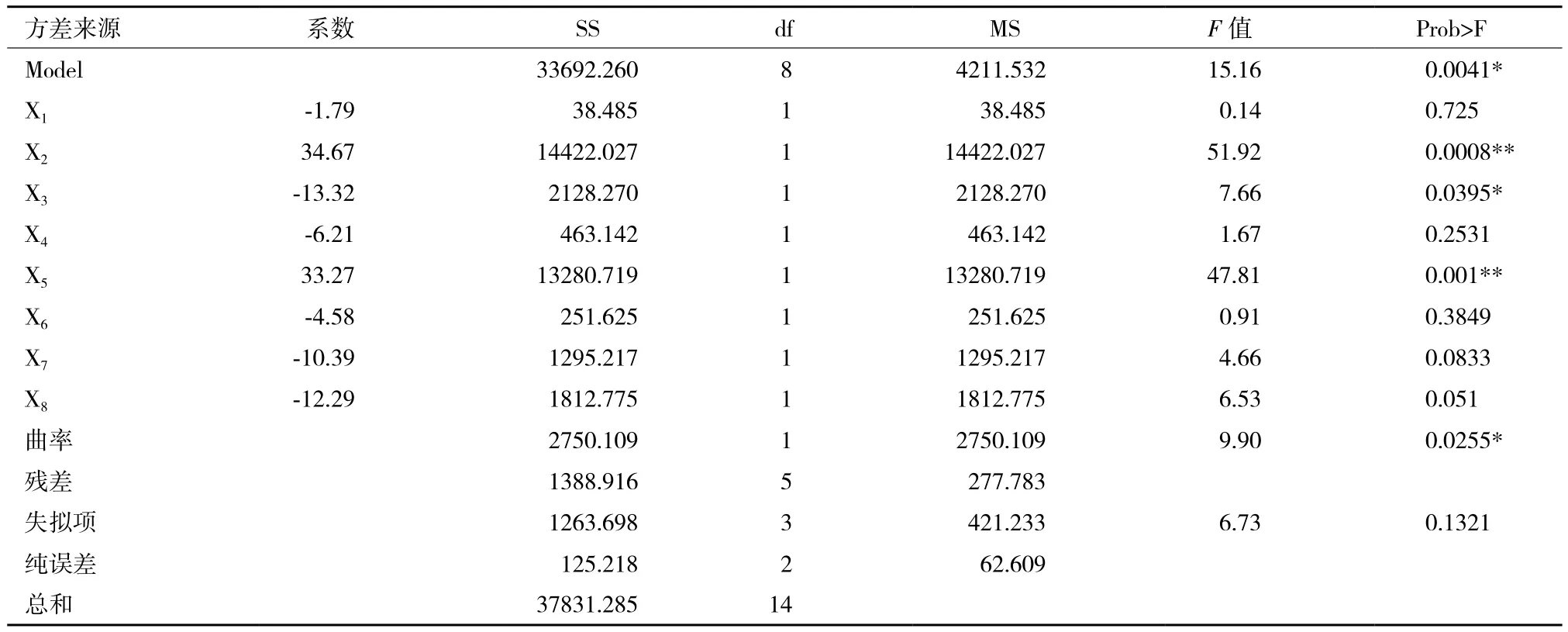
表6 Plackett-Burman试验回归分析结果
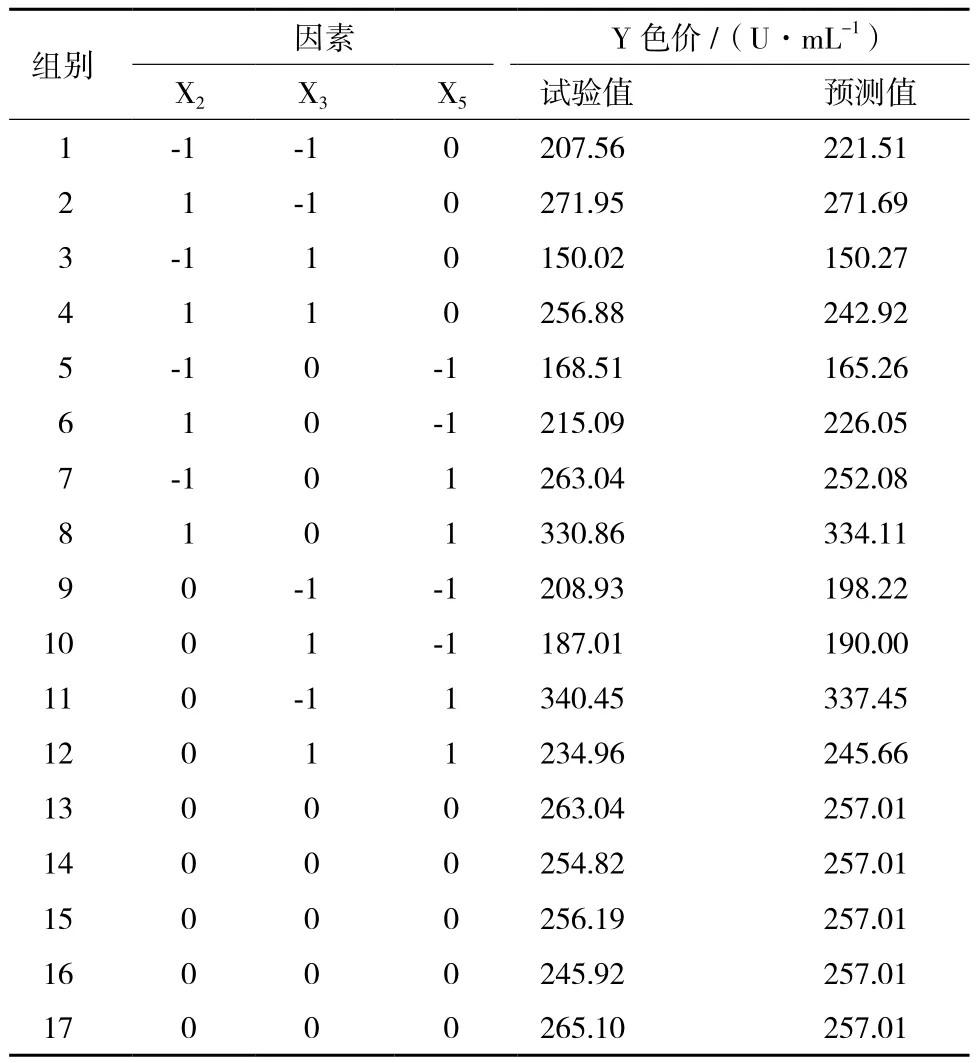
表7 Box-Behnken试验设计和结果
由方差分析结果(表8)可知,回归模型极显著(P<0.01)、失拟项不显著(P>0.05)、模型相关系数R2=0.972 1,这表明回归方程的拟合度和可信度均很高,能够很好地对红曲色素的发酵工艺进行描述与预测。由模型系数的显著性检验结果可知,模型的一次项、交互项X3X5与二次项对红曲色素产量的影响显著(P<0.05),而交互项(X2X3和X2X5)与二次项X52影响不显著(P>0.05)。为了更直观地描述X2、X3和X5等3个因素对响应值的影响,利用Design Expert 7.1软件绘制的响应面图如图9所示,在试验量程内,蛋白胨(X2)和装瓶量(X3)存在一个拐点,此点红曲色素产量最高,但接种量(X5)不存在拐点,红曲色素产量随接种量的增加一直呈上升趋势。模型最佳预测点的各因素编码值可通过对上述二次回归方程求解而获得,即X2=0.91、X3=-0.98、X5=1,解码后可得其真实值,即:蛋白胨58.07 g/L、装瓶量50.8 mL、接种量10.0%(V/V),在此佳条件下,模型预测的红曲色素色价的最大值为351.09 U/mL。为验证模型预测结果的准确性,采用上述最佳条件进行了3次验证试验,实测值为342.24±2.88 U/mL,与预测值十分接近,这说明该模型是准确有效的。
3 讨论
目前,红曲霉主要通过固态发酵或液态发酵的方式进行生产。欧美等西方国家推崇液态发酵,主要是其自动化程度高、劳动强度低、生产效率高;但红曲霉在液态发酵时产红曲色素的水平较低,这严重制约着液态发酵的推广与应用[4,13]。本研究通过单因素试验、P-B试验和响应面试验对发酵条件进行了系统的优化,分别选择葡萄糖和蛋白胨是紫色红曲霉MY-03液态发酵生产红曲色素的最适碳源和最适氮源,此结果与黄林等[13]的研究结果一致,但在王广峰[11]和熊晓辉等[19]的研究中玉米粉是最佳碳源,在陈蕴等[20]的研究中,大豆水解液是最佳氮源,这是因为所采用的红曲霉菌株不同,其生理特性也有差异,同时优化了其他发酵条件。在最佳液态发酵条件下,紫色红曲霉MY-03红曲色素的色价为342.24±2.88U/mL,此发酵水平高于目前文献报道的红曲色素液态发酵的生产水平[11-13],对红曲色素的生产具有一定的指导意。。

表8 二次回归模型的回归分析结果
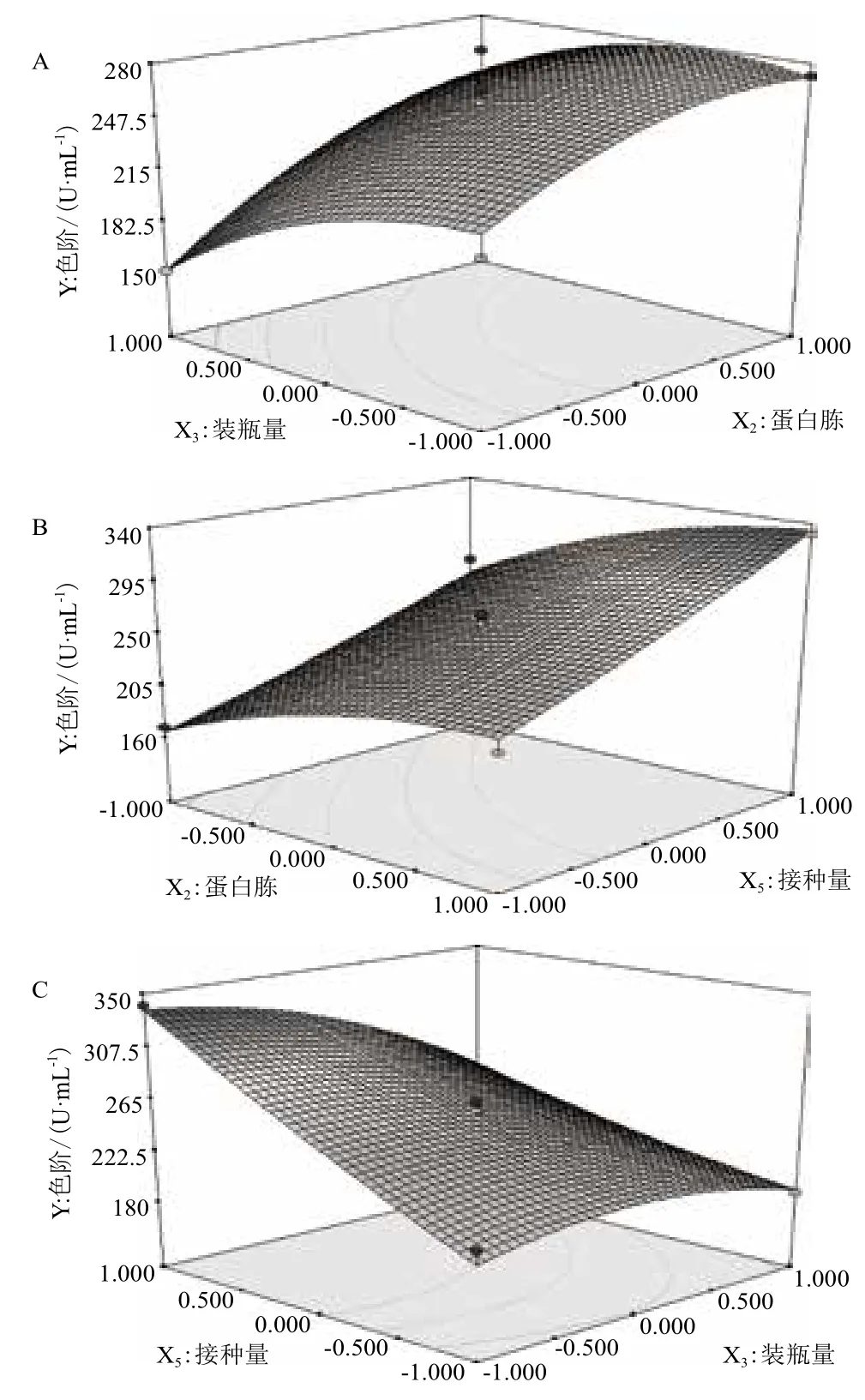
图9 蛋白胨、装瓶量与接种量影响红曲色素色价的响应面图
4 结论
本研究通过单因素试验、Plackett-Burman试验与Box-Behnken试验对红曲霉MY-03液态发酵生产红曲色素的工艺条件进行了系统优化,确定了其最佳生产工艺:葡萄糖50 g/L、蛋白胨58.07 g/L、MgSO42 g/L、NaNO32 g/L、MnSO40.3 g/L、ZnSO40.1 g/L、装瓶量50.8 mL、接种量10.0%(V/V),于150 r/min、30℃恒温培养7 d,红曲色素色价可达342.24±2.88 U/mL,比基础培养基提高了86.9%。
[1] Silveira ST, Daroit DJ, Brandelli A. Pigment production by Monascuspurpureus in grape waste using factorial design [J]. Food Science and Technology, 2008, 41(1):170-174.
[2] 刘德华, 刘代喜, 丁海洋, 等.红曲霉JR液体发酵产红曲色素的工艺研究[J].中国酿造, 2010(5):59-61.
[3] 陈运中.功能性红曲色素发酵工艺研究[ J].食品科学, 2003,24(7):83-87.
[4] 季宏飞, 许杨, 李燕萍.采用响应面法优化红曲霉固态发酵产红曲色素培养条件的研究[J].食品科技, 2008, 33(8):9-13.
[5] Zhou B, Wang JF, Pu YW, et al. Optimization of culture medium for yellow pigments production with Monascus anka mutant using response surface methodology [J]. European Food Research and Technology, 2009, 228(6):895-901.
[6] 纪远中.红曲及红曲霉的研究现状及进展[J].天津药学,2005, 17(2):65-67.
[7] 董吉林, 杨公明, 杜冰, 等.固态发酵生长动力学模拟的研究进展[J].中国酿造, 2009(6):9-12.
[8] Smits JP, Rinzema A, Tramper J, et al. The influence of temperature on kinetics in solid-state fermentation [J]. Enzyme and Microbial Technology, 1998, 22(1):50-57.
[9] 董文宾, 郑丹, 于琴, 等.红曲霉固态发酵产生红曲色素工艺研究[J].食品研究与开发, 2005, 26(2):57-59.
[10] Johns MR, Stuart DM. Production of pigments by Monascus purpureus in solid culture [J]. Journal of Industrial Microbiology,1991, 8(1):23-28.
[11] 王广峰.红曲色素液体深层发酵工艺研究[J].食品科技,2007, 32(10):57-59.
[12] 丁海洋, 孟惠惠, 盛承承, 等.红曲霉JR摇瓶分批补料发酵产红曲色素的研究[J].中国酿造, 2009(12):91-93.
[13] 黄林, 孟惠惠, 丁海洋, 等.红曲霉JR产红曲色素液态发酵培养基配方的筛选[J].江西农业大学学报, 2009, 31:1134-1139.
[14] 王金字, 董文宾, 陶璐, 等.红曲霉固态发酵产红曲色素的条件研究[J].添加剂与调味品, 2010, 35(2):199-202.
[15] Cho YJ, Park JP, Hwang HJ, et al. Production of red pigment by submerged culture of Paecilomyces sinclairii [J]. Letters in Applied Microbiology, 2002, 35(3):195-202.
[16] 周波, 杨玲, 崔思颖, 等.响应面法优化培养基提高红曲黄色素的色调[J].华南理工大学学报, 2008, 36(11):91-95.
[17] 陈运中.红曲色素提取条件的实验研究[J].武汉工业学院学报, 2001(3):19-21.
[18] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB4926-2008食品添加剂红曲米(粉)[S].北京:中国标准出版社, 2008.
[19] 熊晓辉, 沈昌, 高巍, 等.红曲色素液体深层发酵工艺研究[J].南京农业大学学报, 1997, 20(1):90-95.
[20] 陈蕴, 夏永军, 许赣荣, 等.红曲液态发酵高产色素低产桔霉素的工艺条件[J].食品与发酵工业, 2007, 33(10):10-13.
(责任编辑 马鑫)
Optimization of Production Condition of Monascus Pigment by Monascus purpureus in Liquid State Fermentation
Zhang Rui
(Bao Tou Light Industry Vocational Technical College,Baotou 014035)
In order to improve the yield of Monascus pigment and reduce the production costs, Monascus purpureus MY-03 was adopted to produce Monascus pigment in the liquid state fermentation, and the fermentation conditions were optimized by Plackett-Burman design and Box-Benhnken experimental design. The results showed that the optimum medium was composed of glucose 50 g/L, peptone 58.07 g/L, MgSO42 g/L, NaNO32 g/L, MnSO40.3 g/L, ZnSO40.1 g/L;and the optimum bottle load was 50.8 mL in a 250 mL flask, and the optimum inoculum volume was 10.0%(V/V). The color value of Monascus pigment reached to 342.24±2.88 U/mL, increased by 86.9% than that in the basal medium,when the test fungi were incubated in 150 r/min and 30℃ for 7 d.
Monascus purpureus;submerged fermentation;Monascus pigment;Response Surface Methodology
10.13560/j.cnki.biotech.bull.1985.2015.02.028
2014-07-18
张锐,男,讲师,研究方向:生物制药;E-mail:252917839@qq.com

