纤维堆囊菌SoF5-76产埃博霉素B分批发酵动力学研究
马利云 龚国利 王娜
(陕西科技大学生命科学与工程学院,西安 710021)
纤维堆囊菌SoF5-76产埃博霉素B分批发酵动力学研究
马利云 龚国利 王娜
(陕西科技大学生命科学与工程学院,西安 710021)
埃博霉素发酵生产体系复杂,且生产菌株较难操作,导致发酵参数测定困难,迄今为止未见关于埃博霉素发酵动力学方面的报道。利用5 L发酵罐,对纤维堆囊菌(Sorangium cellulosum)产埃博霉素B(Epothilone B)的分批发酵动力学进行了研究,整个发酵过程中维持温度30℃、pH7.4。发酵结束时,菌体干重达3.00 g/L,埃博霉素B产量达18.20 mg/L,葡萄糖含量为0.049 g/L。基于Logistic方程和Luedking-Piret方程,利用MATLAB软件对其进行非线性拟合,构建了菌体生长、埃博霉素B合成和葡萄糖消耗的动力学模型。结果表明,该组模型能较好的拟合发酵过程。
纤维堆囊菌;埃博霉素B;分批发酵;动力学模型;MATLAB;非线性拟合
埃博霉素(Epothilones)是微生物粘细菌产生的一类次级代谢产物[1],其杀死肿瘤机制与紫杉醇相似,能够在癌症晚期抑制纺锤体和纺锤丝的形成,从而抑制有丝分裂,阻止癌细胞增殖,具有广谱的抗癌疗效。埃博霉素化学结构简单,易于进行修饰,来源不受限制,可以通过大规模的工业发酵进行制备等,其有望成为继紫杉醇之后更为有效的抗肿瘤药物,具有广阔的市场前景,因此受到学术界和企业界的密切关注。目前已有一个埃博霉素药物(BMS-247550,Ixabepilone)用于卵巢癌的治疗,且注射剂已上市,另外其它埃博霉素药物(ABJ-879,Patupilone、BMS-310705、KOS-862、KOS-1584和ZK-EPO等)正在进行临床研究[2,3],但埃博霉素发酵产量较低及成本较高,极大地限制了该类抗肿瘤药的开发应用,因此如何提高生产菌株的产埃博霉素能力仍是目前该药物研发的一大热点。发酵动力学是研究菌体生长速率、基质消耗速率、产物生成速率的相互关系,并用一定形式的数学模型将发酵过程中的有关因素进行定量描述,对进一步确定发酵过程中最佳发酵工艺条件和设计合理的发酵过程有极大帮助[4]。由于埃博霉素发酵生产体系复杂且难以控制,发酵动力学研究比较困难。目前国内外有关埃博霉素发酵生产的研究报道大都是基于摇瓶试验的结果[5-10],只有少量文献在发酵罐水平进行描述[11,12],未见发酵动力学的研究报告。本试验是基于实验室所保藏的纤维堆囊菌以葡萄糖为底物,进行5 L发酵罐分批发酵生产埃博霉素B的动力学研究,分别建立菌体生长、底物消耗、产物生成的动力学模型,采用MATLAB软件对其进行非线性拟合,旨在得到相对应的动力学参数估计值,为后续补料分批发酵和连续发酵动力学研究奠定良好基础,对利用中小试数据进行大型发酵工艺设计提供指导。
1 材料与方法
1.1 材料
1.1.1 菌种 本实验室所保存的菌纤维堆囊菌SoF5-76(Sorangium cellulosum SoF5-76)。来源:由本实验室从土壤中筛选,经基因组重组技术选育获得,埃博霉素B摇瓶发酵产量为35.24 mg/L[5-7]。
1.1.2 培养基 发酵培养基(g/L):马铃薯淀粉3.9,脱脂奶粉2.2,豆饼粉1.5,MgSO4·7H2O 2.5,CaCl21.3,葡萄糖1,EDTA-Fe3+3 mL/L,微量元素液0.5 mL/L,pH7.4,115℃灭菌30 min。
M26种子培养基(g/L):马铃薯淀粉8,豆蛋白胨2,葡萄糖2,酵母粉2,MgSO41,CaCl21,EDTA-Fe3+1 mL/L,pH7.2,115℃灭菌30 min。
斜面保藏培养基(g/L):KNO30.5,Na2HPO40.25,MgSO4·7H2O 1,EDTA-Fe3+1 mL/L,微量元素液 1 mL/L,琼脂2%,pH7.2,121℃灭菌30 min。
1.1.3 试验仪器 BIOF-6000B发酵罐:上海高机生物工程有限公司制造;Waters-2487-2420-1535高效液相色谱仪,美国waters公司;Hitachi himac CR21G高速冷冻离心机(日本,日立)。大孔吸附树脂XAD-16,Sigma公司。
1.2 方法
1.2.1 培养方法
1.2.1.1 种子培养 将保藏的纤维堆囊菌SoF5-76接入放有已灭菌滤纸片的CNST平板上,30℃恒温培养5-7 d,之后按一定的接种量转接到M26培养基中,装液量为50 mL/250 mL,恒温摇床(170 r/min),30℃培养72 h,获得发酵种子液。
1.2.1.2 发酵培养 以8%(V/V)接种量将所得种子液接种到5 L发酵罐中,装液量为60%。发酵条件为:温度30℃、pH7.4、搅拌转速200 r/min、通气量1.0 vvm,罐压控制在0.01 MPa。培养7 d,每隔1 d取样,分别测定菌体干重、还原糖浓度和埃博霉素B产量。
1.2.2 分析方法
1.2.2.1 发酵过程中参数的测定 生物量的测定:采用菌体干重法[13]。还原糖的测定:用 3,5-二硝基水杨酸(DNS)法[14]。
埃博霉素B提取及含量测定:将获得的样品进行离心,收集树脂,经10倍体积甲醇浸提、浓缩后,采用HPLC对其含量进行定量分析。高效液相色谱条件[15]:C18色谱柱(YWG,10 μm,250×4.6 mm),柱温30℃;紫外检测波长为249 nm;流动相为甲醇∶水(含0.2%乙酸)=65∶35;上样体积为20 μL;时间为30 min;流速为1 mL/min。埃博霉素B的定量采用本实验室通用标准曲线。方程为:y=0.132x+0.0035(y:埃博霉素B的产量(mg/L),x:峰面积)。利用HPLC检测埃博霉素B得到峰面积,根据上述标准曲线换算出埃博霉素B的产量。
1.2.2.2 数据的处理 利用MATLAB软件对实际测得的纤维堆囊菌SoF5-76分批发酵实验数据进行拟合,求得模型相关参数,建立动力学模型。再通过Origin8.0软件将所得模型定义为拟合函数,采用的算法是修正的高斯-牛顿法(Levenberg-Marquardt),以误差平方和最小为目标,可以获得模型参数初估值,然后要不断对其进行修正直到获得最优值。
2 结果
2.1 埃博霉素B发酵过程的代谢变化
图1显示,0-2 d菌体干重有所增加,但增长缓慢,可能是种子液接种到发酵培养基时,需要适应新的环境,需经历短暂的迟滞期。3-4 d菌体干重迅速增长,菌体进入对数生长期。第5天菌体干重基本维持不变,进入稳定期。埃博霉素B的大量产生主要集中在发酵第4-5天。其产量高峰出现和结束比细胞进入对数生长期和稳定期的时间分别推迟1 d。
分析还原糖的变化曲线可知,0-2 d还原糖浓度略有降低,发酵前期与菌体生长相适应,第2天开始还原糖消耗明显加快,第3-4天进入快速耗糖期,从第5天至发酵结束还原糖浓度降低缓慢;从埃博霉素B生成曲线得知,其生成与还原糖消耗基本相对应。0-2 d只产生极少的埃博霉素B,第2天后产生速度有所加快,从第3天开始到第5天进入埃博霉素B快速产生期,第5天后埃博霉素B的产生速度开始减慢,直到发酵结束埃博霉素B产量维持不变;通过分析菌体生长与产物合成的变化曲线,埃博霉素B进入快速产生期滞后于菌体进入对数生长期,当菌体处于稳定期时,埃博霉素B产量仍处于快速生产期。因此得出:纤维堆囊菌SoF5-76产埃博霉素B发酵属于产物形与菌体生长部分偶联。
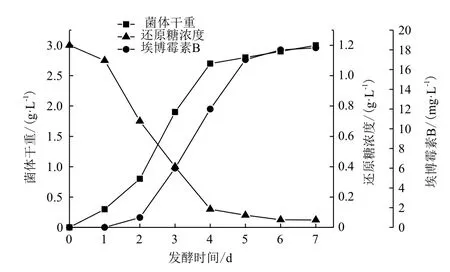
图1 发酵罐发酵过程曲线
2.2 发酵动力学模型的建立及求解
2.2.1 细胞生长动力学 微生物菌体生长动力学模型采用Logistic[16]方程:
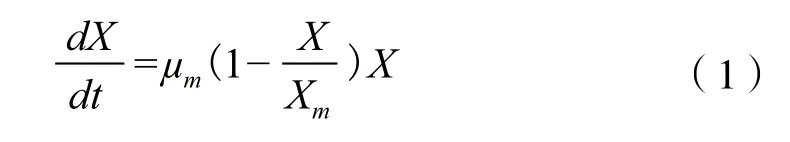
其中,μm为最大比生长速率(h-1);Xm为菌体生长上限(g/L),X为菌体浓度(g/L)。
Logistic模型是微生物发酵过程中普遍存在的一个典型S型曲线,能很好地反映分批发酵过程中因菌体浓度的增加对自身生长存在的抑制作用[16-17]。发酵初始,菌体浓度很低,菌体浓度(X)远远没有达到菌体生长上限(Xm),因此X/Xm项可忽略,此时模型表示菌体呈对数生长;菌体在对数期结束后进入稳定生长期,此时菌体浓度(X)近似于最大菌体浓度(Xm),表示菌体生长停止。
在初始条件t=0时,有X=X0,对式(1)求微分方程,得:
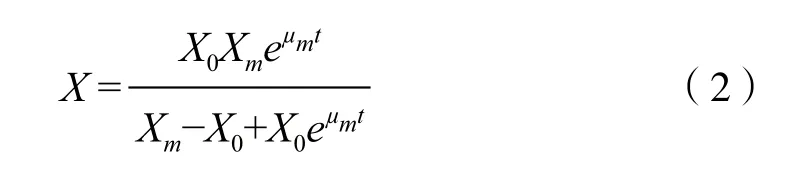
利用MATLAB软件对实际测得的纤维堆囊菌SoF5-76菌体干重数值进行拟合并通过参数修正,求解得出:X0=0.051 g/L;μm=1.547 h-1;Xm=2.945 g/L。分别将X0、μm和Xm的值代入(2)式,得到菌株SoF5-76生长动力学模型为:

将试验所测数据与式(3)的拟合曲线相比较,结果(图2)显示,该菌体的生长拟合模型与实测值拟合情况比较理想,能较好地反应菌体SoF5-76的生长情况,在95%的置信区间内,模型的F检验的相关系数R2=0.997,说明该模型可以解释99.7%试验所得菌体干重的变化,表明模型拟合良好,试验结果和预测值之间具有较好的一致性。这说明该方程可作为菌株SoF5-76的细胞生长动力学模型。
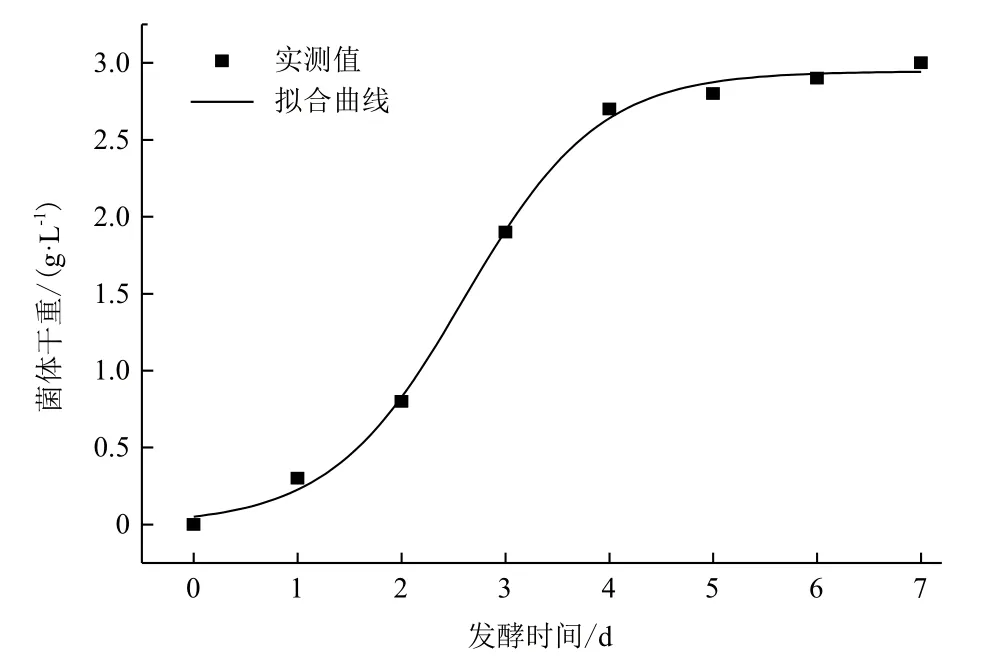
图2 细胞生长的拟合曲线与实验测得值比较图
2.2.2 产物生成动力学模型 根据分批发酵产物生成和菌体细胞生长之间的关系,Garden将产物形成分成3类:产物生成与生长相关、部分相关和不相关。因此,将产物生成动力学模型分为3种类型[18]:(I)生长相耦联型,只有在菌体生长的情况下才有产物形成;(II)部分耦联型,菌体生长时有一些产物生成,部分或大部分产物是在稳定期形成的,此阶段菌体生长处于停止期;(III)非生长偶联型,产物形成与菌体是否生长没有关系。根据上述纤维堆囊菌SoF5-76发酵过程曲线推断出菌株SoF5-76为部分偶联型,Luedeking-Piret方程可以对其产物形成动力学模型进行描述:
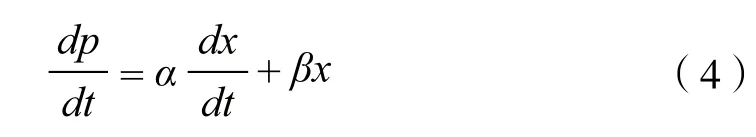
其中,α是与菌体生长有关的产物形成比例常数,β为与菌体浓度有关的产物形成比例系数(h-1);αdx/dt表示与菌体生长率相关的产物形成率;βx是与非伴随菌体生长的产物形成率,p为产物浓度(g/L)。
将式(1)代入式(4)得:
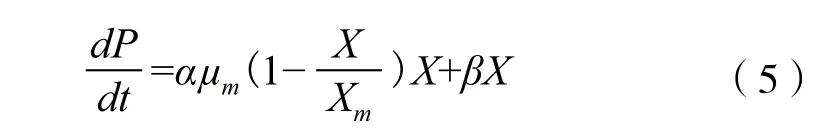
在初始条件t=0时,埃博霉素B浓度P=0。对式(5)积分得:
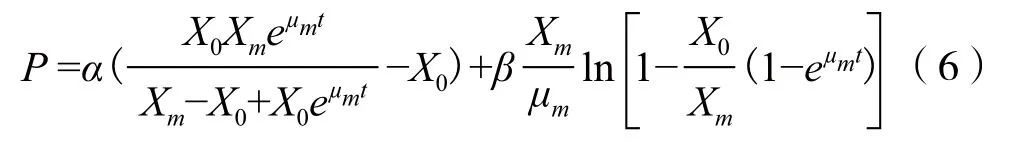
其中,P为产物埃博霉素B浓度(g/L);μm为最大比生长速率(h-1);X0为菌体初始浓度(g/L);Xm为菌体生长上限(g/L);α和β为常数。
利用MATLAB软件对实际测得的产物埃博霉素B产量数值进行拟合并通过参数修正,求得α=3.232,β=0.803;分别将α、β、X0、μm和 Xm的值代入模型方程,经整理得到埃博霉素B生成动力学模型为:
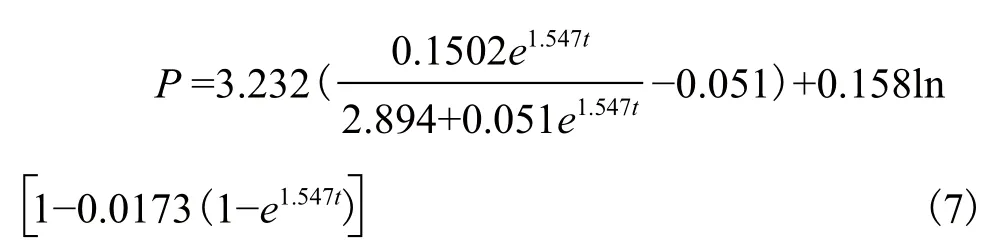
将式(7)的埃博霉素B生成拟合曲线与实验测得值相比较,结果(图3)显示,该产物拟合模型与实测值拟合情况比较理想,能够较好地反应埃博霉素B的生成情况。在95%的置信区间内,模型经F检验,相关系数为R2=0.964,即模型在96.4%的概率水平上是非常显著的。这说明该方程可作为SoF5-76的埃博霉素B的生成动力学模型公式。

图3 埃博霉素B生成拟合曲线与实验测得值的比较
2.2.3 底物消耗动力学模型 在发酵过程中,底物消耗主要有3个方面:细胞生长的消耗,合成新的细胞;细胞维持基本生命活动的消耗;合成代谢产物的消耗。因此底物消耗动力学可用如下模型描述:

式中,yx/s是碳源用于菌体生长的得率常数;yp/s是碳源用于产物积累的得率常数;mx是微生物碳源的维持常数,s为底物浓度(g/L)。
用于产生能量供细胞维持生命活动所消耗的底物很少,为建模简化起见,可以将其忽略。埃博霉素B分批发酵过程中底物的消耗就分为细胞生长和埃博霉素B生成两部分。因此底物消耗动力学模型用(9)式表述:
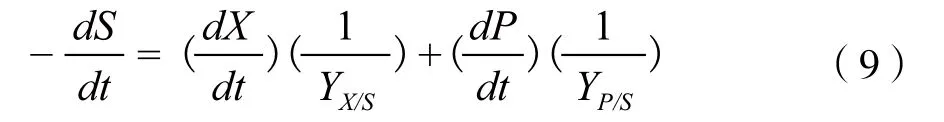
将式(4)代入式(8),整理后得

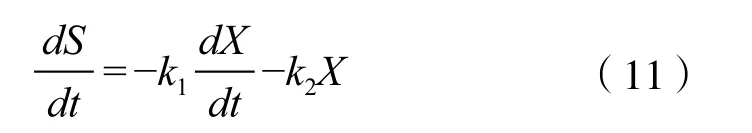
在初始条件t=0时,S=S0。求解式(12)的微分方程,可得:
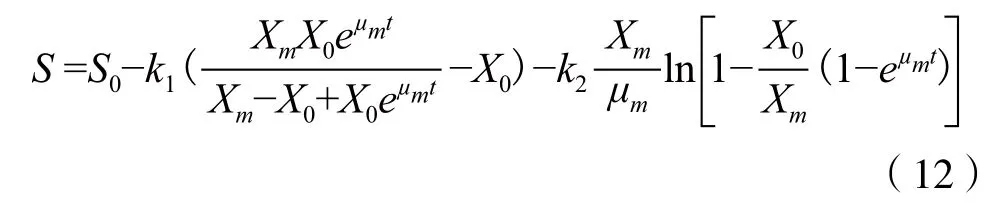
其中,S为底物浓度(g/L);S0为底物初始浓度(g/L);μm为最大比生长速率(h-1);X0为菌体初始浓度(g/L);Xm为菌体生长上限(g/L);利用MATLAB软件对实际测得的产物埃博霉素B产量数值进行拟合并通过参数修正,求得:k1=0.063 8;k2=0.013;分别将k1、k2、μm、X0和Xm的值代入式(12),经整理得到菌株SoF5-76的埃博霉素B生成动力学模型为:

将底物消耗拟合曲线与实验所测值相比较,结果(图4)显示,底物消耗拟合模型曲线与实验数据拟合情况比较理想,能够较好地反映分批发酵过程中底物(葡萄糖)消耗的情况。模型在95%的置信区间内,经F检验后显著性很高,R2=0.995,即模型在99.5%的概率水平上是非常显著的。表明方程拟合较好,实验结果与预测值之间具有较好的一致性。这说明该模型可作为SoF5-76的底物消耗动力学模型公式。

图4 底物消耗拟合曲线与实验测得值的比较
2.3 模型的验证
在与上述相同发酵条件下,重复进行分批发酵实验,通过实验值与计算值相比较结果(表1)显示,菌体干重、埃博霉素B产量和葡萄糖消耗模型计算值与实测值的平均相对误差分别为2.36%、5.89%和 5.24%,能够较好地反映实际的发酵过程。
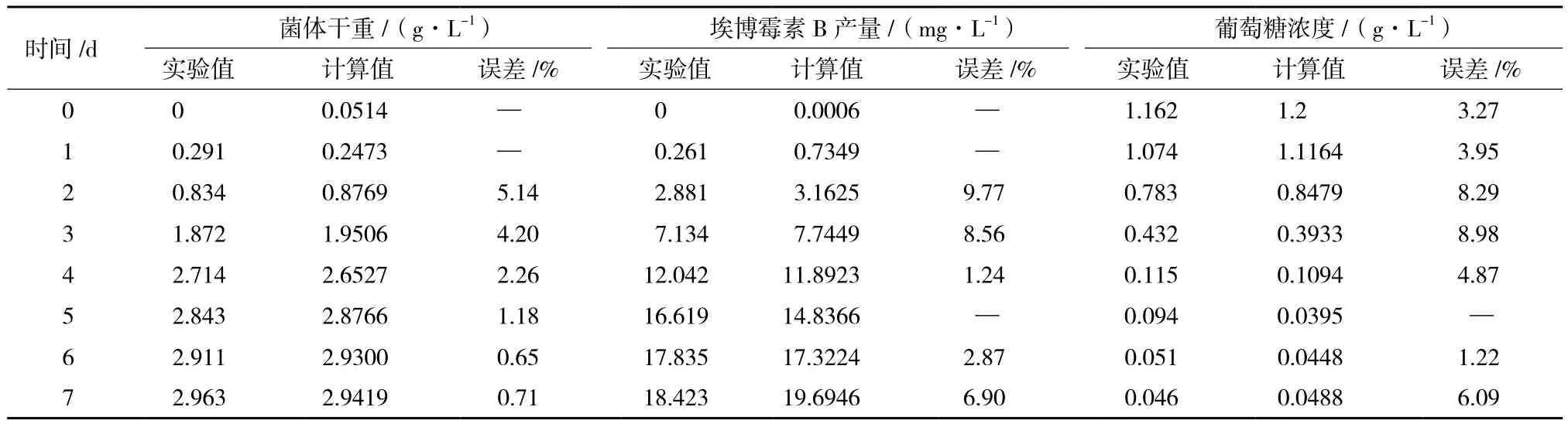
表1 分批发酵动力学模型误差检验
3 讨论
根据实验室保藏的纤维堆囊菌SoF5-76在5 L发酵罐中发酵生成埃博霉素B的实验数据,构建了动力学模型,埃博霉素B发酵除个别数据点外,大部分数据都能很好地拟合(计算值与实验值之间的相对误差低于10%),因此该模型能较好地描述纤维堆囊菌SoF5-76发酵过程规律。但实验中存在一些问题和不足有待解决:其一,初始菌体数量较少,产量较低,并且菌体与树脂很难充分分离,致使测量上有一定的误差,计算模型平均误差时可以忽略;其二,数据测定存在误差,如在搅拌过程中,剪切力及树脂之间的相互碰撞对其物理结构和性能产生较大的影响,导致树脂的利用率大大降低[11];其三,树脂对发酵液中其他物质的非特异性吸附,导致其对埃博霉素B的吸附量减少,使得计算值与实验值之间存在偏差;其四,粘细菌特殊的多细胞行为,在发酵液中成团生长[19],且在发酵罐中发酵时,菌体在发酵罐内壁粘附,并逐渐向上蔓延,贴壁菌体无法回到发酵液中,极大地影响了菌体的生长[20];此外,在发酵即将结束阶段,由底物消耗方程得到的最终底物浓度较实测值低,使得实际发酵时间比模型预测发酵时间有所延长。这些问题极大地限制了埃博霉素B的大规模发酵生产。龚国利等[21]曾在摇瓶试验中将多孔陶瓷应用于固定化纤维堆囊菌发酵生产埃博霉素B,使埃博霉素B的产量与未采用多孔陶瓷相比提高了近4倍。于是我们提出以下假设:在发酵罐中采用固定化技术,使菌体附着于固体表面生长,代谢产物则在发酵液中,这不仅可以解决菌体在发酵罐内壁粘附,而且可以替代树脂在发酵过程中吸附率下降等问题。
4 结论
本研究以Logistic、Luedeking-Piret等方程为基础,建立了埃博霉素B发酵过程中菌体生长模型、产物生成模型和底物糖消耗模型,并利用MATLAB软件进行非线性拟合。结果表明,各模型拟合的相关系数R2分别为0.997、0.964和0995,均接近1,说明拟合结果良好,并通过实验进一步进行模型验证,相对误差都较小。所构建模型一定程度上能较好反映纤维堆囊菌分批发酵埃博霉素B过程规律,可以为工业生产规模化应用提供理论依据。
[1]韩莉莉, 卢育新, 王赫, 等.培养基组成对纤维对囊菌产埃博霉素的影响[J].微生物学杂志, 2008, 28(6):103-106.
[2]Goodin S, Kane MP, Rubin EH. Epothilones:mechanism of action and biologic activity [J]. Journal of Clinical Oncology, 2004, 22:2015-2025.
[3]Altmann KH. Recent developments in the chemical biology of epothilones[J]. Curr Pharm Des, 2005, 11:1595-1613.
[4]吴悦, 李强, 林燕, 等.酵母乙醇发酵动力学模型研究[J].可再生能源, 2014, 32(2):229-233.
[5]龚国利, 陈松, 李慧, 等.基因组重组技术选育埃博霉素B高产菌株[J].中国抗生素杂志, 2013, 38(2):106-110.
[6] 龚国利, 王娜, 刘丽丽.响应面法优化纤维堆囊菌SoF5-76产埃博霉素B发酵培养基[J].生物技术通报, 2014(1):171-176.
[7]龚国利, 王娜, 刘丽丽.纤维堆囊菌产埃博霉素B的发酵条件优化[J].陕西科技大学学报, 2014, 32(1):128-132.
[8]龚国利, 刘丽丽, 王娜.用于吸附固定纤维堆囊菌的硅藻土基多孔陶瓷制备[J].现代化工, 2013, 33(11):66-70.
[9]Sang WP, Se JH, Kimb DS, et al. Improvement of epothilone B production by in situ removal of ammonium using cation exchange resin in Sorangium cellulosum culture [J]. Biochemical Engineering Journal, 2007, 37:328-331.
[10]Gong GL, Sun X, Liu, XL, et al. Mutation of Sorangium cellulosum and a high-throughput screening method for improving the production of Epothilones [J]. J Ind Microbiol Biotechnol, 2007,34:615-623.
[11]Frykman S, Tsuruta H, Galazzo J, et al. Characterization of product capture resin during microbial cultivations [J]. J Ind Microbiol Biotechnol, 2006, 33:445-453.
[12]Frykman S, Tsuruta H, Licari P. Assessment of Fed-Batch,semicontinuous, and continuous Epothilone D production processes[J]. Biotechnol Prog, 2005, 21:1102-1108.
[13]周德庆.微生物学教程[M].北京:高等教育出版社, 2002.
[14]杨贵明, 蒋爱华, 薛秋生.用DNS光度法测定还原糖的条件研究[J].安徽农业科学, 2006, 34(14):3258-3264.
[15]龚国利.粘细菌的Genome shuffling育种技术及其埃博霉素的高产菌株改良[D].济南:山东大学, 2007.
[16] 龚军辉. Logistic方程的推导及生物学意义[J].高等函授学报:自然科学版, 2008, 22(1):48-50.
[17]徐莹, 何国庆.弹力蛋白酶分批发酵动力学模型的建立[J].农业生物技术学报, 2007, 1(1):138-141.
[18]贾士儒.生物反应工程原理[M].北京:科学出版社, 2002.
[19]曹文瑞.纤维堆囊菌GSUV-205发酵生产埃博霉素过程中关键因子的探索及优化[D].济南:山东大学, 2011.
[20]刘新利, 赵林, 胡玮, 等.纤维堆囊菌合成埃博霉素专用气升式发酵罐的设计优化[C]. 2010 First International Conference on Cellular, Molecular Biology, Biophysics and Bioengineering(CMBB), 2010:540-544.
[21]龚国利, 刘丽丽, 王娜.多孔陶瓷吸附固定纤维堆囊菌发酵制备埃博霉素[J].中国生物工程杂志, 2014, 34:109-113.
(责任编辑 马鑫)
Kinetics of Batch Fermentation of Epothilone B by Sorangium cellulosum SoF5-76
Ma Liyun Gong Guoli Wang Na
(College of Life Science and Engineering,Shaanxi University of Science & Technology,Xi’an 710021)
The fermentation system produced epothilone is complex, and the production strain is more difficult to operate, leading to difficulties in fermentation parameters measured, so far there is no reporting on Epothilone fermentation kinetics. In this paper, the batch fermentation kinetics of the epothilone B produced by Sorangium cellulosum SoF5-76 was studied in a 5 L fermentor. During the process, the temperature and pH were almost constant, 30℃, 7.4. When the fermentation finished, the dry cell weight, epothilone B production and residual glycerol could reach 3.00 g/L, 18.20 mg/L and 0.049 g/L. On the bases of Logistic and Luedking-Piret equation, the models of cell growth,epothilone B production and substrate consumption were established, and the non-line fitting was employed to model the kinetics of fermentation by software MATLAB. The results show that the kinetic models were in good agreement with the fermentation process.
Sorangium cellulosum;epothilone B;batch fermentation;kinetic models;MATLAB;non-line fitting
10.13560/j.cnki.biotech.bull.1985.2015.02.030
2014-06-23
国家自然科学基金项目(20906058),陕西科技大学学术骨干培育项目(XSG2010009)
马利云,男,硕士,研究方向:微生物制药;E-mail:mayun919585594@163.com
龚国利,男,博士,教授,研究方向:工业微生物发酵工程技术;E-mail:gongguoli@sust.edu.cn

