柚皮中抑菌物提取工艺优化研究
摘要[目的] 优化柚皮提取类黄酮、类柠檬苦素的工艺条件。[方法]以柚皮为原料,采用“乙醇水浴法”提取类黄酮,采用“二氯甲烷回流法”提取类柠檬苦素。[结果] 提取类黄酮的最佳工艺为乙醇体积分数60%、料液比1∶25 g/ml、提取温度70 ℃、提取时间1.5 h,提取次数2次,类黄酮3次平均提取率为1.211%;提取类柠檬苦素的最佳工艺为料液比1∶15 g/ml,温度55 ℃,提取2.5 h,提取次数2次,类柠檬苦素3次平均提取率为0.561%。[结论] 所得的多元二次回归方程预测模型与实际情况拟合较好,可用于指导柚皮抑菌物的提取分离。
关键词柚皮;类黄酮;类柠檬苦素;均匀设计;响应面分析
中图分类号S666.3;TS255.1文献标识码
A文章编号0517-6611(2015)05-259-04
Study on the Optimal Extraction Technology of Antimicrobial Substance from Pomelo Peels
TIAN Guang-wen,LI Peng-fei ,DU Li-hua et al (College of Life Sciences,Northwest A&F University,Yangling,Shaanxi 712100)
Abstract [Objective] The paper aims to set up an optimal method for extraction technology of flavonoids and limonoids from pomelo peels.[Method] Using “ethanol water bath method” extracts flavonoids; using “dichloromethane refluxing method” extracts limonoids.[Result] The optimal extraction conditions of flavonoids were ethanol concentration 60%,solid-liquid ratio 1∶25 g/ml,extracting temperature 70 ℃,extracting time 1.5 h and extraction 2 times.In these conditions,the average of three actual verification extraction yield of flavonoids was 1.211%.The optimum extraction condition of limonoids were solid-liquid ratio 1∶15 g/ml,extracting temperature 55 ℃,extracting time 2.5 h and extraction 2 times.In these conditions,the average of three actual verification extraction yield of limonoids was 0.561%.[Conclusion] The resulting multivariate quadratic regression equation prediction model fit well with the actual situation,can be used to guide the extraction and separation of antimicrobial substance from pomelo peels.
Key words Pomelo peel; Flavonoids; Limonoids; Uniform design method; Response surface methodology (RSM)
基金項目西北农林科技大学校重点创新实验项目(1210712162)。
作者简介田广文(1964- ),男,陕西蓝田人,实验师,从事生物学和食用菌实验教学科研工作。
收稿日期2014-12-23
柚皮占整个柚子43%~48%[1],在生鲜食用或加工时,大部分作为垃圾处理,不仅浪费资源而且污染了环境。从柚皮中提取安全高效的抗氧化、抑菌防腐活性物质,符合“绿色环保健康”的概念。据近年研究,柚皮提取物中富含类黄酮、类柠檬苦素、胰岛素类似物、酚酸、香精油等多种植物化学活性成分[1-2]。柚皮中的类黄酮化合物多与糖结合成苷,主要为柚皮苷、新陈皮苷、柚皮素芸香苷等二氢黄酮类。柚皮中柚皮苷含量为1%~6%[2-6],其具有抑菌、抗氧化、抗衰老、免疫调节和抗肿瘤等更多生理活性作用[7-10]。
类柠檬苦素在柑橘属类中以柚类最高(56 mg/kg)、橙类次之(32 mg/kg)[10-14]。研究表明[12-14],类柠檬苦素含量在果实中以种子最高,其次为果皮、果肉;在成熟果实中,中果皮(海绵层)含类柠檬苦素约1%。迄今分离到约300多种类柠檬苦素化合物,其代表物是柠檬苦素和诺米林,该类物质具有杀虫、抗疟、抗病毒、抗肿瘤形成、抑菌、消炎等作用[1,3,11-15]。因此,柚皮已是天然防腐剂、抗病毒制剂、杀虫剂等的良好来源[1-15]。
笔者在总结前人试验的基础上,通过科学试验设计研究最大化提取柚皮中两类抑菌物(类黄酮、类柠檬苦素),为进一步的抑菌试验提供好原料。
1材料与方法
1.1材料
1.1.1原料及试剂。
柚皮,当地超市优质沙田柚自加工。芦丁标准品(Rutin 153-18-4,UV≥98%)、柠檬苦素标准样品(Limonin 1180-71-8,HPLC≥98%)均为上海源叶生物科技有限公司产品。主要试剂:乙醇、甲醇、石油醚(60~90 ℃)、乙醚、丙酮、浓盐酸、浓硫酸、氢氧化钠、亚硝酸钠、硝酸铝、三氯化铁、对二甲氨基苯甲醛、二氯甲烷等,国产分析纯(AR)。
1.1.2主要仪器设备。
FW-400A高速万能粉碎机,北京中兴伟业仪器有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;SHB-III循环水式多用真空泵,郑州市长城科工贸有限公司;HH-S4数显恒温水浴锅,金坛医疗器械厂;WFJ2000型可见分光光度计,尤尼柯(上海)仪器有限公司。
1.2方法
1.2.1柚皮处理。
鲜柚果实→洗去杂物→剥皮→去果皮表面黄色油胞层→切成5 mm长宽条→50 ℃烘6~12 h至干(含水量不高于10%)→粉碎→过60目筛→装入棕色广口瓶→2~5 ℃保存备用。
1.2.2柚皮脱脂。
文献报道[1-5,11,14,16],脱脂效果的好坏对柚皮提取抑菌物有直接影响。该试验按文献最佳条件进行脱脂,即称取100 g柚皮粉末各5份,放入5个棕色瓶,加4倍石油醚(60~90 ℃),pH 6.5,避光放置32 ℃下8 h。滤除石油醚,少许水冲洗,风干装瓶备用。
1.2.3类黄酮化合物提取。
1.2.3.1工艺流程。脱脂柚皮粉→乙醇水浴恒温回流提取→抽滤→旋蒸浓缩→柚皮类黄酮。
1.2.3.2提取方法。
称2.5 g脱脂柚皮粉于250 ml圆底烧瓶,加入乙醇混匀,恒温回流提取1~3 h,然后抽滤,旋蒸浓缩至约为原体积1/3,移至25 ml容量瓶,加30%乙醇定容,适当稀释测吸光度。
1.2.3.3类黄酮化合物的测定(标准曲线绘制)。采用NaNO2-Al(NO3)3比色法[4,17-18]。
1.2.3.4样品测定。
移取试验样液,加30%乙醇定容至25 ml,按“1.2.3.3”节方法显色和测吸光度。据芦丁标准曲线回归方程计算类黄酮质量浓度,再计算柚皮总黄酮提取率。
类黄酮得率(%)=25×C×V1×100/(103×m×V2)
式中,C为类黄酮质量浓度(mg/ml);V1为移取试验样液的体积(ml);V2为显色所移取的试验样液体积(ml);m为柚皮粉质量(g)。
1.2.3.5类黄酮提取单因素试验。据文献[2-10,17-18],分别考察提取溶剂、时间、温度、料液比对类黄酮提取的影响(每样称柚皮粉2.5 g进行)。
1.2.3.6均匀试验设计[19-20]。在单因素试验基础上,以乙醇为提取溶剂,采用恒温回流提取法,选取乙醇体积分数(X1)、料液比(X2)、提取温度(X3)和提取时间(X4)为考察因素,以类黄酮得率为评价指标,按均匀试验设计方法安排试验,优选提取工艺。
1.2.4类柠檬苦素提取。
1.2.4.1 工藝流程。
脱脂柚皮粉→有机溶剂恒温回流抽提→抽滤→减压浓缩→类柠檬苦素物。
1.2.4.2提取方法。提取溶剂选择:类柠檬苦素在不同有机溶剂中的溶解度不同[1,3,10-16,21-22],在相同浸提条件下,该试验分别选用无水乙醇、二氯甲烷、丙酮和乙醚为提取剂进行对比试验。即按料液比1∶12 g/ml、50 ℃恒温回流2 h后抽滤,50 ℃旋蒸浓缩,适当稀释浓缩液比色,据标准曲线求得率。
单因素试验:据文献[1,3,10-16,21-22],影响恒温回流法提取类柠檬苦素的因素主要是提取剂浓度、料液比、提取温度和提取时间。该试验改变其中某一因素进行试验,以考察各因素对提取的影响。
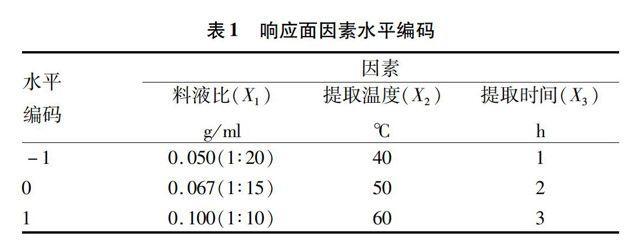
类柠檬苦素提取工艺响应面试验设计[23]:在单因素试验的基础上,以二氯甲烷为提取溶剂,根据Box-Behnken的组合试验设计原理,选取料液比X1、提取温度X2和提取时间X3 3个因素,自变量编码见表1。以类柠檬苦素得率为考察指标(Y),采用响应面分析方法,确定最佳提取工艺条件。
1.2.4.3类柠檬苦素测定[16,21-22,24]。①
显色剂Ehrlich试剂的配制。显色剂A液:将125 mg对二-甲氨基苯甲醛溶于100 ml硫酸的乙醇溶液(65 ml浓硫酸∶35 ml无水乙醇,放冷使用)中。
显色剂B液:准确称取三氯化铁9.0 g,用蒸馏水溶解并定容至100 ml。使用时往A溶液中加入0.05 ml三氯化铁水溶液,混合均匀,即得Ehrlich试剂。②标准曲线的绘制。
柠檬苦素标准品以无水乙醇配成370 μg/ml的标准工作溶液,在6支试管中分别加入0、0.4、0.8、1.2、1.6、2.0 ml标准溶液,分别加无水乙醇至2.0 ml,再分别加入5.0 ml Ehrlich试剂,摇匀,静置30 min,在300~700 nm范围内,最大吸收波长为550 nm,故选550 nm为测定波长,以空白液为参比。以标准品浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到回归方程和相关系数(表2)。③样品测定。
将所得提取物用无水乙醇溶解并定容至25 ml,取此溶液2 ml,分别加入5 ml显色剂显色30 min后于550 nm处测定吸光度。根据测得样品吸光度A和标准曲线,计算出样品中类柠檬苦素浓度C,再换算为提取得率。
提取得率(%)=25C×10-3×100/m
式中,C为试样中类柠檬苦素浓度(mg/ml);m为柚皮粉质量(g)。
2结果与分析
2.1类黄酮提取
2.1.1单因素试验结果。试验得到较佳的提取条件为:提取溶剂60%~70%乙醇,料液比1∶20~1∶30 g/ml,提取温度70 ℃,提取时间2.0 h,提取次数2次(即提取完后残渣再提取1次,合并提取液减压浓缩)。
2.1.2均匀设计试验结果。
表3每项类黄酮得率为2次提取平均值。以DPS软件进行二次多项式逐步回归,建立类黄酮得率(Y)与乙醇体积分数(X1)、料液比(X2)、提取温度(X3)、提取时间(X4)之间的回归方程:Y=1.273 79-0.038 79X1-0.007 20X22+0.007 16X1X2+0.000 77X3X4,相关系数R=1.000 0,F值=7 861.702 6,P值=0.008 5<0.05,剩余标准差S=0.000 8,回归方程显著,有统计学意义。对各因子通径分析,决定系数为0.999 97,说明实测值与模型有很好的一致性,回归分析有效。
回归方程各因素显著性检验结果表明:方程中的X1(P=0.000 3)、X22(P=0.000 1)、X1X2(P=0.000 6)和X3X4(P=0.002 8)这4项对试验结果均有显著影响。从方程可知,X1、X22对提取影响较大,二者为负相关;而交互项X1X2、X3X4为正相关。
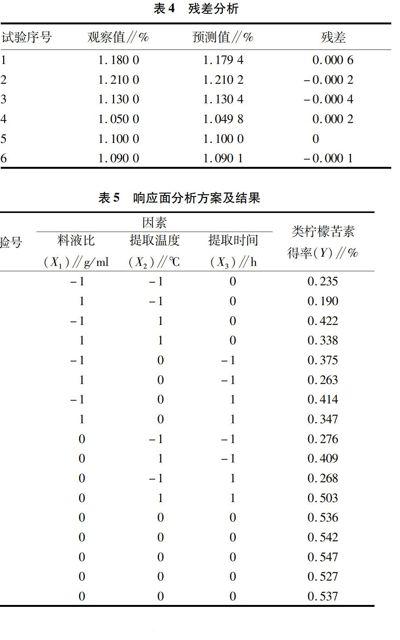
通过上述回归方程对类黄酮得率进行预测,如表4所示,第2组的预测值(1.210 2%)最大,残差较小,其对应的最优提取工艺条件为:乙醇体积分数60%、料液比1∶25 g/ml、提取温度70 ℃、提取时间1.5 h,提取2次。
2.2最优提取条件的验证
采用乙醇体积分数60%,料液比1∶25 g/ml,提取温度70 ℃,提取时间1.5 h,进行3次平行提取验证,类黄酮的得率分别为1.205%、1.215%、1.213%,平均为1.211%,RSD为0.437%,结果重复性良好,与预测值接近,证明所得类黄酮的最优提取工艺可行。
2.3柠檬苦素提取
2.3.1单因素试验。
结果得出,乙醚的提取效果最差,丙酮提取率最高,其次是二氯甲烷和乙醇。但由于丙酮揮发性和毒性较大,综合考虑组合试验选二氯甲烷作为类柠檬苦素的提取溶剂(二氯甲烷也有一定毒性,使用中要注意皮肤、眼睛接触与吸入)。
据报道[13,15,22,24],类柠檬苦素是一类天然抗氧化物质,过高的提取温度会促使其氧化,降低提取效率,因此,提取温度选在50~60 ℃进行。而从该试验料液比、提取时间分别对提取率的影响结果知,料液比宜选1∶12 g/ml左右,提取时间宜选2 h。
于是,在温度40、50、60 ℃,料液比为1∶12 g/ml,提取时间为2 h,进行二氯甲烷提取试验,类柠檬苦素得率分别为0.279%、0.291%、0.288%。可见50 ℃以上得率较高。
2.3.2响应面试验及结果。以二氯甲烷为提取溶剂,按表1、表5进行试验,每项类柠檬苦素得率为2次提取的平均值,试验提取结果见表5。
利用Design Expert软件对表5试验数据进行回归分析,得回归方程(模型)为Y=-3.893 7+30.211 1X1+0.120 1X2+0.107 8X3-0.039 6X1X2+0.451 0X1X3+0.002 5X2X3-204.524 0X21-0.001 1X22-0.060 3X23。各项系数绝对值代表因素对提取率影响程度,系数正负代表影响方向。
方差分析显示:
F模型=220.35,P模型< 0.000 1**;FX1=100.68,PX1< 0.000 1**;FX2=519.91,PX2< 0.000 1**;FX3=45.81,PX3=0.000 3*;FX1X2=3.31,PX1X2=0.111 9;FX1X3=4.29,PX1X3=0.077 2;FX2X3=21.33,PX2X3=0.002 4*;FX21=580.01,PX21< 0.000 1**;FX22=456.49,PX22< 0.000 1**;FX23=129.19,PX23=< 0.000 1**;F失拟=3.62,P失拟=0.123 1(不显著)。由此看出,一次项中X1、X2、X3的P值<0.01,说明3因素间均对响应值有极显著性影响,影响次序是提取温度(X2)>料液比(X1)>提取时间(X3)。二次项X21、X22和X23的P值<0.000 1,具有极高的显著性,说明这3因素对响应值的影响不是简单的线性关系,响应面效应显著。交互项X2X3的P值<0.05,说明提取温度与提取时间的交互作用对响应值的影响显著,其余交互项的P值>0.05,说明其交互作用对响应值影响均不显著。
拟合模型相关系数R2为0.996 5,即99.65%的数据可用此方程解释;失拟项检验值>0.05,不显著;用上述回归方程描述各因素与响应值的关系时,其因变量和全体自变量之间的线性关系R=0.24/0.24=1.000,模型的显著水平P<0.000 1,回归方差模型极显著。综上说明,此方程可靠且与实际拟合良好,试验误差较小,可用其替代真实试验点进行分析和预测。
43卷5期田广文等柚皮中抑菌物提取工艺优化研究
2.3.3柚皮类柠檬苦素提取工艺的响应面分析。
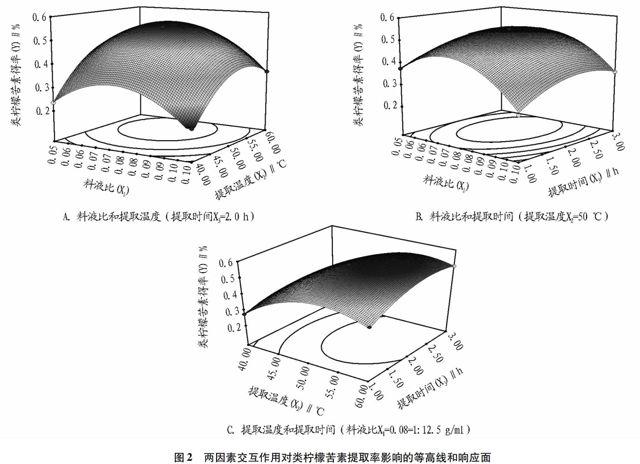
图1A等高线呈圆形,说明两因素的交互作用不显著。从响应面图可看出:随着提取温度的上升,曲面较陡,说明提取温度对提取率影响较显著;料液比对类柠檬苦素提取率的影响不太显著,曲面较缓和,提取率经过一个先升高后降低的过程。图1B等高线呈近似圆形,说明两因素的交互作用不显著。从响应面图可以看出:曲面较陡,则料液比对类柠檬苦素提取率的影响较显著;曲面较缓和,则提取时间对提取率的影响不太显著。图1C等高线呈椭圆形,说明两因素的交互较显著。从响应面图可以看出:曲面较陡,则提取温度对柠檬苦素提取率的影响较显著;曲面较缓和并且随着时间的延长,提取率经过一个缓慢升高后稍微减小的过程,则提取时间对提取率的影响不太显著。
2.3.4类柠檬苦素提取工艺条件优化及验证。
根据上述回归模型可预测理论响应值最大时的提取条件为是:料液比数(X1)0.07,提取温度(X2)54.26 ℃,提取时间(X3)2.29 h,预测类柠檬苦素提取率为0.563%。考虑到实际操作选择:料液比数(X1)0.067(即1∶15 g/ml)、提取温度(X2)55 ℃、提取时间(X3)2.5 h。在此条件下进行3次重复验证试验,提取率分别为0.557%、0.564%、0.561%,平均提取率为0.561%,RSD为0.626%,与理论预测值相比,差异不显著(P>0.05),说明预测模型与实际情况拟合较好,可用于对柚皮类柠檬苦素提取条件进行回归分析和参数优化。
图2两因素交互作用对类柠檬苦素提取率影响的等高线和响应面
3结论
对柚皮提取类黄酮试验,通过4因素多水平均匀试验设计,建立了模型方程:Y=1.273 79-0.038 79X1-0.007 20X22+0.007 16X1X2+0.000 77X3X4,回归相关系数R=1.000 0。通过DPS软件分析,得出模型中类黄酮最优提取工艺条件为:乙醇体积分数60%、料液比1∶25 g/ml、提取温度70 ℃、提取时间1.5 h,提取次数2次。方程预测类黄酮提取得率为1.210%,而经3次验证试验柚皮类黄酮平均提取得率为1.211%,可见与模型拟合较好,说明均匀设计法优化类黄酮提取的结果可靠,所得方程模型适于指导柚皮类黄酮的提取分离。
对以柚皮提取类柠檬苦素试验,该研究从单因素试验得知二氯甲烷回流法提取效果较佳。利用Box-Behnken设计法建立的多元二次方程(模型)为:Y=-3.893 7+30.211 1X1+0.120 1X2+0.107 8X3-0.039 6X1X2+0.451 0X1X3+0.002 5X2X3-204.524 0X21-0.001 1X22-0.060 3X23,相关系数R2=0.996 5。显著性检验得出3个因素对响应值影响的顺序为:提取温度(X2)>料液比(X1)>提取时间(X3)。最佳提取工艺是料液比1∶15 g/ml,提取温度55 ℃,提取时间2.5 h,提取次数2次。此条件下预测Y的理论值为0.563%,而3次验证试验柚皮类柠檬苦素平均提取得率Y为0.561%,差异不显著(P>0.05),可见该多元二次方程可用于指导柚皮类柠檬苦素的提取分离。
参考文献
[1]
李彪,施蕊,熊智,等.柚皮柠檬苦素的提取及其杀虫活性研究[J].中国农学通报,2012,28(1):284-288.
[2] 杨洋,韦小英.柚皮黄酮类化合物提取方法和抗氧化性的研究[J].食品与工业发酵,2002,28(6):9-11.
[3] 周强,汪秋安.柚皮与柚籽中果胶、柚皮苷和类柠檬苦素的提取研究[D].长沙:湖南大学,2007.
[4] 李叶,唐浩国,刘建学.黄酮类化合物抑菌作用的研究进展[J].农产品加工,2008,157(12):53-55.
[5] 吴琼英,贾俊强.柚皮黄酮的超声辅助提取及其抗氧化性研究[J].食品科学,2009,30(2):29-32.
[6] 彭芳,陈植和.黄酮类化合物的生物活性[J].国外医药·植物药分册,1998,13(5):207-209.
[7] 刘星雨,周敏,孙体健.天然黄酮类化合物的药理活性及分离提取[J].中国药物与临床,2014,14(5):621-623.
[8] HONGFEI L,HONG Z,HEQIANG L,et al.Using neural networks to estimate the losses of ascorbic acid,total phenols,flavonoid,and antioxidant activity in asparagus during thermal treatments[J].Journal of Agricultural and Food Chemistry,2010,58(10):2995-3001.
[9] CAIYA Z,SHEN Y,CHEN J,et al.Nondestructive prediction of total phenolics,flavonoid contents,and antioxidant capacity of rice grain using near-infrared spectroscopy[J].Journal of Agricultural and Food Chemistry,2008,56(10):8268-8272.
[10] 贾冬英,姚开,谭敏,等.柚果皮中生理活性成分的研究进展[J].食品与发酵工业,2001(27):77-78.
[11] 孙崇德,陈昆松,戚行江,等.苗世军.柑桔果实柠檬苦素类化合物的研究与应用[J].浙江农业学报,2002,14(5):297-302.
[12]
王贱荣,董美玲,郭跃伟.芸香科柠檬苦素类化合物及其生物活性研究进展[J].国际药学研究杂志,2009,36(5):321-331.
[13] 张虹,张艳萍.柠檬苦素类似物的研究进展[J].食品与发酵工业,2002,28(2):80-83.
[14] 曾凡坤,邹连生,焦必林.柑桔中类柠檬苦素含量及分布研究[J].中国食品学报,2003,3(4):79-81.
[15] 李赤翎,俞 建,蒋雪薇,等.柠檬苦素类似物糖苷的抗菌与抗氧化作用研究[J].食品科技,2008(5):154-156.
[16] 张朝晖,朱中品,李辉.柑橘中柠檬苦素超声提取工艺及含量分析[J].食品科学,2009,30(8):56-59.
[17] 何晋浙,汪 钊,金再宿.柚皮中生物类黄酮提取优化工艺研究[J].食品工业科技,2002,23(3):39-40.
[18] 秦秀凤.柑橘皮中黄酮类化合物提取和纯化方法研究[D].雅安:四川农业大学,2011.
[19] 周梅,汪振双,李塑忠.基于均匀设计的逐步回归法预测树脂混凝土强度研究[J].硅酸盐通报,2007,26(5):924-947.
[20] 胡敏,姜发堂,张生华,等.三种测定银杏叶提取物中总黄酮的方法比较[J].食品與发酵工业,1997,23(4):40-43.
[21] DANDEKAR D V,JAYAPRAKASHA G K,PATIL B S.Hydrotropic extraction of bioactive limonin from sour orange(Citrus aurantium L.) Seeds[J].Food Chemistry,2007(12):71-73.
[22] 罗水忠,潘利华,何建军,等.柑橘籽中柠檬苦素的提取与抑菌性研究[J].农产品加工,2006,79(10):105-107.
[23] 黄彤,李丽华,刘蕾,等.利用响应面分析法优化葛渣异黄酮提取工艺[J].食品研究与开发,2013,34(10):32-35.
[24] 田庆国,丁霄霖.测定橘核中柠檬苦素类似物的分光光度法[J].分析测试学报,1999,18(5):45-47.
责任编辑李菲菲责任校对况玲玲

