共表达纤维素酶菌株发酵条件研究
刘默洋,唐自钟,晋海军,孙 蓉,陈 惠,韩学易(四川农业大学生命科学学院,四川雅安625014)
共表达纤维素酶菌株发酵条件研究
刘默洋,唐自钟,晋海军,孙蓉,陈惠*,韩学易
(四川农业大学生命科学学院,四川雅安625014)
目的:为了解决在发酵过程中酶活较低、成本高等问题,加快纤维素酶工业化生产。方法:采用Plackett-Burman进行实验设计,对影响基因工程菌pET30b-BGL产酶因素:接种量(A)、培养温度(B)、装液量(C),诱导时间(D)、初始pH(E)、IPTG诱导浓度(F)进行筛选,进行方差分析,结果表明,培养温度、初始pH和装液量对产酶有重要影响。进一步用Box-Behnken的响应面方法,对这3个因素进行优化,结果:当温度为35℃,初始pH7.5,装液量为25mL(容积为100mL),pET30b-BGL产酶的酶活最高达到2080.5U/mL,较优化前的1196.8U/mL提高了将近一倍。结论:本研究为进一步研究纤维素酶提供了依据。
纤维素酶,大肠杆菌,发酵条件,响应面分析法
植物细胞壁主要是由纤维素构成的,由光合作用产生的植物纤维素物质是自然界中含量最丰富的碳水化合物之一,是一类可再生的重要资源和能源[1]。纤维素水解成可利用的葡萄糖,具有很大的难度,利用纤维素酶、实现对纤维素的生物转化与利用,对于解决目前世界存在的能源、粮食短缺、环境污染等问题具有非常现实和重要的意义[2-3]。纤维素酶有外切葡聚糖酶(exoglucanase)、内切葡聚糖酶(endoglucanase)和β葡萄糖苷酶(β-1,4-glucosiase)3种酶组成的复合酶,它能够降解纤维素,使其生成纤维二糖、葡萄糖[4-7]。目前纤维素酶的酶活较低、生产成本过高,严重限制了纤维素酶的大规模化生产和实际生活中的应用。因此,纤维素酶的研究和应用成为目前国内外学者广泛关注的焦点。
本研究采用实验室已将2种纤维素酶:内切葡聚糖酶和β-葡萄糖苷酶同时表达于同一大肠杆菌并具有高酶活的工程菌株pET30b-BGL出发[8-10],利用Plackett-Burman设计和响应面分析法优化工程菌产酶条件,提高产酶水平。
1 材料与方法
1.1材料与仪器
产内切葡聚糖、β-葡萄糖苷酶的重组基因工程菌pET30b-BGL为本实验室自行构建并成功表达;氨苄青霉素(Amp)、卡那霉素(Kan) 均为大连TaKaRa公司产品;IPTG为美国AMRESCO公司产品;胰蛋白胨、酵母粉、琼脂粉、结晶酚、NaCl、NaOH、CMC-Na、K2HPO4·3H2O,KH2PO4等均为国产分析纯。
高速台式冷冻离心机Thermo;离心机Eppendorf,Centrifuge 5417R,Germany;Eppendor微量加样器(0.5~10μL);Finnpipette微量加样器(40~200μL);QL-901型旋涡混合器江苏海门市麒麟医用仪器厂;SW-CJ-U型净化工作台苏州安泰空气技术有限公司;98-2-B磁力搅拌电热套天津市泰斯特仪器有限公司;Unico2102C-紫外可见分光光度计上海尤尼可有限公司仪;DK-8D型电热恒温水槽上海三发科学仪器有限公司;HZQ-F型全温振荡培养箱哈尔滨市东联电子技术开发有限公司;DNP-9272型电热恒温培养箱上海精宏实验设备有限公司;HH-S型电热恒温水浴锅江苏国胜实验仪器厂。
1.2培养基和试剂的配制
1.2.1LB培养基1%胰蛋白胨,1%NaCl,0.5%酵母粉,pH7.0~7.5;配制固体培养基时需加入1.5~2.0%的琼脂粉。
1.2.2LB-Amp-Kan培养基自LB培养基基础上加入100μg/mL的氨苄青霉素钠和50μg/mL硫酸卡纳霉素。
1.2.33,5-二硝基水杨酸试剂(DNS) 称取3,5-二硝基水杨酸6.3g,加到500mL含有185g酒石酸钾钠的热溶液中,然后加入2mol/L氢氧化钠溶液262mL,再加5g结晶酚和5g亚硫酸钠,加热搅拌溶解,冷却后加蒸馏水定容至1000mL,贮存于棕色瓶中,室温放置一周后即可使用。
1.2.41%羧甲基纤维素钠(CMC-Na)溶液称取1g羧甲基纤维素钠,放入100mL 1/15mol/L磷酸氢二钠-磷酸二氢钾缓冲液(pH6.8)中,加热溶解,补充蒸发掉的水分,置于4℃保存。
1.2.5IPTG诱导溶液在8mL蒸馏水中溶解2g IPTG后,用蒸馏水定容至10mL,用0.22μm滤器过滤除菌,分装成1mL小份贮存于-20℃。
1.2实验方法
1.2.1摇瓶培养方法从平板上挑取一环工程菌pET30b-BGL接种于10mL LB培养基中,37℃、200r/min振荡培养12h后取出作为液体种子。按3%接种量接种到LB培养基(含100μg/mL Amp和50μg/mL Kan),每隔12h加入IPTG诱导剂,诱导产酶。
1.2.2Plackett-Burman筛选影响工程菌pET30b-BGL产酶的重要因素以培养条件中的6个因素为研究对象,在单因素实验的基础上,采取2水平,N=12的P-B实验设计,以酶活为响应值(表1),使用Design-Expert V8.0.6.1软件对实验结果进行方差分析,筛选对产酶有重要影响的显著因子。

表1 P-B实验设计的因素水平表Table 1 Factors and levels for P-B experiment
1.2.3Box-Behnken实验设计对P-B实验中得到的结果,影响酶活最主要的3个因素进行三因素三水平的B-B设计(表2)。使用Design-Expert V8.0.6.1软件进行响应面分析。

表2 实验因素水平及编码Table 2 Levels and coding of experiment
1.2.4纤维素酶酶活力测定方法以1mL 1%的羧甲基纤维素钠(用1/15mol/L pH6.8磷酸盐缓冲液配制)为底物,加入0.1mL粗酶液,50℃水浴反应30min后,加入2.5mL DNS显色液,沸水浴煮10min,取出后在流水下迅速冷却后定容至5.0mL摇匀。将灭活的酶液作为空白对照,其他同以上步骤。在530.0nm波长处测得各管溶液的吸光值[11-13]。
酶活的定义:1g酶液每分钟产生1μg还原糖的酶量作为1个酶活单位,用μ/g表示。酶活性的计算公式:
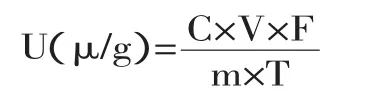
式中,U(μ/g)为试样中纤维素酶活性;C(μg/mL)为根据试样吸光度由葡萄糖标准曲线计算出葡萄糖量;V为浸提试样时所加入的缓冲液体积(mL);F为试样反应前的稀释倍数;T为反应时间(min)。
1.2.5数据处理采用软件Design-Expert V8.0.6.1。
2 结果与分析
2.1Plackett-Burman实验设计筛选影响产酶的重要因素
微生物在生长代谢过程中,培养环境的变化对其生长和代谢产物的分泌都会产生影响。以接种量(X1)、培养温度(X2)、装液量(X3)、诱导时间(X4)、初始pH(X5)、IPTG诱导浓度(X6)这6个因素为研究对象,在单因素实验的基础上,采取2水平,N=12的P-B实验设计(表3),以纤维素酶酶活为响应值筛选显著因子。
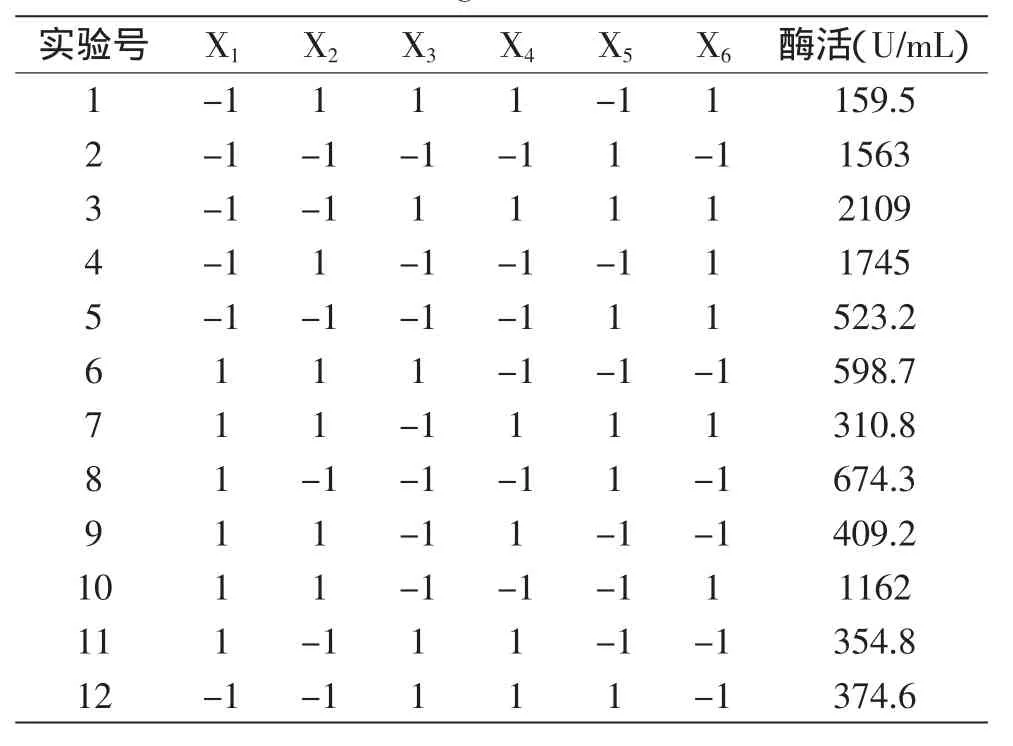
表3 Plackett-Burman实验设计和酶活Table 3 Activity of reconstructed enzyme and experiment design of P-B
结果分析(表4),初始pH、装液量和培养温度这3个因素的可信度均在96%以上,对酶活有显著影响。模型的拟合度R2为99.82%,且与校正拟合度一致;信噪比为32.398,远大于4,说明该模型可用于预测响应值。

表4P-B显著性分析Table 4 Significance analysis for P-B
2.2响应面分析确定最适产酶条件
使用Box-Behnken实验设计方法对P-B实验中得到的结果,影响酶活最主要的3个因素培养温度、初始pH和装液量进行三因素三水平的响应面分析。各因素的低水平(-1)为P-B设计中的低水平,高水平(1)为P-B设计中的高水平,中间水平(0)为(-1)和(1)的平均值,其余因素均取其低水平(表5)。
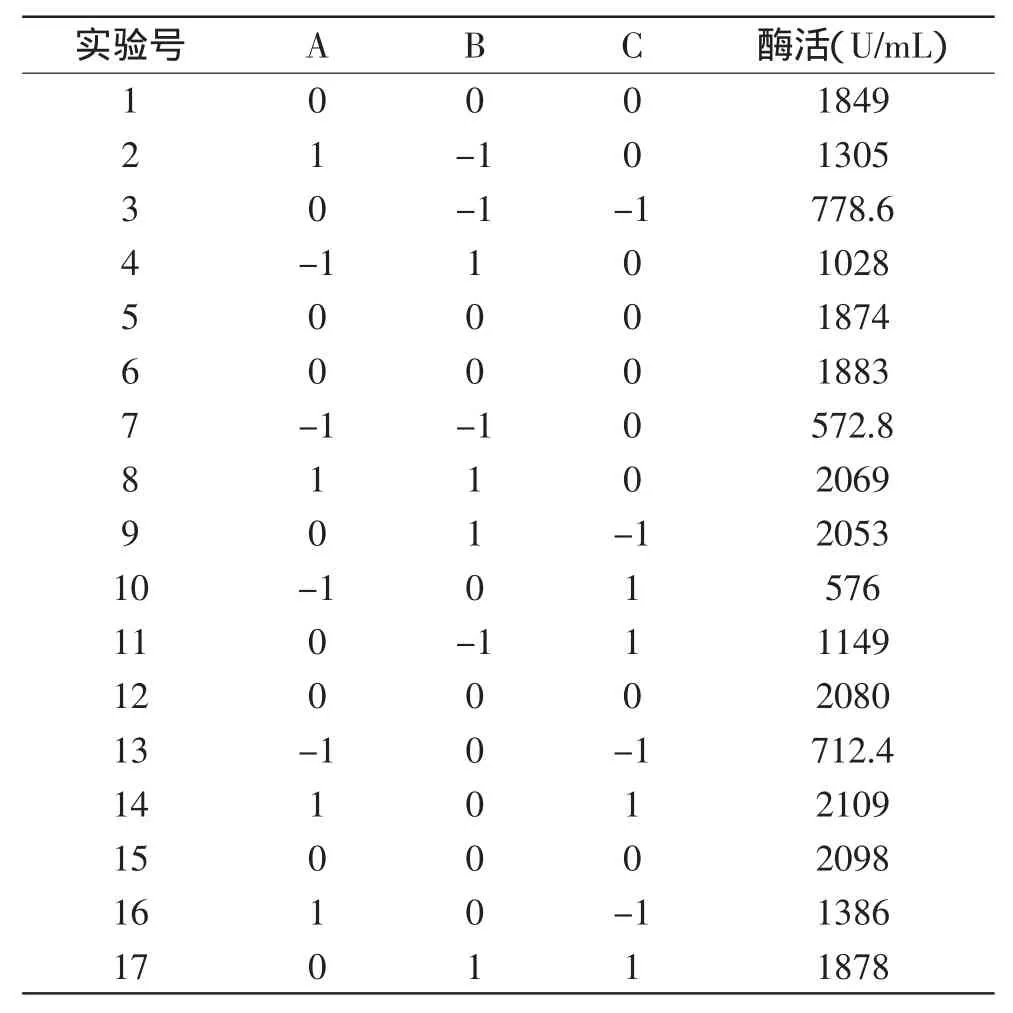
表5 B-B实验设计和酶活结果Table 5 Activity of enzyme and expriment design of B-B resuts
使用Design-Expert V8.0.6.1软件,对表3中得出的实验数据用响应面软件进行方差分析。
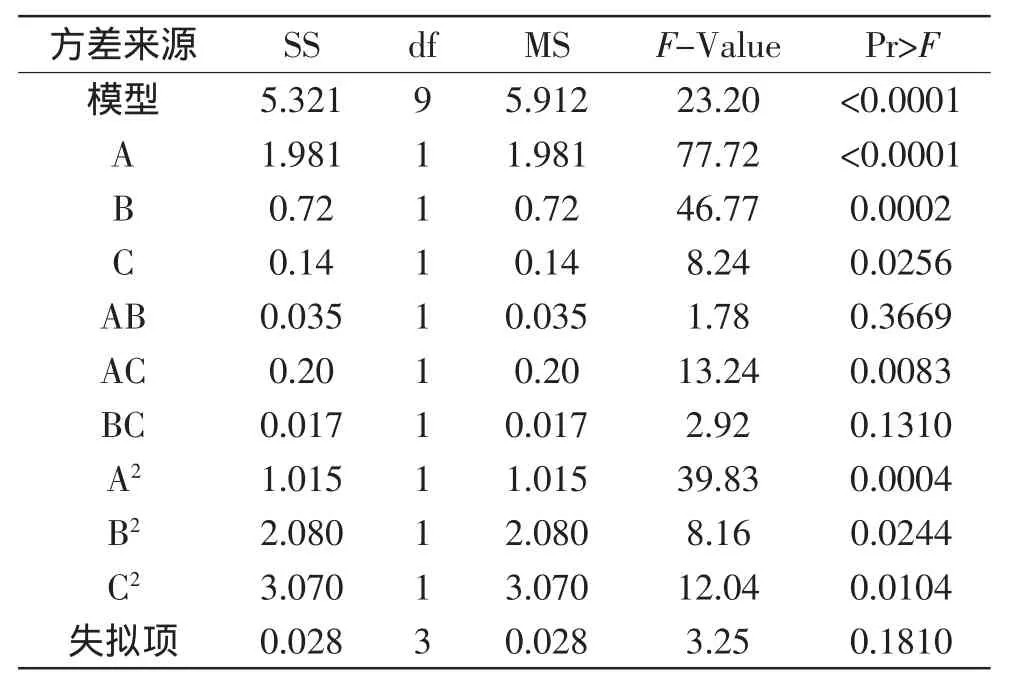
表6 Box-Behnken实验设计的方差分析Table 6 Analysis of variance of B-B
结果可知(表6),构建的模型的Pr>F值远小于0.01,说明该模型极显著;失拟项的Pr>F值为0.1810,无显著意义,说明实验数据中无异常点,无需引入更高次项,模型可行。另外,模型的校正拟合度R2= 98.09%,变异系数C.V.=10.69%,信噪比为14.71,表明该模型可以用于解释实验设计结果。
以酶活为响应值,根据表5和表6的实验结果,利用Design-Expert V8.0.6.1软件对模型进行二次回归分析,寻求酶活最大值及相应的对酶活有影响的因素的水平,得到回归方程:酶活=1956.80+497.63A+ 403.00B+97.88C+77.00AB+214.75AC-136.50BC-491.03A2-222.28B2-270.03C2,通过对回归方程分析,当培养温度为35℃,初始pH7.5,装液量为25mL(容积为100mL),工程菌pET30b-BGL产酶的酶活最高为2000U/mL。为验证模型的预测值,在该条件下,进行3次重复实验,所得的酶活为2080.5U/mL,与预测值接近,比没有优化前的1196.8U/mL提高了将近一倍。
2.3因素间的交互作用分析
根据回归方程作出的响应面图见图1~图3。响应面图可直观反映各因子之间的交互作用强弱,椭圆表示两因子交互作用明显,圆形则表示交互作用较小或没有交互作用。由图可知,在各因子的最佳值情况下模型有最大值,且各因子相互之间有或强或弱的交互作用,培养温度和装液量交互影响很明显,而培养温度和初始pH、初始pH和装液量之间交互作用很小。
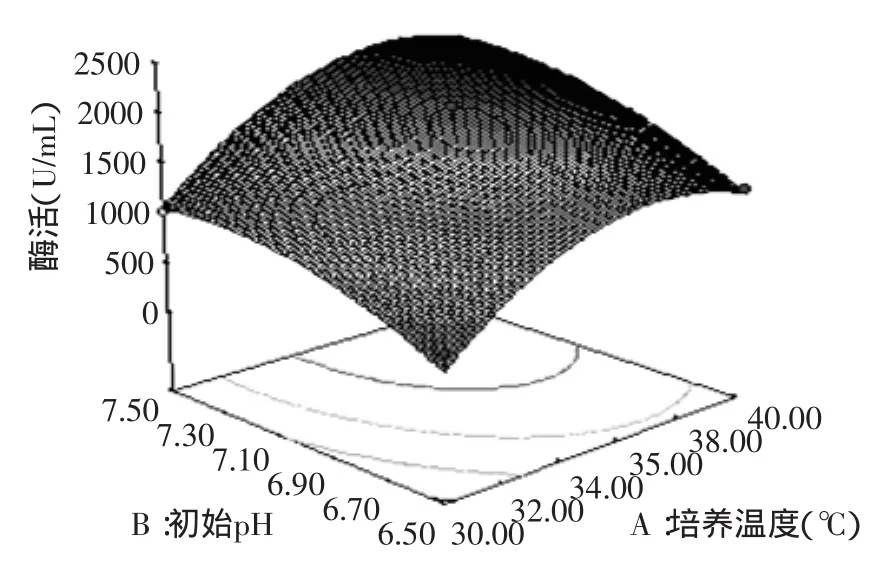
图1 温度与初始pH交互影响酶活的响应面图Fig.1 Response surface plot of the combined effects of temperature and initial pH on the activity of enzyme
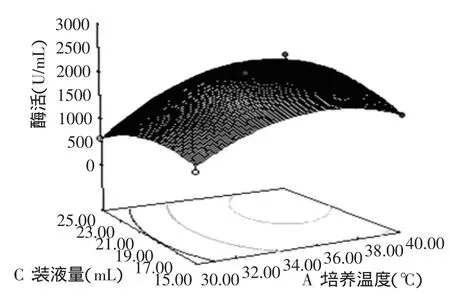
图2 温度与装液量交互影响酶活的响应面图Fig.2 Response surface plot of the combined effects of temperature and the volume of liquid on the activity of enzyme
3 讨论
由于原始菌株产酶能力低,酶活不高,通过基因重组技术对菌种进行改良,培养后能提高产酶能力,降低生产成本。基因工程菌高密度发酵产品,在食品、环保和医药等方面都有很大的应用价值。大肠杆菌高密度发酵工艺被广泛的应用于在重组蛋白的生产[14]。发酵过程中产量的多少主要取决于工程菌的细胞密度,目的蛋白的表达量[12]。为工程菌提供良好的生长条件、减少对细胞生长有毒害作用和抑制目的蛋白表达的物质,可以提高目的蛋白的表达量。因此,通过对工程菌发酵条件的优化,可以使其酶活进一步得到提高,比如温度、pH、通气量、接种量、诱导剂等因素。2005年,胡彩静等对纤维素酶高产菌株里氏木霉ZU-03产纤维素酶的液态发酵条件进行了研究,酶活力提高近3倍[15];2008年,潘春梅等借助响应面法分析,对纤维素酶高产菌康氏木霉P12进行了发酵工艺条件的优化研究,优化条件过后纤维素酶活提高了96.7%[16]。本实验通过对工程菌发酵条件的优化过后,比没有优化前酶活提高将近一倍,为以后能在小型发酵罐中进行发酵,提供初始参考数据,为以后能大规模发酵并应用于工业生产奠定一定的基础。

图3 初始pH与装液量交互影响酶活的响应面图Fig.3 Response surface plot of the combined effects of Initial pH and the volume of liquid on the activity of enzyme
4 结论
利用Plackett-Burman实验设计,对接种量(A)、培养温度(B)、装液量(C)、诱导时间(D)、初始pH(E)、IPTG诱导浓度(F)6个因素进行评价,方差分析结果表明,影响工程菌pET30b-BGL II产酶的主要因素有培养温度、初始pH和装液量;在此基础上,用Box-Behnken的响应面分析对这3个因素进行了优化,当温度为35℃,初始pH7.5,装液量为25mL(容积为100mL)酶活最高为2080.5U/mL,较优化前的1196.8U/mL提高了将近一倍,为大规模工业生产奠定了基础。
[1]Kubicek CP,Messner R,Gruber F,et al.The Trichoderma cellulase regulatory puzzle:From the interior life of a secretory fungus[J].Enzyme and Microbial Technology,1993,15(2):90-99.
[2]Zhang YHP,Himmel M,Mielenz JR.Outlook for cellulase improvement:screening and selection strategies[J].Biotechnology Advances,2006,24:452-481.
[3]赵荣乐.纤维素酶研究进展[J].喀什师范学院学报,2005,26(6):51-54.
[4]Warren RAJ.Microbial hydrolysis of polysaccharides[J]. Annual Review of Microbiology,1996,50:1167-1178.
[5]Teeri TT.Crystalline cellulose degradation:new insight into the function of cellobiohydrolases[J].Trends Biotechnol,1997,15:160-167.
[6]WithersSG.Mechanismsofglycosyltransferasesand hydrolyses[J].Carbohydr Polym,2001,44:325-337.
[7]Eriksson KEL,Blanchette RA,Ander P.Microbial and enzymatic degradation of wood and wood components[M]. Springer-Verlag,New York,1990.
[8]耿风廷,赵晓瑜,高珊.多基因在大肠杆菌中的共表达策略[J].生物技术通讯,2007,39(3):27-33.
[9]唐自钟,刘姗,韩学易,等.重组β-葡萄糖苷酶基因和内切葡聚糖苷酶基因在大肠杆菌中的共表达[J].食品工业科技,2013,34(24):189-194.
[10]Tang ZZ,Chen H,Chen LJ,et al.Improving endoglucanase activity by adding the carbohydrate-binding module from corticium rolfsii[J].J Microbiol Biotechnol,2014,24(4):440-446.
[11]Tolonen AC,Chilaka AC,Church GM.Targeted gene inactivation in Clostridium phytofermentans shows that cellulose degradation requires the family 9 hydrolase Cphy3367[J].Mol Microbiol,2009,74(6):1300-1313.
[12]Cai GH,Zhang Z,Wang ZH.Fusion expression and analysis of the epitopes in tartary buckwheat allergen[J].Food Science,2006,11:211-215.
[13]Tang ZZ,Wu ZF,Chen H,et al.Characterization of novel EGs reconstructed from Bacillus subtilisendoglucanase[J]. Applied Biochemistry and Biotechnology,2013,169:1764-1773.
[14]Fuchs C,Koster D,Wiebusch S,et al.Scale-up of dialysis fermentation for high cell density cultivation of Escherichia coli[J].Journal of Biotechnology,2002,93(3):243-251.
[15]胡彩静,代淑梅,李秋园.里氏木霉产纤维素酶液态发酵条件的研究[J].食品与发酵工业,2005,31(9):45-48.
[16]潘春梅,王辉,任敏.纤维素酶液体发酵工艺条件的响应面分析优化[J].环境科学与技术,2008,31(8):120-124.
Study on fermentation conditions of co-expression cellulase strains
LIU Mo-yang,TANG Zi-zhong,JIN Hai-jun,SUN Rong,CHEN Hui*,HAN Xue-yi
(College of Life Science,Sichuan Agricultural University,Ya’an 625014,China)
Objective:To solve the low enzyme activity and high cost in the process of cellulase fermentation and ameliorate the industrial production.Methods:These factors[Inoculums’quality(A),temperature(B),liquid volume(C),induce time(D),initial pH(E)and IPTG concentrate(F)]were used to screen and analyze by Plackett-Burman.From the results,Box-Behnken analyze was conducted,the temperature(B),liquid volume(C)and initial pH (E)were used to optimized.Results:The enzyme activity of pET30b-BGL had nearly 2-fold increase than before(1196.8U/mL to 2080.5U/mL)in the condition of 35℃,pH7.5 and 25mL liquid volume(100 mL in all).Conclusion:This research could provide the basis for the further investigations of cellulase.
cellulases;Escherichia coli;fermentation conditions;response surface analysis
Q814
A
1002-0306(2015)02-0173-04
10.13386/j.issn1002-0306.2015.02.028
2014-04-10
刘默洋(1989-),男,在读硕士研究生,主要从事微生物酶工程及蛋白质组学方面的研究。
陈惠(1962-),女,博士,教授,主要从事微生物酶工程方面的研究。

