添加剂和光照对合浦珠母贝肉酶解液抗氧化活性的影响
吴燕燕,王 晶,2,李来好,杨贤庆,胡 晓,周婉君(.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州50300;2.上海海洋大学食品学院,上海20306)
添加剂和光照对合浦珠母贝肉酶解液抗氧化活性的影响
吴燕燕1,王晶1,2,李来好1,杨贤庆1,胡晓1,周婉君1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州510300;2.上海海洋大学食品学院,上海201306)
为了探明合浦珠母贝(Pinctada fucata)肉抗氧化肽在应用中是否受到食品添加剂和光照的影响,文章以清除DPPH·、·OH和等自由基的能力以及可溶性蛋白质量分数(SPC)为指标,测定合浦珠母贝肉酶解液的抗氧化稳定性受食品辅料(NaCl、蔗糖和葡萄糖)、不同浓度防腐剂(苯甲酸钠和山梨酸钾)、金属离子(K+、Ca2+、Mg2+、Zn2+和Cu2+)等添加剂以及光照的影响。结果表明:NaCl(0.5%~4.0%)和蔗糖(2.0%~10.0%)对合浦珠母贝肉酶解液抗氧化性影响并不显著,长时间保存,葡萄糖的影响较大;防腐剂对其抗氧化活性和SPC也有一定的影响,0.6%的山梨酸钾和0.4%的苯甲酸钠有益于其保存,且苯甲酸钠的作用效果大于山梨酸钾;K+、Ca2+、Mg2+对其清除自由基的能力影响较小,而Cu2+的影响最大,0.05mg·mL-1以上浓度的Cu2+和光照都会降低其抗氧化能力。
合浦珠母贝肉,抗氧化肽,食品添加剂,光照,抗氧化稳定性
活性肽在蛋白链中并不表现出相应的活性,只有经过专一的蛋白酶酶切释放后,形成的肽片段才能发挥其功能活性。天然抗氧化肽一方面能够清除·OH、和DPPH·等氧化自由基,另一方面具有抑制脂质过氧化反应并螯合金属离子抑制自由基链式反应的效应[1],从而能够积极作用于身体机能。而且,抗氧化肽不仅具有良好的溶解性和热稳定性等理化性质,而且具有人工合成抗氧化剂无可比拟的强抗氧化能力和安全性[2-3]。然而,酶法制备的抗氧化肽是一种混合的粗提物,其中包括的肽片段抗氧化活性强弱不一[4],在应用过程中会受到外界因素的影响,需要研究其稳定性的变化,以更好地对天然抗氧化肽开发利用[5-6]。目前,国内外对抗氧化肽的提取纯化研究较多,例如Je等[7]酶解多区域的深海鳕鱼骨架制备抗氧化肽酶解物;Wu等[8]研究了鲭鱼酶解制备抗氧化肽在1400u的抗氧化性高;王晶等[9]和石丽梅等[10]利用碱性蛋白酶对玉米蛋白酶解制备抗氧化肽,并分别讨论了其在熟肉糜中和中式香肠的应用。但是关于其稳定性的研究反而不全面。
本文利用微波辅助蛋白酶水解合浦珠母贝(Pinctada fucata)肉,经过脱盐,研究其酶解液受食品辅料、防腐剂、金属离子等添加剂以及光照的影响,追踪其抗氧化活性的变化,从而阐述其稳定性,以期对其在医药、食品以及化妆品行业[11-12]中的应用提供理论依据。
1 材料与方法
1.1材料与设备
合浦珠母贝海南养殖基地;DPPH(CAS:1898-66-4,AR) 美国Sigma公司;邻苯三酚、邻二氮菲、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷、铁氰化钾、蔗糖、葡萄糖、山梨酸钾、苯甲酸钠、硫酸钾、硫酸镁、氯化锌、氯化钠和硫酸铜等均为分析纯,购自广州化学试剂厂。
DS-1高速组织捣碎机上海标本模型厂;DKS24恒温水浴锅上海森信实验仪器厂有限公司;3K30高速冷冻离心机德国Sigma公司;MAS-Ⅱ微波仪上海新仪微波化学科技有限公司;Delta320精密pH计梅特勒-托利多仪器(上海)有限公司;CHAIST真空冷冻干燥机博劢行仪器有限公司;AKTA purifier100GE公司;MILLIPORE超滤装置广州东锐科技有限公司;UV-3000PC紫外分光光度计上海美谱达公司;METER SUNRISE酶标仪奥地利TECAN公司。
1.2实验方法
1.2.1样品的制备酶解液中抗氧化肽的活性与蛋白质的含量,其中的氨基酸种类以及肽段的分子量大小有着紧密的联系,合浦珠母贝肉抗氧化肽(Antioxidant peptides),记为AOP,是由本实验室自制[13]得到的产品,经过前期的实验基础选取过0.2μm滤膜的酶解液,冷冻干燥得到的产品作为本实验的样品。
1.2.2合浦珠母贝肉酶解液产物对DPPH自由基清除能力的测定参考Rajapakse N等对DPPH清除率的测定方法,稍作修改[14]:
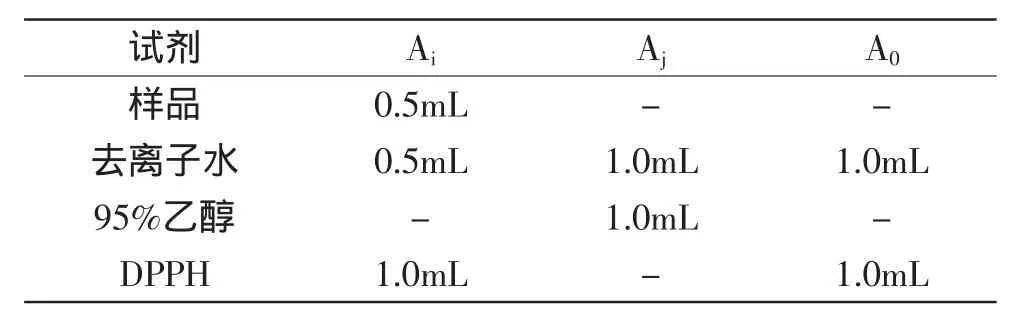
表1DPPH自由基清除能力的测定Table 1 The determination of DPPH radicalscavenging activity
按照表1操作的各组实验品,在混匀后在室温下避光反应20min,10000r/min离心10min,517nm比色,并以等体积去离子水和无水乙醇混合液空白调零。DPPH自由基清除率的公式计算如下:
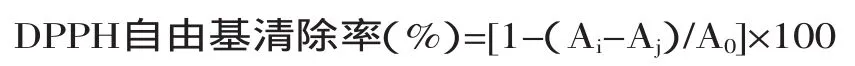
式中:A0—对照组吸光值;Ai—样品组吸光值;Aj—空白组吸光值。
1.2.3AOP对·OH清除能力的测定参考Fenton反应体系模型,利用H2O2与Fe2+混合可以生产·OH的原理,加入水杨酸捕捉·OH产生的有色物质在510nm处有强吸收[15]。具体操作如下:
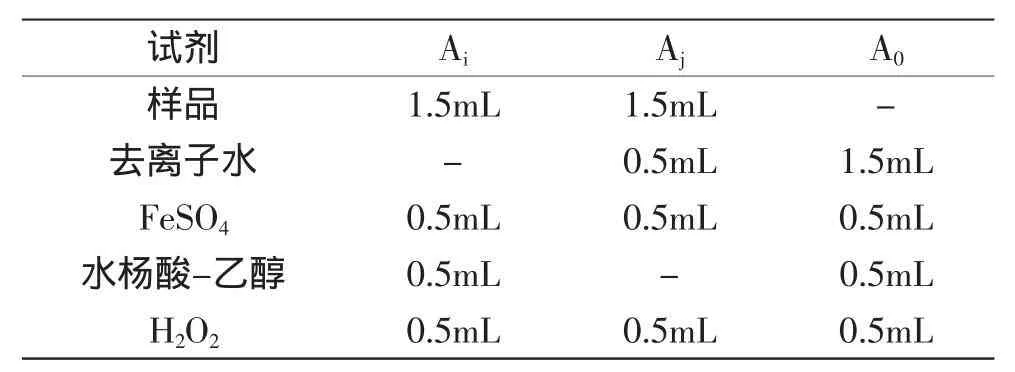
表2 ·OH清除能力测定Table 2 The edetermination of OH radicalscavenging activity
按照表2中要求操作后,在37℃下反应30min,510nm比色以等体积去离子水和无水乙醇混合液空白调零。清除率(%)计算如下:
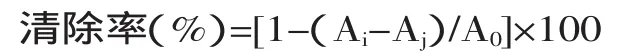
式中:A0—对照组吸光值;Ai—样品组吸光值;Aj—空白组吸光值。
1.2.4AOP对O2-·清除能力的测定参考吴燕燕等[16-17]的方法测定:取样品0.2mL加入Tris-HCl缓冲溶液5mL,操作如表3所示。
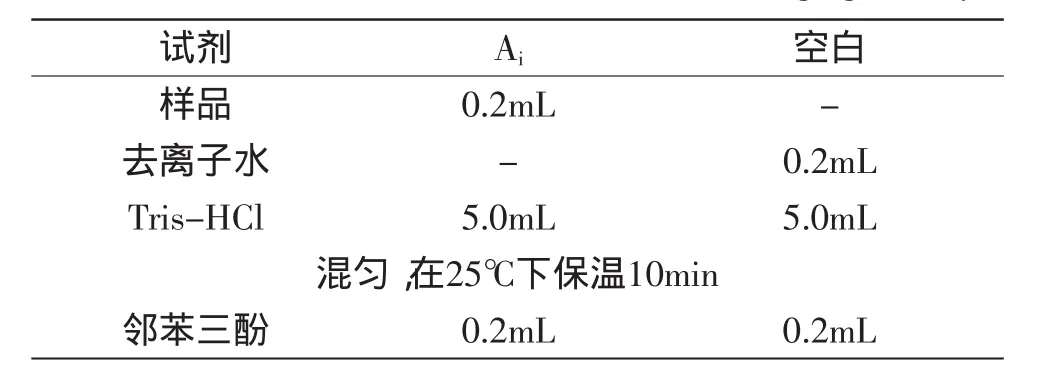
表3 超氧阴离子清除能力测定Table 3 The determination of O2-radical scavenging activity
按照表3中的步骤处理样品后,在325nm每30s读数一次,5min后结束以等体积去离子水和Tris-HCl缓冲液混合液空白调零。
按下式计算样品对超氧阴离子的抑制率:
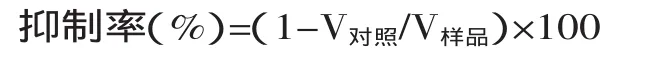
式中:V对照—对照组邻苯三酚自氧化速率(ΔA/ min);V样品—样品组邻苯三酚自氧化速率(ΔA/min)。1.2.5可溶性蛋白的质量分数(SPC)测定考马斯亮蓝G-250在稀酸环境中与蛋白质的疏水区结合,最大吸收由465nm变为595nm,由红色变为青色。在一定蛋白质浓度范围内(1~100μg),取上清液加入考马斯亮蓝G-250色素,其结合物在595nm波长下的光吸收,并以牛血清作为标准蛋白做标准曲线[18],按照此法确定上清液中蛋白质的质量。样品的总氮可参照凯氏定氮法,按照以下公式计算可溶性蛋白质量分数:

式中:A为上层清液中蛋白质质量,mg;B为样品总蛋白质质量,mg。
1.2.6合浦珠母贝肉酶解液产物稳定性影响因素实验在日常的加工过程中,加工的样品会在各道工序中被添加不同的添加剂,根据需要会添加限制剂量的食品辅料、防腐剂和金属离子等,本实验根据已报道的多篇抗氧化性稳定性文献确定了较宽泛的添加剂量,以确定对样品影响一切可能性和趋势。
1.2.6.1食品辅料的影响配制脱盐后肽液的浓度为10mg·mL-1,分别添加等体积不同质量分数NaCl、蔗糖和葡萄糖的溶液,保存在4℃下测定其活性和可溶性蛋白质量分数。
1.2.6.2防腐剂的影响配制脱盐后肽液浓度10mg·mL-1,分别添加不同质量分数等体积的山梨酸钾和苯甲酸钠溶液,质量浓度为0.2%、0.4%、0.6%、0.8%和1%,保存在4℃下测定其活性和可溶性蛋白质量分数。
1.2.6.3金属离子的影响不同添加量的金属离子会对其有不同的影响,本实验分别配制脱盐酶解物浓度为10mg·mL-1,分别添加不同质量分数等体积的K+、Ca2+、Mg2+、Zn2+、Cu2+金属离子的溶液,质量浓度为0.005、0.01、0.050、0.50、50mg·mL-1,保存在4℃下测定其DPPH·清除率、·OH清除率和可溶性蛋白质量分数。
1.2.6.4光照的影响配制脱盐酶解物浓度为10mg·mL-1,在室温条件下设立有日光灯照射的光照组和避光组,并在其保存时间的第1、3、5、10、30d取样测定指标。
1.3统计分析
每个处理重复3次平行,部分数据结果采用SPSS 17.0方差分析。结果表示为x±s,当p<0.05时为有差异显著性。
2 结果与分析
2.1不同浓度NaCl对AOP的影响
表4是不同质量浓度的NaCl对AOP的抗氧化活性以及SPC的跟踪测试结果。由表4可知,NaCl的浓度随着时间延长,每次抽样测得的活性指标和SPC变化没有规律可循,即对其活性和SPC并没有太大的影响,多重比较分析结果在前5d各指标的对比并不显著,后期随着时间SPC的变化较显著,不同浓度间并无明显变化,由此可知其影响较小,在加工中可以根据需要加入该食品辅料。此现象表明,NaCl基本不影响AOP的活性,随着5d之后时间的推移,不同浓度间变化小,而与前期相比变化增大,可能是贮藏期限对其活性影响的结果。
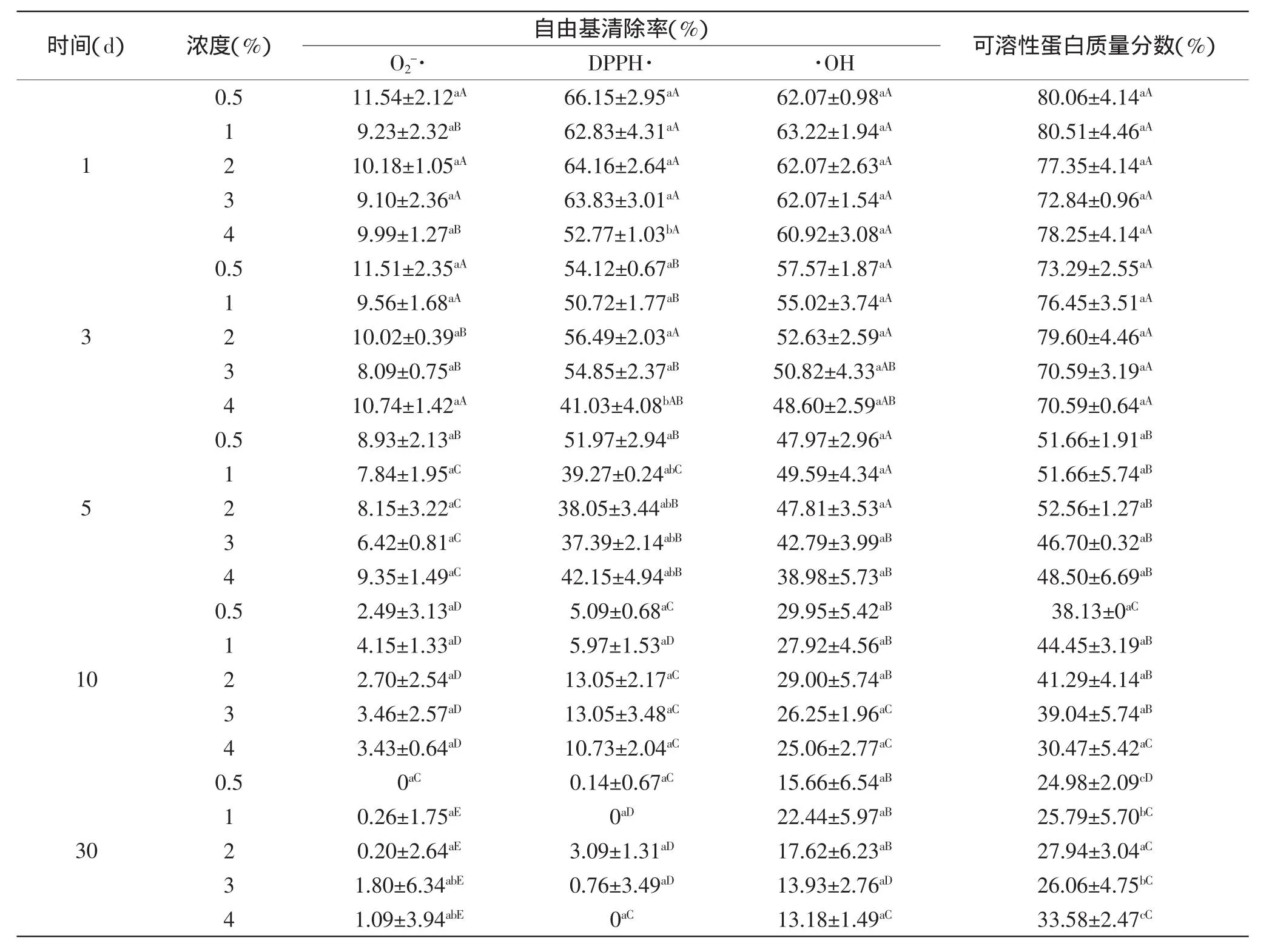
表4 不同浓度NaCl对AOP自由基清除率和可溶性蛋白质量分数的影响Table 4 Effect of NaCl concentration on free radicals scavenging capacity and soluble protein content of the rude product
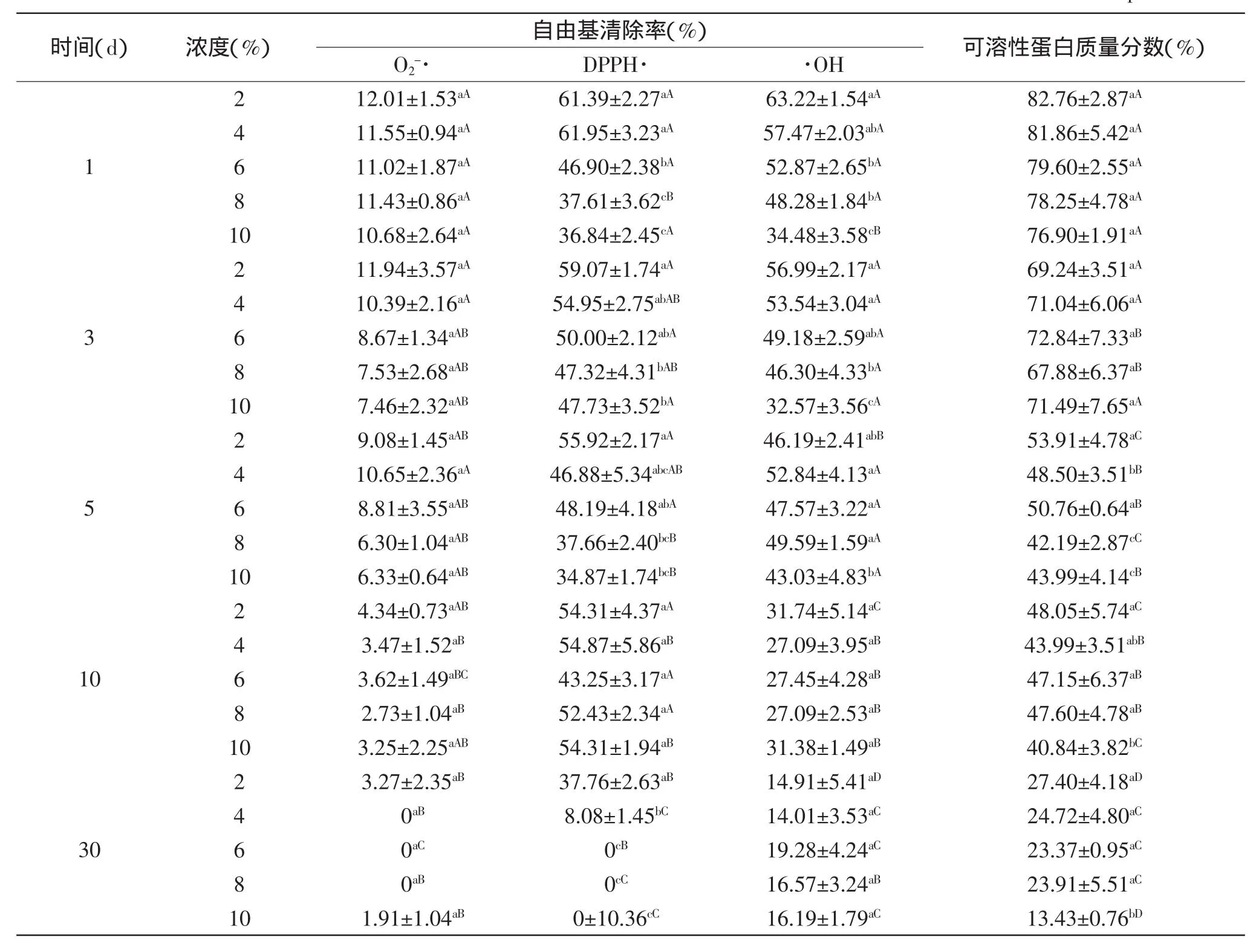
表5 不同蔗糖浓度对AOP自由基清除率和可溶性蛋白质量分数的影响Table 5 Effect of sucrose concentration on free radicals scavenging capacity and soluble protein content of the rude product
2.2糖的影响
2.2.1蔗糖的影响从表5中可以看出,随着时间推移,样品对O2-·、DPPH·和·OH的清除能力逐渐降低,可溶性蛋白的量也在减少,后期出现大量的不溶固形物,离心取上清液测定以上指标时呈现悬浊状态,因而后期测算的标准偏差也较大。在前5d的时候,虽然大体也是呈现下降趋势,但是可以发现,蔗糖浓度大则不利于其短期内活性的保持。5d以后,不同质量浓度的蔗糖则几乎没有影响,与赵谋明等[19]对蓝园鲹抗氧化肽稳定性的研究结果一致。
2.2.2不同葡萄糖浓度的影响从表6中可以看出,葡萄糖的浓度增大,DPPH自由基和·OH的清除率有显著差异,说明其抗氧化能力随浓度变化而降低,且前5d的SPC基本不变。随着时间延长,SPC降低,清除自由基的能力均下降。造成该现象的原因,一方面是因为贮藏时间的缘故,另一方面前期的活性变化要进一步的深入研究。由此可见,葡萄糖不利于此抗氧化产物的活性保持,因此在应用时不宜和葡萄糖同时使用。
2.3防腐剂的影响
不同质量浓度的防腐剂山梨酸钾和苯甲酸钠,在保存期间跟踪测试其抗氧化活性和SPC,结果分别见表7和表8。在表7中,在实验浓度范围内,随着山梨酸钾浓度的增加,结合抗氧化能力和SPC可以看出,5d之前没有明显的变化,5d之后0.6%的山梨酸钾有利于脱盐产物的活性和蛋白链结构的保持,在其他浓度的山梨酸钾作用下,自由基清除率和SPC下降较快。从表8中可以看出,苯甲酸钠的作用效果比山梨酸钾的大,5d之后,在0.4%的苯甲酸钠浓度下,自由基清除率下降的速度比对0.6%山梨酸钾作用下慢。从两表中可看出,表8在前5d的同防腐剂浓度下,各指标的变化均呈现一般显著性,而表7相对变化更加显著;且在后5d,不同浓度的防腐剂保存AOP,随时间变化各指标显示结果也是表7的变化更加显著。此现象说明两种防腐剂可能需要合适的浓度才能对AOP抗氧化活性以及可溶性结构其到稳定作用,这也与朱淑云等[20]研究结果相符,即一定浓度的防腐剂会降低其活性。预实验并结合其他学者的相关研究结果,已证实小浓度的防腐剂对其活性变化影响较小,实验选取了超出国家安全标准规定的浓度来做基础实验,进一步研究其影响。
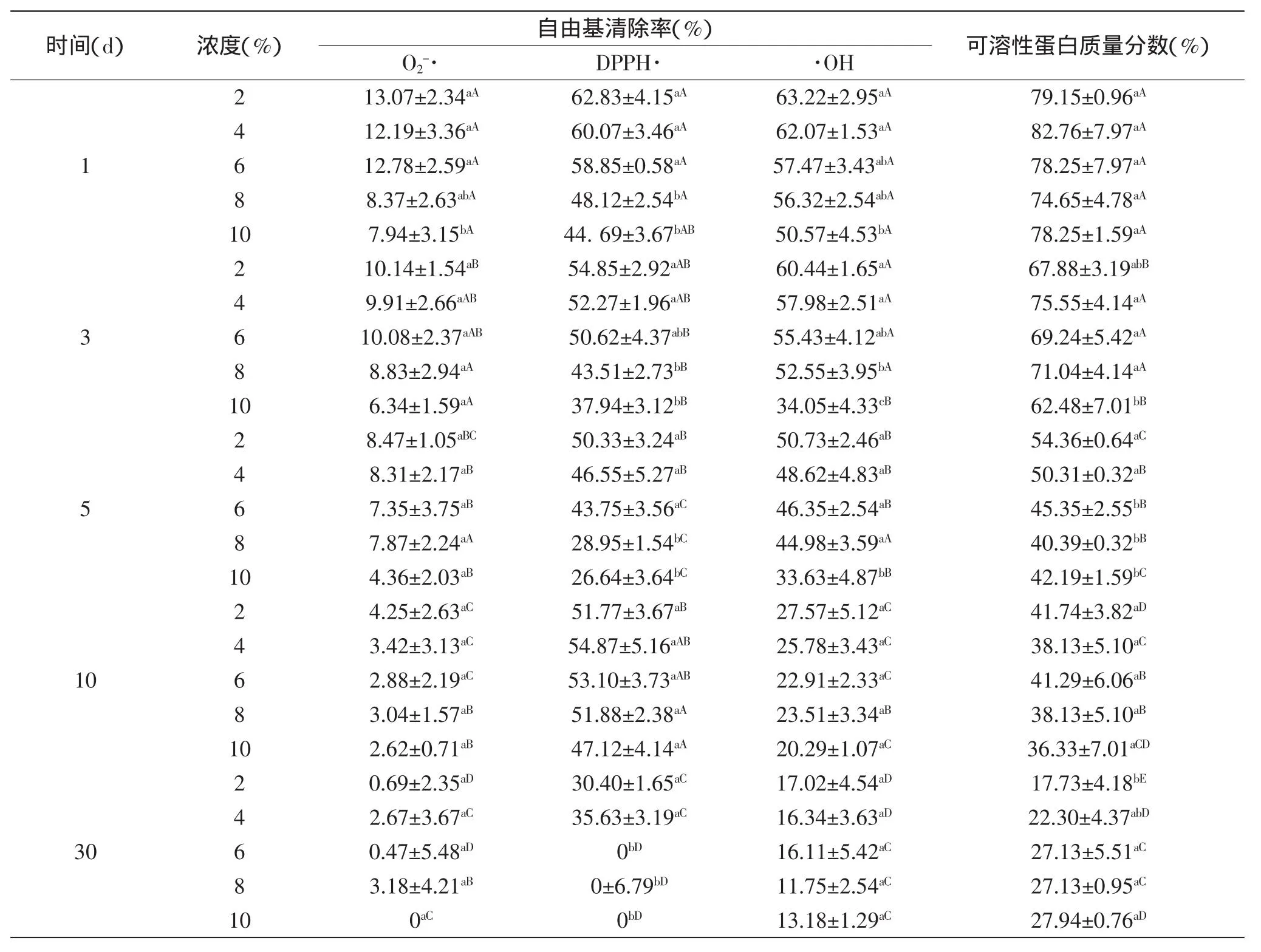
表6 不同葡萄糖浓度对AOP自由基清除率和可溶性蛋白质量分数的影响Table 6 Effect of glucose concentration on free radicals scavenging capacity and soluble protein content of the rude product
2.4金属离子的影响
在食品中,经常会存在一些对人体有益的金属离子,或者作为强化剂添加在食品中,所以必须考虑这些常见金属离子对合浦珠母贝肉抗氧化肽的稳定性影响。在实验浓度范围内,不同的金属离子对脱盐产物的DPPH·、·OH清除率和可溶性蛋白的质量分数的影响程度也不同,具体结果见图1~图3。
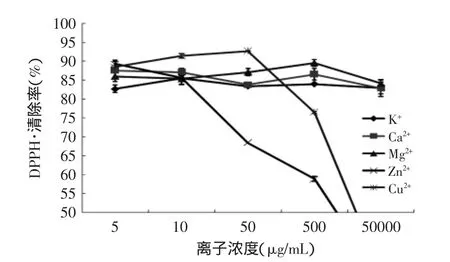
图1 不同离子对产物DPPH·清除能力的影响Fig.1 Effect of different metal ions on scavenging rates of the rude product against DPPH free radicals
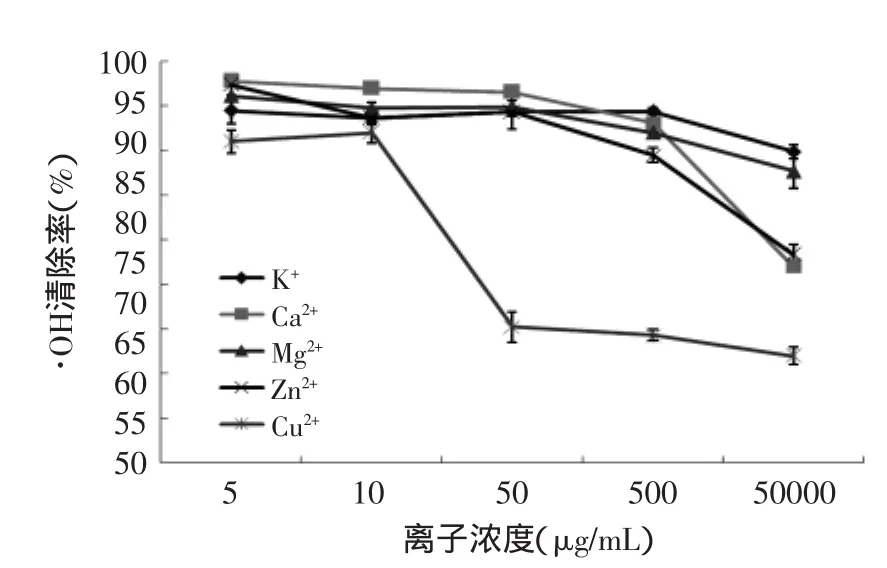
图2 不同离子对产物·OH清除能力的影响Fig.2 Effect of different metal ions on scavenging rates of the rude product against OH free radicals
由图1可知,不同浓度K+、Ca2+和Mg2+对样品的DPPH自由基清除率影响较小,与孟良玉等[21]就金属离子对蜂胶提取物抗氧化活性的研究结论一致。而Zn2+和Cu2+的影响较大,Zn2+在0.01mg·mL-1后其对DPPH·清除率下降迅速,同样Cu2+在0.05mg·mL-1后有同样的影响效果,但是不同的是Cu2+0.05mg·mL-1之前呈现些许的上升的趋势,可能是肽的螯合作用增强了对DPPH自由基的清除能力。此结果与游丽君等[22]就金属离子对泥鳅多肽的抗氧化性的影响研究结果一致。
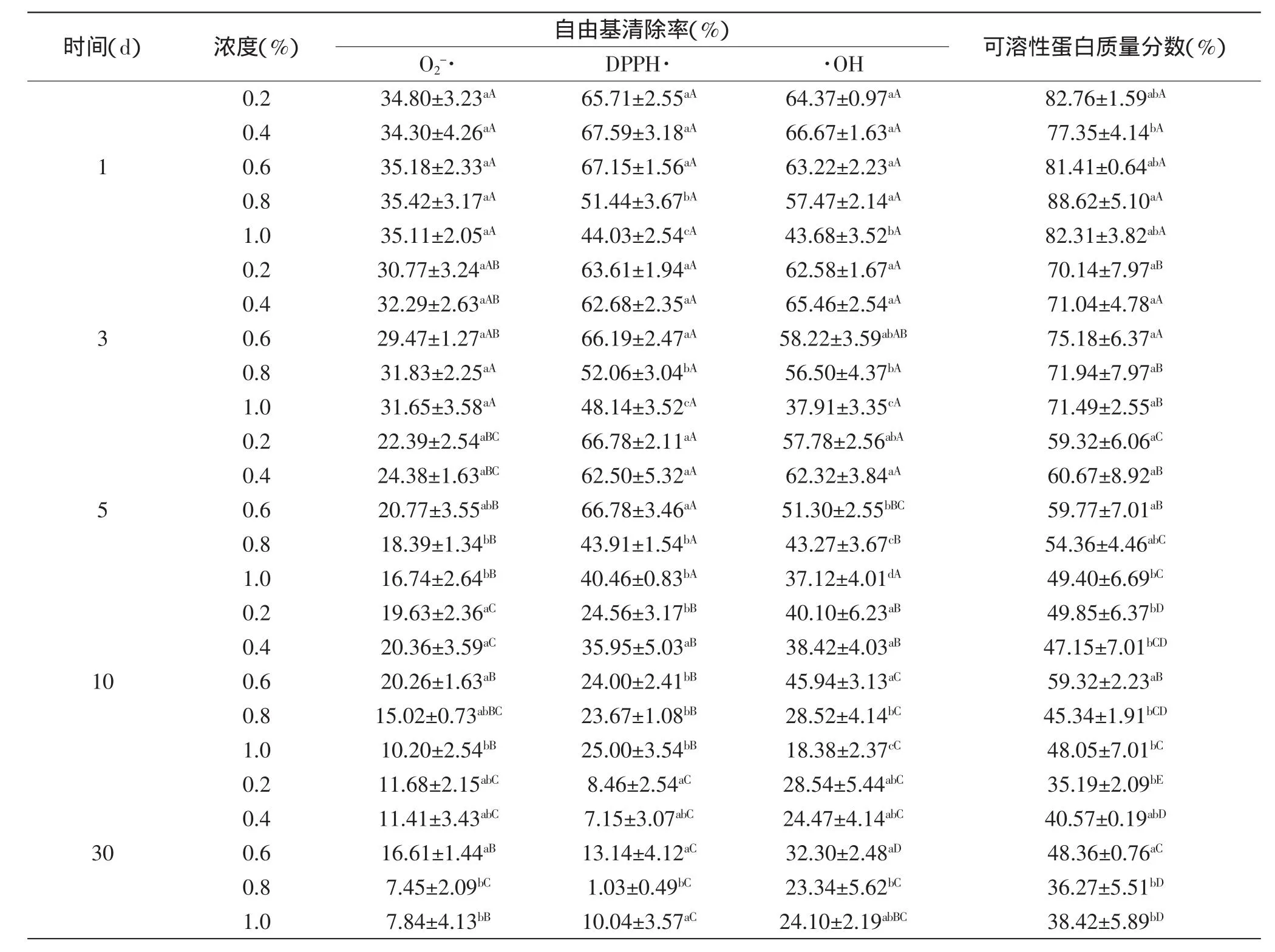
表7 不同山梨酸钾浓度对AOP自由基清除率和可溶性蛋白质量分数的影响Table 7 Effect of potassium sorbate concentration on free radicals scavenging capacity and soluble protein content of the rude product
由图2可知,在5~500μg·mL-1范围内,K+、Ca2+、Mg2+和Zn2+对样品的·OH清除率影响较小,曲线没有明显的变化,但之后会有所下降。而Cu2+的影响较大,0.01~0.05mg·mL-1范围内样品对·OH清除率急速下降,之后则较平缓。由图3可见,不同离子在不同的浓度同样对蛋白的溶解性也有一定的影响。从以上三个图中的结果来看,这可能是因为样品对Zn2+和Cu2+的螯合能力较好,但也有一定的限度,螯合物对其结构存在一定的影响,从而影响其活性变化。
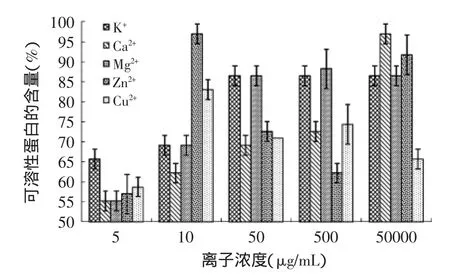
图3 不同离子对产物可溶性蛋白质量分数的影响Fig.3 Effect of different metal ions on soluble protein content of the rude product
2.5光照的影响
图4是光照对产物清除超氧阴离子能力的影响结果,对于超氧阴离子的清除能力,光照与避光相比没有大的影响。此点与于志鹏等[23]对光照引起蛋清蛋白质降压肽的活性变化并不显著的结果相吻合。
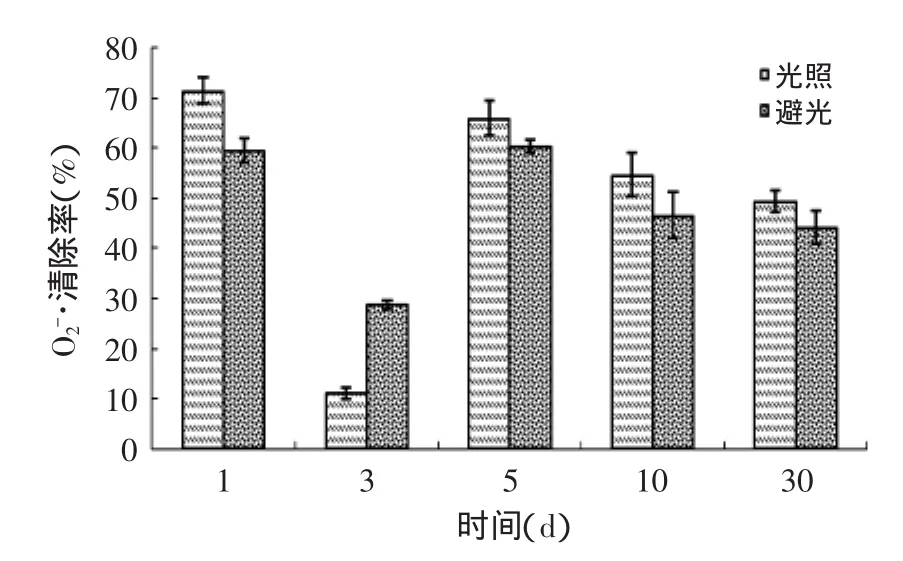
图4 光照对产物清除能力的影响Fig.4 Effect of light on scavenging rates of the rude product againstfree radicals
图5中,随着时间增加,避光的样品对DPPH自由基的清除能力有几近相同逐渐显现出优势,说明避光保存样品,有利于其对DPPH自由基的清除能力保持,长时间光照会影响其活性的变化。同样,图6是光照对样品清除羟自由基能力的影响结果,其效果与图5相似。
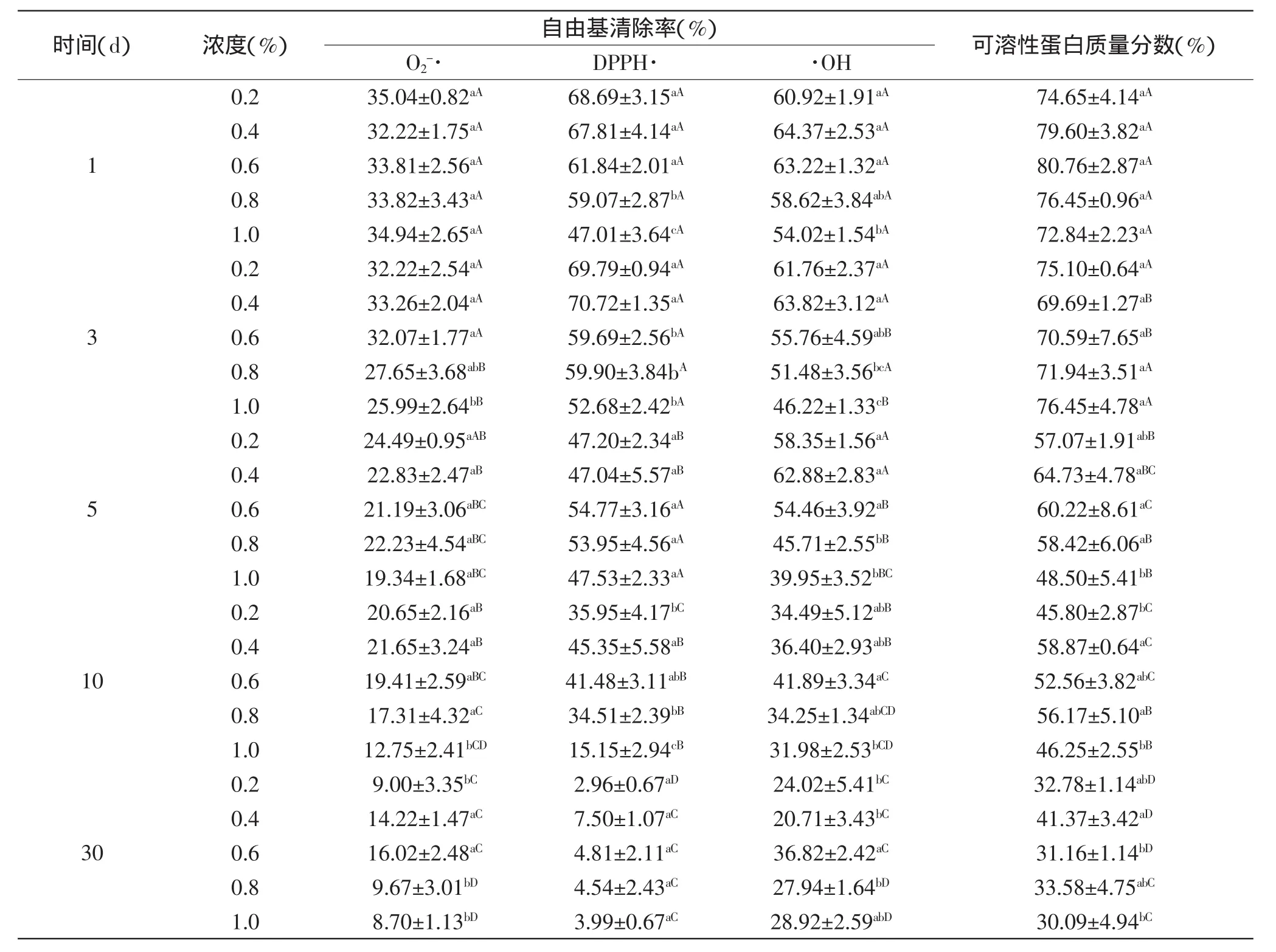
表8 不同苯甲酸钠浓度对AOP自由基清除率和可溶性蛋白质量分数的影响Table 8 Effect of sodium benzoate concentration on free radicals scavenging capacity and soluble protein content of the rude product
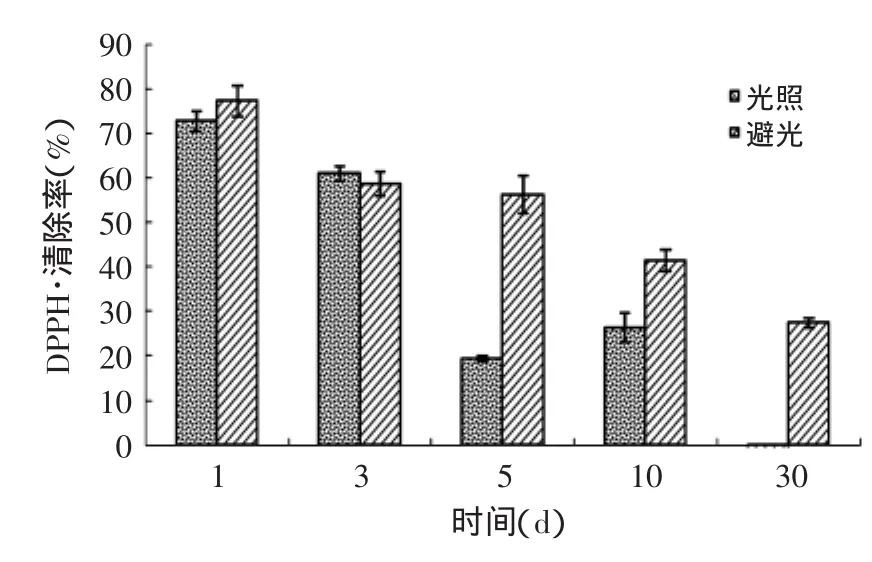
图5 光照对产物DPPH·清除能力的影响Fig.5 Effect of light on scavenging rates of the rude product against DPPH free radicals
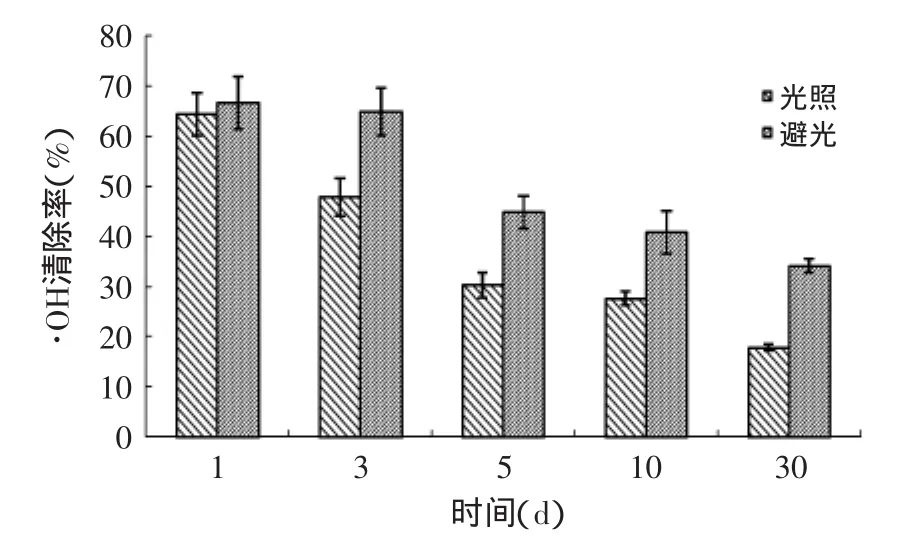
图6 光照对产物·OH清除能力的影响Fig.6 Effect of light on scavenging rates of the rude product against OH free radicals
图7中是光照与避光对样品中可溶性蛋白质量分数的影响结果,从图7中可以看出,前3d,两组下降程度相同,但避光稍好。之后光照组的样品随着时间延长,其下降的趋势也逐渐增大,避光组则相对较平缓,说明光照不利于合浦珠母贝蛋白结构的保存,此处与游丽君等[22]就光照对泥鳅多肽的抗氧化性的影响研究结果一致。
本实验中发现AOP在光照条件下,对超氧阴离子的清除能力在跟踪期限内变化不显著,而对DPPH·和·OH随着时间延长其清除能力下降,相应的在图7中也显示5d后光照对可溶性蛋白含量有显著影响。综合比较分析,光照可能影响AOP中存在的抗氧化片段中供质子体或者与自由基结合形成的电子云结构的稳定性,图7中也侧面证明了光照对其蛋白结构的影响,结构变化影响其被氧化。然而其精确的机理还需要进一步的研究加以证明。
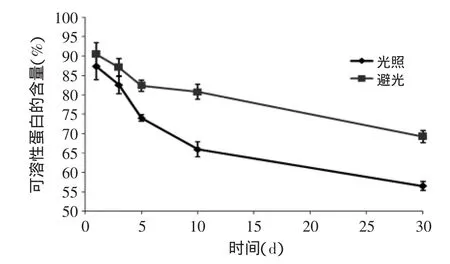
图7 光照对产物可溶性蛋白质量分数的影响Fig.7 Effect of light on soluble protein content of the rude product
3 结论
食品添加剂中NaCl和蔗糖对合浦珠母贝肉抗氧化肽的活性以及可溶性蛋白的影响较小,而葡萄糖在样品保藏过程中,随着时间延长,会使抗氧化能力和SPC降低速度增加。防腐剂山梨酸钾的浓度为0.6%时有利于AOP抗氧化活性的保持,而苯甲酸钠的效果较山梨酸钾相对较大,对样品两项指标保持较好的浓度为0.4%。不同的金属离子在不同浓度下,对其抗氧化能力和SPC的影响不同。Cu2+的影响最大,所以添加该离子时,要注意浓度范围,小于0.05mg·mL-1下较好。光照不利于其抗氧化能力的保持,也会对合浦珠母贝蛋白造成一定的影响,故而避光保存较好。
综上可以说明此酶解产物会在应用过程中受到食品类添加剂、防腐剂、金属离子以及光照等的影响,对不同因素,其稳定性表现出不同程度的变化,以期此实验可以为其在后续应用中,针对性地保护其抗氧化稳定性,提高对抗氧化肽的利用率,将成为抗氧化剂研究的重点[24]。
[1]Igor B Afanas’ev,Anatolii I Dcrozhko,Aleksander V Brodskii,et al.Chelating and free radical scavenging mechanisms of inhibitory action of rutin and quercetin in lipid peroxidation[J]. Biochem Pharmacol,1989,38(11):1763-1769.
[2]Hui-Chun Wu,Hua-Ming Chen,Chyuan-Yuan Shiau.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Res Inter,2003,36(9-10):949-957.
[3]Bahareh H.Sarmadi,Amin Ismail.Antioxidative peptides from food proteins:A review[J].Peptides,2010,31(10):1949-1956.
[4]UchidaK,Kawakishi S.Sequence-dependent reactivityof histidine containing peptides with copper(Ⅱ)ascorbate[J].J Agric Food Chem,1992(40):13-16.
[5]吴燕燕,李来好,杨贤庆,等.栅栏技术优化即食调味珍珠贝肉工艺的研究[J].南方水产,2008,4(6):56-62.
[6]Eresha Mendis,Niranjan Rajapakse,Se-Kwon Kim.Antioxidant propertiesofaradical-scavengingpeptidepurifiedfrom rnzymatically prepared gish dkin helatin hydrolysate[J].J Agric Food Chem,2005,53(3):581-587.
[7]Je Jae Young,Park Pyo Jam,Kim Se Kwon.Antioxidant activity of a peptide isolated from Alaska pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food Res Inter,2005,38(1):45-50.
[8]Wu H C,Chen H M,Shiau C Y.Free amino acides and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Res Inter,2003(36):949-957.
[9]王晶,孔保华.玉米蛋白抗氧化肽的制备及其在熟肉糜中的应用[J].肉类研究,2009(11):42-47.
[10]石丽梅,唐雪燕,何志勇,等.玉米抗氧化肽对于中式香肠的氧化稳定性的影响[J].食品科技,2008(10):135-139.
[11]Shin-Ichi Togashi,Noriko Takahashi,Masanori Iwama,et al. Antioxidative collagen-derived peptides in human-placenta extract[J].Placenta,2002,23(6):497-502.
[12]杜登学,王姗姗,周磊.肽类在化妆品中的应用[J].山东轻工业学院学报:自然科学版,2012,26(1):35-39.
[13]Yanyan Wu,Jing Wang,Laihao Li,et al.Desalination of antioxidantpeptidesfromPinctadaFucatausingC18chromatographic column[J].Advances in Chemical EngineeringⅢ,2013,781,1508-1512.
[14]Niranjan Rajapakse,Eresha Mendis,K W Jung,et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Res Inter,2005,38:175-182.
[15]刘秋风,吴成业,苏永昌,等.龙须菜中硫琼脂的体外抗氧化评价及降血糖、降血脂活性的动物实验[J].南方水产科学,2013,9(3):57-66.
[16]吴燕燕,尚军,李来好,等.合浦珠母贝肉短肽的分离及其抗氧化活性研究[J].食品工业科技,2012,33(7):123-126.
[17]田倩,吴燕燕,李来好,等.合浦珠母贝肉酶解液中抗氧化肽的分离及活性研究[J].食品科学,2011,32(增刊):144-148.
[18]曲春香,沈颂东,王雪峰,等.用考马斯亮蓝测定植物粗提液中可溶性蛋白质质量分数方法的研究[J].苏州大学学报:自然科学版,2006.22(2):82-85.
[19]赵谋明,何婷,赵强忠,等.蓝园鲹抗氧化肽抗氧化稳定性研究[J].食品科学,2009,30(1),128-130.
[20]朱淑云,董英,周越,等.水飞蓟粕蛋白酶解物抗氧化稳定性研究[J].临产化学与工业,2012,32(2):153-157.
[21]孟良玉,卢佳琨,兰桃芳,等.蜂胶提取物抗氧化稳定性研究[J].食品科学,2012,33(7):127-130.
[22]游丽君,赵谋明,Regenstein Joe,等.加工和贮藏条件对泥鳅多肽抗氧化活性的影响[J].江苏大学学报:自然科学版,2009,(6):549-553.
[23]于志鹏,赵文竹,于一丁,等.蛋清蛋白质降压肽的化学及酶稳定性研究[J].食品科学,2010,39(9):23-26.
[24]孙宏,吴逸飞,冯国强,等.蛋白水解物的生产和抗氧化活性评价及其作用机理[J].中国畜牧杂志,2012,48(5):63-66.
Effect of additives and illumination on antioxidant activity of antioxidant peptides derived from Pinctada fucata protein
WU Yan-yan1,WANG Jing1,2,LI Lai-hao1,YANG Xian-qing1,HU Xiao1,ZHOU Wan-jun1
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Lab of Aquatic Product Processing,Ministry of Agriculture,Guangzhou 510300,China;2.College of Food,Shanghai Ocean University,Shanghai 201306,China)
To find out whether antioxidant peptides derived from Pinctada fucata protein in the application under the influence of food additives and light.The scavenging capacities against DPPH,hydroxy free radicals,superoxide anions and soluble protein content(SPC)served as the indexes,we measured its oxidation stability by food materials(NaCl,sucrose and glucose),concentration of different preservatives(sodium benzoate and potassium sorbate),metal ions(K+,Ca2+,Mg2+,Zn2+和Cu2+)and the influence of illumination.The results showed that antioxidation peptide activity was less affected by NaCl and sucrose in 0.5%~4.0%and 2.0%~10.0%,but strongly influenced by glucose for long time preservation.Preservative affected their antioxidant activity and SPC,and the effect of sodium benzoate(0.4%)effect stronger than potassium sorbate(0.6%).K+,Ca2+,Mg2+less effect on its ability of scavenging free radicals,but the influence of Cu2+maximum,especially in the bigger concentration than 50μg·mL-1.Light could reduce its antioxidant capacity and didn’t do good to its storage.
Pinctada fucata protein;antioxidant peptides;food additives;illumination;antioxidant stability
TS254.9
A
1002-0306(2015)02-0149-08
10.13386/j.issn1002-0306.2015.02.024
2014-06-04
吴燕燕(1969-),女,博士,研究员,研究方向:水产品加工与质量安全控制。
广东省科技计划项目(2011B031200009);海南省重点科技项目(ZDXM20100005);国家海洋局海洋公益性行业科研专项(201305018)。

