一氧化碳释放分子-2对小鼠急性肝功能衰竭保护作用的实验研究
颜炳柱 王晓韧 许磊 朱安超 杨宝山 刘冰熔
·论 著·
一氧化碳释放分子-2对小鼠急性肝功能衰竭保护作用的实验研究
颜炳柱 王晓韧 许磊 朱安超 杨宝山 刘冰熔
目的 探讨一氧化碳释放分子-2对小鼠急性肝功能衰竭(ALF)的保护作用及机制。方法 雄性C57BL/6小鼠30只随机分为对照组、模型组和保护组,每组10只。通过一次性腹腔注射脂多糖/D-氨基半乳糖(LPS/D-GalN)构建小鼠ALF的动物模型,CORM-2于造模前30min行尾静脉注射,造模后6h分别留取血清、肝组织标本。生化分析仪检测血清中ALT、AST水平,HE观察肝脏病理改变,酶联免疫吸附法(ELISA)检测血清中TNF-α和IL-6的水平,反转录酶-聚合酶链反应(RT-PCR)检测肝组织中TNF-α和IL-6mRNA的表达。结果 保护组小鼠血清ALT[(1274.60±157.24)U/L比(3499.00±136.19)U/L]和AST[(1151.50±244.58)U/L比(4079.50±481.11)U/L]水平均明显低于模型组(均t1=33.81,t2=17.16,P<0.05);与模型组比较,保护组肝组织炎性细胞浸润明显减少,肝细胞坏死程度明显减轻[(0.14±0.05)比(0.37±0.05),t=10.29,P<0.05];保护组小鼠血清和肝组织中TNF-α[(139.60±28.39)pg/mL比(447.34±128.17)pg/mL、(0.31±0.03)比(0.69±0.05)]和IL-6[(215.21±85.16)pg/mL比(1461.58±244.90)pg/mL、(0.33±0.03)比(0.72±0.05)]表达水平明显低于模型组(均t1=7.41,t2=20.61,t3=15.20,t4=21.15,P<0.05)。结论
急性肝衰竭;一氧化碳释放分子-2;炎症;肿瘤坏死因子-α;白细胞介素-6
急性肝功能衰竭(acute liver failure,ALF)是由多种因素引起的严重肝脏损害,具有较高的病死率,其发病机制尚未完全阐明,也缺乏有效的药物治疗[1-2]。因此,探讨对ALF的新的治疗措施具有重要的研究价值和临床意义。研究证实,CO 作为机体内一种重要的细胞信使分子,具有极其重要的生物学功能,如抗炎、抗凋亡和细胞保护作用[3]。一氧化碳释放分子-2(tricarbonyldichlororuthenium II dimmer,CORM-2)是近年来新合成的一种CO复合物,经适当溶剂溶解后能够提供外源性CO分子,较CO气体而言,其浓度相对容易控制并且又能够使碳氧血红蛋白保持在较低水平[4]。本研究采用脂多糖(LPS)和D-氨基半乳糖(D-GalN)构建急性肝衰竭动物模型,并给予CORM-2进行预保护,旨在探讨其可能的作用机制。
资料和方法
一、实验动物与材料
(一)动物 健康雄性C57BL/6小鼠,8~10周龄,体质量20~22 g,由哈尔滨医科大学动物实验中心提供(动物许可证号:SCXK京2012-0001),清洁级饲养,实验前12 h开始禁食。
(二)试剂和仪器CORM-2、LPS和 D-Gal N购于美国Sigma公司;二甲基亚枫(DMSO)购于Sigma公司;二氨基联苯胺染色试剂盒(DAB)购于武汉博士德公司;TNF-α和IL-6ELISA检测试剂盒为BG公司;Taq酶、RT-PCR试剂盒为美国Promega公司产品。PCR扩增仪(Gene Amp PCR System 9700,美国),全自动生化分析仪(Dimension○REXLTMwith LM,SIEMENS)。
二、实验方法
(一)动物模型与分组将30只小鼠按照随机原则分为对照组、模型组和保护组,每组10只。模型组和保护组一次性腹腔注射LPS(100μg/kg)和D-GalN(800mg/kg),保护组于造模前30min予以CORM-2(8mg/kg)尾静脉注射,而模型组、对照组分别注射同等体积0.9%氯化钠溶液作为对照,各组分别于给药后6h采集血清和肝组织标本。
(二)肝功能检测小鼠去眼球后静脉采血,静止30min,3500r/min离心(r=8cm)15min后取上清液;应用全自动生化分析仪分析ALT和AST水平,判断肝脏功能改变情况。
(三)肝组织学检测采血取样后迅速断颈处死小鼠,无菌取肝脏组织,4%多聚甲醛液固定,石腊包埋、切片,5μm厚,按试剂盒说明书操作,进行HE染色,光学显微镜下观察肝脏组织病理学改变。肝脏组织病理学评分按照以往文献进行[5]。
(四)血清TNF-α和IL-6测定收集各组小鼠血清,应用肝素抗凝后,室温静置30min,离心,取上清液,-20℃保存,具体按ELISA试剂盒说明书操作。
(五)肝组织中TNF-α和IL-6mRNA检测取肝脏组织100mg,应用Trizol试剂盒参照说明提取总RNA,用紫外分光光度法测定所提取总RNA含量,各标本总RNA经定量后,取1μg反转录成cDNA,反应体系20μL,42℃15min,95℃5min,4℃5min。取cDNA1.5μL进行扩增PCR,反应体系25μL,反应条件均为:94℃2min;96℃15s,62℃20s,70℃1min,35个循环;70℃5min。采用Primer5.0设计软件设计引物,由上海生工生物工程公司合成引物,具体见表1。PCR产物经1%琼脂糖凝胶电泳后,紫外线分析仪下观察、摄片用Quantity-One4.31软件进行条带扫描半定量分析,计算基因相对表达量,目的基因相对表达量=目的基因条带密度/GAPDH基因条带密度。

表1 引物序列
三、统计学处理
使用SPSS13.0统计软件进行统计处理,计量资料采用均数±标准差(x-±s)表示,两组间比较采用t检验,多组之间比较采用单因素方差分析,显著性检验水准a=0.05,P<0.05为差异有统计学意义。
结果
一、CORM-2对血清转氨酶的影响
与正常组比较,模型组血清ALT和AST水平明显升高;给予CORM-2干预后,ALT和AST水平明显降低,差异有统计学意义(t1=33.81,t2=17.16,P<0.05),见表2。
二、病理学改变
正常组:肝组织染色均匀,肝小叶结构清晰,细胞排列规则,细胞核形态正常,未见炎性细胞浸润及凋亡和坏死现象。模型组:可见肝组织呈灶状或片状坏死,肝细胞明显水肿和疏松化,肝窦内充血、扩张明显,汇管区有大量炎性细胞浸润。保护组:肝脏组织病变较轻,肝细胞坏死面积较少、呈散在碎片状,坏死区可见少量炎性细胞浸润。肝脏组织病理学评分比较,模型组与保护组差异有显著统计学意义(t=10.29,P<0.05)。见图1、表2。

表2 各组转氨酶、病理学评分比较(-x±s)
三、TNF-α和IL-6血清水平变化
与正常组比较,模型组血清TNF-α和IL-6水平明显升高;给予CORM-2干预后,TNF-α和IL-6水平明显降低,差异有统计学意义(t1=7.41,t2=20.61,P<0.05),见表3。
四、肝组织TNF-α和IL-6mRNA表达
正常小鼠肝组织表达极少量的TNF-α和IL-6mRNA;模型组表达量明显增高;保护组给予CORM-2干预后,TNF-α和IL-6mRNA的表达量明显下调,差异有统计学意义(t3=15.20,t4=21.15,P<0.05)。见图2,表3。

图1 各组小鼠肝组织病理改变(HE染色,×200)

表3 各组血清和肝组织中TNF-α和IL-6表达水平的比较(-x±s)
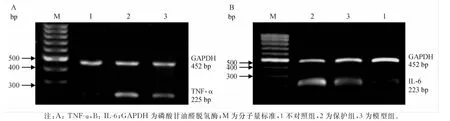
图2 各组小鼠肝组织TNF-α和IL-6表达
讨论
ALF的发病机制极其复杂,目前治疗措施尚未能完全阻止肝衰竭的进展,因此探索肝衰竭的发病机制及防治措施,具有重要的意义及广阔的应用前景。研究证实TNF-α,IL-6等炎性细胞因子的级联式释放是ALF发生发展的关键因素,不仅与肝细胞损伤密切相关,而且可直接反应肝脏炎性损伤程度[6-7]。因此,抑制TNF-α、IL-6促炎细胞因子的释放可能成为临床救治ALF的策略[8-9]。
CO作为机体内重要的气体信号分子,以往研究重点多集中在其毒理方面,但越来越多的研究者发现CO还具有抗炎、抗凋亡、扩张血管等多种生物学功能[10-12]。而外源性CO干预小鼠急性肝功能衰竭的研究目前较少,主要是因为外源性CO的动物实验其操作难度大,浓度不宜控制,且容易发生中毒,实际应用中受到了限制。CORM作为一种新合成的新型金属羰基化合物,经适当溶剂溶解后可在机体内缓慢、持续、可控地释放CO,并能够模拟内源性CO在体内产生的病理生理过程[13]。其中CORM-2是目前被用于动物实验最多的一类CO释放分子,溶于DMSO时能够释放CO,而且不升高动物体内碳氧血红蛋白浓度,不致使动物发生CO中毒,受到越来越多研究者的关注。在多种动物模型中,研究证实CORM-2能够释放CO并且具有保护肝脏、肺脏、肾脏、神经系统等重要器官的作用[14-17]。
本研究表明,给予LPS/D-GalN后小鼠ALT、AST水平明显升高,而CORM-2干预后能够极大地降低转氨酶水平。此外,对肝组织学的观察发现CORM-2显著抑制了LPS/D-GalN诱导ALF肝组织内的炎性细胞浸润、出血和坏死,这说明CORM-2有助于减轻肝细胞的损伤程度。CORM-2不仅抑制血清中TNF-α和IL-6水平,而且也抑制肝组织中TNF-α和IL-6的表达,提示CORM-2能够抑制促炎细胞因子的释放,从而减轻肝细胞的损伤。
综上所述,CORM-2对LPS/D-GalN诱导小鼠ALF进行干预,能够改善ALF时肝损伤程度,对小鼠ALF具有一定的保护作用,其机制可能与CORM-2减轻肝脏炎性反应有关。
1 Ichai P,Samuel D.Epidemiology of liver failure.Clin Res HepatolGastroenterol,2011,35:610-617.
2 Bernal W,Auzinger G,Dhawan A,et al.Acute liver failure.Lancet,2010,376:190-201.
3 Motterlini R,Otterbein LE.The therapeutic potential of carbon monoxide.Nat Rev Drug Discov,2010,9:728-743.
4 Winburn IC,Gunatunga K,Mckernan RD,et al.Cell damage following carbon monoxide releasing molecule exposure:implications for therapeutic applications.Basic Clin Pharmacol Toxicol,2012,111:31-41.
5 颜炳柱,陈立艳,康岚,等.组织蛋白酶 B抑制剂对小鼠急性肝功能衰竭的保护作用及机制.肝脏,2012,17:173-176.
6 刘晓燕,王慧芬.肝衰竭相关致炎因子与 TLR4的关系.肝脏,2009,14:68-70.
7 Zimmermann HW,Trautwein C,Tacke F.Functional role of monocytes and macrophages for inflammatory response in acute liver failure.Front Physiol,2012,3:56.
8 Choi JH,Kang JW,Kim DW,et al.Protective effects of Mg-CUD against-D-galactosamine-induced hepatotoxicity in rats.Eur J Pharmacol,2011,657:138-143.
9 Sugiyama A,Sato A,Shimizu H,et al.PEGylated Lactoferrin enhances its hepatoprotective effects on acute liver injury induced by D-galactosamine and lipopolysaccharide in rats.J Vet Med Sci,2010,72:173-180.
10 Olas B.Carbon monoxide is not always a poison gas for human organism:physiological and pharmacological features of CO.Chem Biol Interact,2014,222c:37-43.
11 Tsui TY,Obed A,Siu YT,et al.Carbon monoxide inhalation rescues mice from fulminant hepatitis through improving hepatic energy metabolism.Shock,2007,27:165-171.
12 Durante W,Johnson FK,Johnson RA.Role of carbon monoxide in cardiovascular function.J Cell Mol Med,2006,10:672-686.
13 Motterlini R,Mann BE,Foresti R.Therapeutic applications of carbon monoxide-releasing molecules.Expert Opin Investig Drugs,2005,14:1305-1318.
14 Wei Y,Chen P,de Bruyn M,et al.Carbon moxoxide-releasing molecule-2 (CORM-2) attenuates acute hepatic ischemia reperfusion injury in rats.BMC Gastroenterol,2010,10:42.
16 阮永乐,王璐,赵越,等.一氧化碳释放分子2减轻小鼠肾脏缺血再灌注损伤.中华器官移植杂志,2013,34:685-689.
15 杨运彩,周君琳,黄新莉,等.一氧化碳释放分子对肢体缺血-再灌注所致肺损伤的作用.中华急诊医学杂志,2012,21:43-47.
17 仇雪枫,孙炳伟,王敏,等.外源性一氧化碳释放分子对脓毒症小鼠神经系统抗炎的调节作用.江苏大学学报(医学版),2012,22:110-113.
An experimental study in protective effect of CORM-2 on acute liver failure in mice
YAN Bing-zhu,WANG Xiaoren,XV Lei,ZHU An-chao,YANG Bao-shan,LIU Bing-rong.Department of Infectious Diseases,the Second Clinical Hospital of Harbin Medical University,Harbin 150001,China
Objective To investigate the protective effect and mechanisms of carbon monoxide releasing molecule (CORM-2)on acute liver failure(ALF)in mice.Methods Male C57BL/6 mice were randomly divided into three groups:control,model and protected group.The ALF animal models were induced by intraperitoneal injection of lipopolysaccharide/D-galactosamine(LPS/D-GalN).CORM-2 was administered via tail vein 30 minutes before LPS/D-GalN treatment.All serum samples and liver specimens were collected for detection in 6 hours after the administration of LPS/DGal N.The serumLevels of alanine aminotransferase(ALT)and aspartate aminotransferase(AST)were measured by automatic biochemical analyzer.The liver pathologic changes were observed by light microscopy using hematoxylin and eosin (HE)staining.The serumLevels of tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6)were measured by enzyme linked immunosorbent assay(ELISA).The expression of TNF-αand IL-6 mRNA in the liver tissues were measured by reverse transcript polymerase chain reaction(RT-PCR)in each group.Results The serumLevels of ALT [(1274.60± 157.24)U/L vs(3499.00±136.19)U/L]and AST[(1151.50±244.58)U/L vs(4079.50±481.11)U/L]in protected group were significantly lower than those in model group(t1=33.81,t2=17.16 both P<0.05).Massive inflammatory cells infiltration and hepatocyte necrosis were widely spread in model group,while liver injuries were obviously relieved in protected group[(0.14±0.05)vs(0.37±0.05),t=10.29,P<0.05].The serumLevels of TNF-α[(139.60±28.39)pg/mL vs(447.34±128.17)pg/mL]and IL-6[(215.21±85.16)pg/mL vs(1461.58±244.90)pg/mL]in protected group were significantly reduced compared with model group(t1=7.41,t2=20.61 both P<0.05).TNF-αm RNA[(0.31±0.03)vs(0.69±0.05)]and IL-6 mRNA [(0.33±0.03)vs(0.72±0.05)]measured by RT-PCR in live tissues of protected group were also significantly lower than that in model group(both P<0.05).Conclusion CORM-2 could remarkably inhibit the inflammatory activity and attenuate liver injury,mechanism of which might be related to inhibiting the release of proinflammatory cytokines TNF-αand IL-6.
Acute liver failure;CORM-2;Inflammation;Tumor necrosis factor-α;Interleukin-6
2015-02-06)
(本文编辑:赖荣陶)
黑龙江省教育厅科学技术研究资助项目(12531294)
150001 哈尔滨医科大学附属第二医院感染科(颜炳柱,王晓韧,杨宝山),医务部(许磊),消化内科(刘冰熔);哈尔滨市第一医院病理科(朱安超)
刘冰熔,Email:liubingrong@ medmail.com.cn
CORM-2能够抑制小鼠ALF时的炎性反应,减轻肝脏病理损伤,其机制可能与抑制促炎细胞因子TNF-α和IL-6的释放有关。

