SPE-LC-MS/MS测定快餐纸袋中7种全氟有机物
徐 睿,谭 红,杨鸿波,*,孙海达,何锦林
(1.贵州大学,贵州贵阳550002;2.贵州省分析测试研究院,贵州贵阳550002)
SPE-LC-MS/MS测定快餐纸袋中7种全氟有机物
徐睿1,2,谭红2,杨鸿波2,*,孙海达2,何锦林2
(1.贵州大学,贵州贵阳550002;2.贵州省分析测试研究院,贵州贵阳550002)
建立了快餐纸袋中7种全氟有机物(全氟己酸、全氟庚酸、全氟辛酸、全氟壬酸、全氟十二烷酸、全氟十四烷酸、全氟辛烷磺酸盐)残留的固相萃取-液相色谱串联质谱(SPE-LC-MS/MS)分析方法。样品以1%甲酸-甲醇溶液超声提取,经C18固相萃取小柱净化,以0.1%甲酸乙腈-2mmol/L乙酸铵水溶液为流动相,经C8反相色谱柱分离,采用多反应监测(MRM)负离子模式检测,外标法定量。阴性样品添加实验表明:方法的检出限为0.008~0.104μg/kg(S/N=3);平均回收率为:80.2%~106.0%;相对偏差为:2.2%~8.1%(n=6)。该方法前处理简单,回收率高,精密度高,适用于各类快餐纸袋中全氟化合物的定量检测,为食品接触材料中全氟有机物的定量检测提供了方法。
液相色谱-串联质谱,快餐纸袋,全氟有机物,检测
全氟有机物(PFCs)具有化学惰性和耐热性等优良性能,自20世纪50年代开始就被广泛应用于涂料、织物、皮革、食品接触材料、地板亮光剂等[1-2]物质的制备中。作为优良的疏水疏油抗静电的人工合成表面活性剂[3],其大量的生产和使用已在生态系统中大量累积并对环境造成了严重的持久性污染。目前,在全球范围内调查的地下水、地表水、海水、环境样品、野生动物和人体内都已经检测到PFCs的存在[4-6];而有研究表明:PFCs是目前最难降解的物质之一[7]。毒理学研究表明:PFCs是一类具有肝脏毒性、心血管毒性、发育毒性、免疫系统毒性、内分泌干扰性及潜在致癌性[2]的全身多脏器官的污染物,可以抑制人体中过氧化物酶合成,影响能量传递、破坏细胞膜,从而诱发癌症、肝肿大等疾病[8-12]。鉴于PFCs存在的广泛性及对环境和生物体造成的危害,2009年5月,在日内瓦举行的斯德哥尔摩大会缔约国会议上,全氟辛基磺酸及其盐类、全氟辛基磺酰氟作为新增持久性有机污染物被正式列入公约附件B中加以限制[13]。美国、加拿大、欧盟等国家和地区相继颁布了相关法规禁止PFCs在某些领域内使用,同时限制该类物质的最大允许添加量[14]。2013年6月,全氟辛酸和全氟辛酸铵被列为第9批SVHC(Substances of Very High Concern,高度关注物质)。
近年来,纸质包装逐渐成为包装材料的主角,被广泛地应用于食品行业中[15],如各种蛋糕托纸、面包纸袋和快餐食品包装等。这些纸质包装材料直接与食品接触,其中有毒有害物质将会迁移进入到食品中,并最终进入人体,给人类健康带来危害[16-19]。而随着社会节奏的加快,越来越多的人选择快餐食品作为日常饮食之一。有研究指出:PFCs在高温条件下会从食品接触材料里迁移到食物中[20],因而膳食暴露也成为人体暴露于PFCs污染的重要来源[21]。因此确定快餐纸质包装材料中PFCs的检测方法,了解快餐纸质包装材料中PFCs的污染水平,对保护消费者具有十分重要的意义。本文利用SPE-LC-MS/MS建立了4类典型快餐纸袋中全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟十二烷酸(PFDoA)、全氟十四烷酸(PFTA)、全氟辛烷磺酸盐(PFOS)7种PFCs残留的分析方法,并对样品前处理方法、质谱条件等方面进行了比较和优化。本法前处理简单,回收率高,精密度与重现性好,特征离子相对强度比值稳定,适合于各类市售快餐纸袋中PFCs的定量检测。
1 材料与方法
1.1材料与仪器
全氟己酸、全氟庚酸、全氟辛酸、全氟十二烷酸、全氟十四烷酸、全氟辛烷磺酸盐7种标准品纯度>99%,德国Dr Enrenstorfer GmbH公司;甲醇、乙腈色谱纯,美国Honeywell公司;甲酸色谱纯,德国Merck公司;乙酸铵优级纯,天津科密欧;HLB固相萃取小柱规格500mg/6m L,天津奥秘科技有限公司;C18固相萃取小柱规格500mg/3m L,天津博纳艾杰尔科技有限公司;各类快餐纸袋均购自某家居公司;纯水。
Agilent 1200/6410液相色谱质谱联用仪(LC-MS/ MS) 美国Agilent公司;N-EVAP-111样品浓缩仪美国Organamation公司;GX-274全自动固相萃取仪美国Gilson公司;SHA-BA双功能水浴恒温振荡器广州永程公司;BG-OX数洗超声波清洗器广州邦杰公司;HH-2C数显恒温水浴锅金坛市鸿科仪器厂;RE-52A旋转蒸发仪上海亚荣仪器厂。
1.2实验方法
1.2.1标准工作液的配制准确称取0.01g(精确至0.1mg)PFCs标准品,用甲醇配制成浓度为1μg/m L单标标准储备液。分别准确吸取适量PFCs单标标准储备液,用甲醇配成10ng/m L的混合标准溶液,使用前用甲醇稀释成所需的标准工作液。
1.2.2样品的提取与净化样品粉粹成5mm×5mm小块,称取试样1.00g(精确至0.01g)至50m L三角瓶中,加入1%甲酸-甲醇溶液25m L,盖上瓶塞,用封口胶密封,振荡后70℃超声提取60m in。将提取液过滤至50m L棕色鸡心瓶中,将鸡心瓶置于40℃水浴减压旋转浓缩近干,加入2m L水,涡旋振荡溶解残渣,待净化。
用2m L甲醇活化C18固相萃取小柱,加2m L水平衡处理,将待净化液体过活化后的C18固相萃取小柱,保持流速小于1m L/m in,弃去流出液,加入2m L甲醇洗脱,收集洗脱液于氮吹管中,40℃水浴氮吹至近干,加入甲醇定容至1m L,超声溶解,过0.22μm有机膜,待测。
1.2.3固相萃取柱的选择本研究考察了HLB和C18两种固相萃取小柱对7种PFCs的回收情况。分别取浓度为1ng/m L的混合标准溶液各1m L加入到25m L空白甲酸-甲醇溶液中,旋蒸近干,加入2m L水,涡旋振荡溶解后分别过经活化的HLB和C18小柱,加甲醇洗脱,将洗脱液40℃氮吹近干,加1m L甲醇定容,上机测定。
1.2.4洗脱体积的确定取1m L 1ng/m L的标准混合液于氮吹管中,40℃氮吹近干,加入2m L水后过C18固相萃取小柱依次加入0.5、1、1.5、2、2.5m L甲醇洗脱,测定PFCs的含量。
1.2.5方法的检出限和线性关系以甲醇稀释PFCs混合标准溶液至0.5、1、2、4、8、10μg/L,按本文仪器条件进行检测,以浓度x(μg/L)对峰面积y作PFCs标准曲线回归方程,按3倍信噪比(S/N)计算方法的检出限(LOD),按10倍信噪比计算方法的定量限(LOQ)。
1.3液质联用仪分析条件
为减少实验过程带来的污染,将原色谱管路更换为Peek材料,全过程避免使用聚四氟乙烯器皿。
1.3.1色谱条件色谱柱:Kromasil C8柱(100mm× 4.6mm,2.6μm);流动相:2mmol/L乙酸铵-水溶液(A)和0.1%甲酸-乙腈(B);洗脱梯度见表1;流速0.3m L/ m in;柱温:30℃;进样量:10μL。

表1 流动相组成和梯度Table 1 The composition and gradientofmobile phase
1.3.2质谱条件离子源:ESI;离子源温度:350℃;电离电压:-4000V;检测模式:多反应监测模式(MRM);辅助气、雾化气、碰撞气:氮气。根据各组分的保留时间和一级、二级质谱参数,按时间分段用多反应离子监测(MRM)模式对各组分进行质谱检测,各化合物的保留时间、母离子、子离子、碰撞能量、电压等参数见表2。
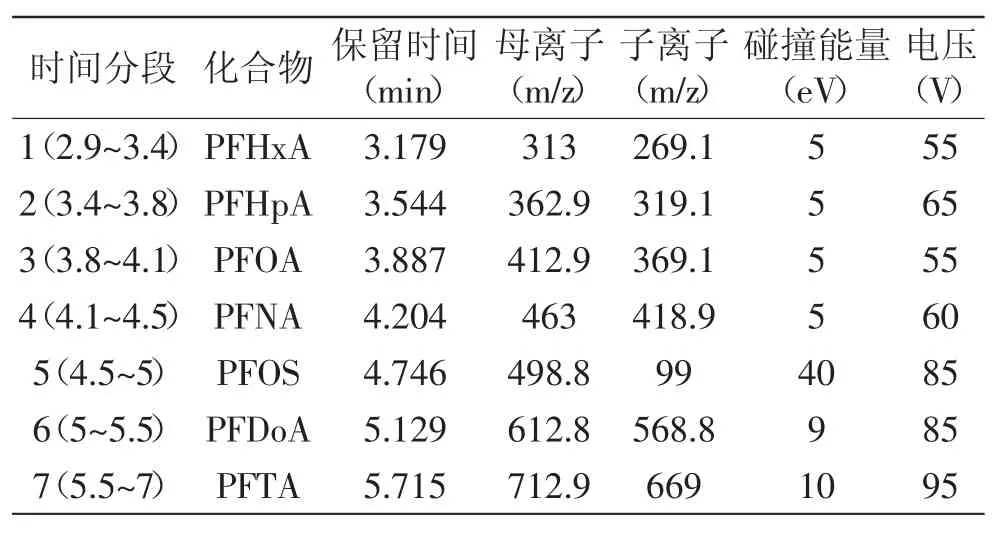
表2 PFCs的质谱分析参数Table 2 The MRM Parameters of 7 PFCs
2 结果与讨论
2.1提取溶剂的选择
考察样品在甲醇、水、1%甲酸-甲醇溶液、1%甲酸-水溶液四种溶剂中的超声提取效果,结果表明1%甲酸-甲醇溶液的提取效果最好。分析其原因,虽然PFCs在水溶液中有较大的溶解度,但纸袋部分会浮在水溶液表面,导致样品无法完全浸湿,从而无法将纸袋中的PFCs全部提取出来;而溶液的pH会影响PFCs类物质的溶解度,所以本文选取1%甲酸-甲醇溶液作为提取溶剂。
2.2提取方法的选择
以1%甲酸-甲醇溶液为提取溶剂,比较了超声提取、索氏提取和振荡提取三种提取方法的提取效果。结果表明:振荡提取周期长且提取含量低,提取1h后含量几乎为零,将提取时间延长至24h,提取含量无明显增加;索氏提取1h后含量同样几乎为零,将时间延长至24h,提取含量与超声提取1h无明显差距,且索氏提取操作繁琐,耗时较长且容易造成试剂的浪费;超声提取周期短且提取含量高。故本文选取破坏力强、耗时短、提取含量高的超声提取方法作为本法的提取方式。
以1%甲酸-甲醇溶液为提取剂,比较了不同的超声时间对样品中7种PFCs的提取效果的影响,7种PFCs的提取含量在0~60min内表现出明显的递增趋势,60m in后样品趋于平衡甚至含量降低(见图1)。文献[22-23]认为长时间的超声会造成PFCs的降解,而时间过短又达不到提取效果,所以本文确定超声时间为60m in。
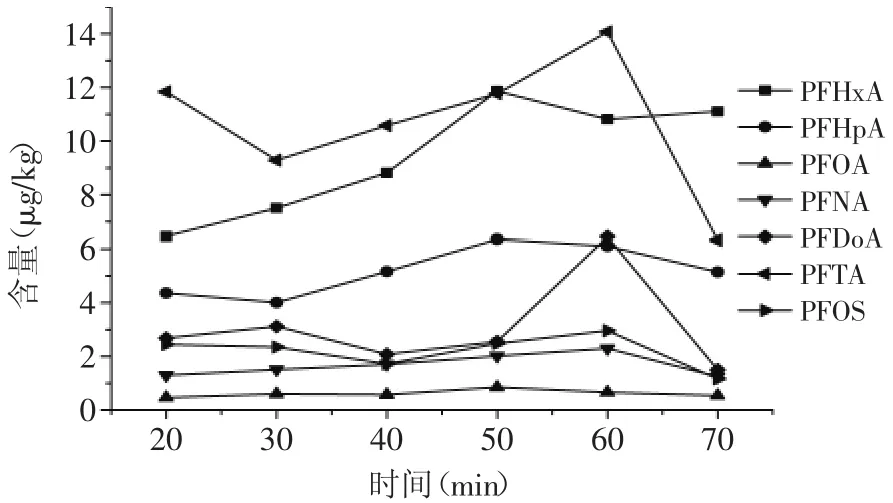
图1 不同超声时间对7种PFCs提取效果的比较Fig.1 Extraction results of 7 PFCswith differentultrasonic time
2.3样品的净化
2.3.1固相萃取柱的选择图2结果表明:C18固相萃取柱的净化效果优于HLB固相萃取,这可能是由于C18固相萃取小柱更适合PFCs的净化与富集[24]。所以本实验选取C18固相萃取小柱。

图2 2种不同的固相萃取柱对7种PFCs提取效果的比较Fig.2 Comparisons of recoveries of 7 PFCs on three different SPE colume
2.3.2洗脱液体积的确定图3结果表明当洗脱液体积大于2m L时7种PFCs含量基本不变,所以本文选取2m L甲醇作为洗脱液。
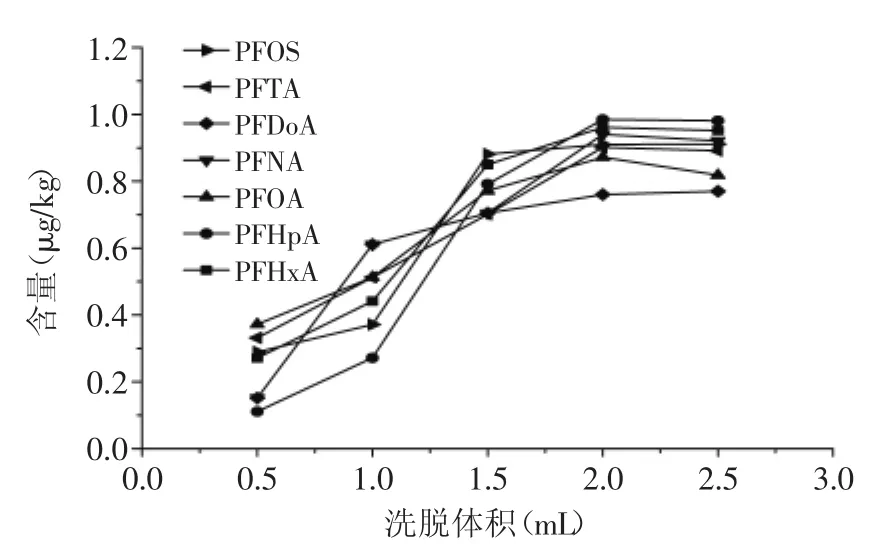
图3 不同洗脱体积时7种PFCs回收效果的比较Fig.3 Comparisons of recoveries of 7 PFCs among different elution volume

表3 7种PFCS的线性范围、线性方程、回归系数、方法定量限Table 3 Lineral equation,coefficients(r),limits of detection(LOD),recoveries and RSD for 7 PFCs
2.4方法检出限与线性关系
线性方程、回归系数、方法的定量限见表3,方法检出限为0.008~0.104μg/kg,7种PFCs标准溶液的总离子色谱图见图4。
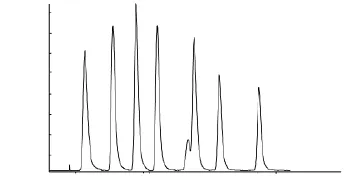
图4 7种PFCs标准溶液的总离子流色谱图Fig.4 Total ion current chromatograms of seven PFCs standard solution
2.5回收率与相对标准偏差
以阴性样品进行3个加标水平的回收实验,每个加标水平取6个平行样,7种PSCs的检测结果见表4。平均回收率为:80.2%~106.0%;相对标准偏差为:2.2%~8.1%。说明方法具有良好的准确性和重现性。
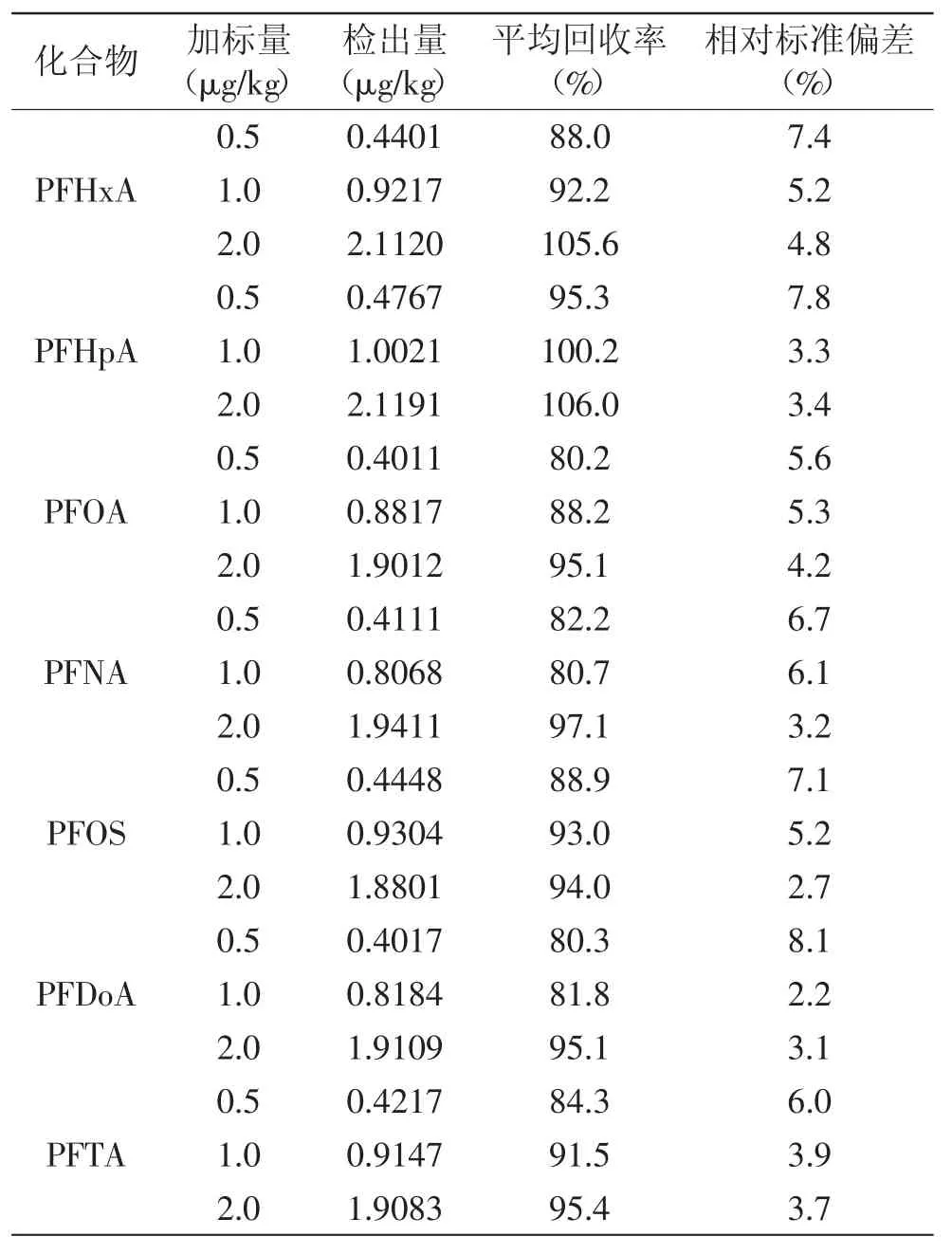
表4 样品中PFCs的回收率与相对标准偏差(n=6)Table 4 Recoveries and RSDs for determination of PFCs(n=6)
2.6实际样品检测
在优化条件下,对从市场上购买的4类快餐纸袋(汉堡纸袋、薯条纸袋、蛋挞纸袋及鸡肉卷纸质外包装)进行检测,结果表明4类快餐纸袋中主要存在2种PFCs污染,为PFHxA和PFHpA,其平均含量分别为0.1639、0.4599μg/cm3,均低于欧盟委员会关于持久性有机污染物(POPs)第757/2010号法规的最低限量标准1μg/cm3。虽PFCs含量及检出率不高,但也证明市售快餐纸袋中存在PFCs的污染问题,应引起监管部门的重视,而且有必要对市售快餐纸袋中PFCs进行长期的检测与监控。
3 结论
本文建立了快餐纸袋中7种PFCs的SPE-LC-MS/ MS分析方法,方法显示了较好的加标回收率和重复性,7m in内即可完成7种PFCs的准确定量分析,其检出限为0.008~0.104μg/kg。该方法适合于各类市售快餐纸袋中PFCs的定量检测,可为人类暴露于PFCs的污染来源提供可靠的数据支撑。
[1]RENNERR.Growing concern over perfluorinated chemicals[J].Environ Sci Technol,2001,35(7):154-160.
[2]范英武,郎朗,季宇彬.全氟辛酸毒性的研究现状[J].食品与药品,2008,10(7):66-69.
[3]曲艳,张超杰,李飞,等.环境中全氟有机物的毒性、检测分析及降解[J].环境污染与防治,2007,29(11):848-853.
[4]Taniyasu S,Kannan K,Horii Y,et al.A survey of perfluorooctane sulfonate and related perfluorinated organic compoundsinwater,fish,birds,and humans from Japan[J].Environ Sci Technol,2003,37(12):2634-2639.
[5]GiesyJP,KannanK.Globaldistributionof perfluorooctanesulfonate inwildlife[J].EnvironSci Technol,2001,35(6):1339-1342.
[6]Bryan Boulanger,John D Vargo,Jerald L Schnoor,et al. Evaluation ofperfluorooctane surfactants in awastewater treatment system and in a commercial surface protection product[J].Environ Sci Technol,2005,39(15):5524-5530.
[7]Harada K,Inoue K,Morikawa A,et al.Renal clearance of perfluorooctane sulfonate and perfluorooctanoate in humans and their species-specific excretion[J].EnvironmentalResearch,2005,99(2):253-261.
[8]Kennedy GL Jr,Butenhoff JL,Olsen GW,etal.The toxicology of perfluorooetanoate[J].Grit Rev Toxicol,2004,34(4):351-384.
[9]Starkov A A,Wallace K B.Structural determinants of fluorochemical inducedmitochondrial dysfunction[J].Toxicol Sci,2002,66(2):244-252.
[10]Lau C,Butenhof JL,Rogers JM.The developmental toxicity of perfluoroalkyl acids and their derivatives[J].Toxicol Appl Pharmaeol,2004,198(2):231-241.
[11]Ruch R J.Intercellular communication,homeostasis and toxicology[J].Toxicol Sci,2002,68(2):265-266.
[12]S0 M K,Taniyasu S,Yamashita N,et al.Perfluorinated Compounds in Coastal Waters of Hang Kong,South China,and korea[J].Environ Sci Technol,2004,38(15):4056-4063.
[13]Wang JM,ShiY L,Pan Y Y,etal.Perfluorooctane sulfonate(PFOS)and other perfluorochem-icals in viscera and muscle of farmed pigs and chickens in Beijing,china[J].Chinese Science Bulletin,2010,55(31):3550-3555.
[14]张晓丽,刘崇华,冼燕萍,等.液相色谱-串联质谱法测定纺织品中7种全氟有机物[J].分析测试学报,2010,12(29):1182-1185.
[15]韩志诚.食品包装纸的推广和应用[C].第八届中国造纸化学品开发应用国际技术交流会论文集,2009.
[16]杨左军,王成云,顾浩飞,等.纸质食品包装材料中五氯酚的测定[J].中国造纸,2010,29(5):43-46.
[17]杨左军,王成云,顾浩飞,等.纸品中多氯联苯的气相色谱法测定[J].中华纸业,2011,32(4):56.
[18]陈旭辉,徐嵘,顾浩飞,等.石墨炉标准加入法测定食品包装纸中镉含量的研究[J].中国造纸,2009,29(9):29-31.
[19]郭仁宏,周颖红.纸巾纸中荧光增白剂迁移性快速检测方法的研究[J].中国造纸,2007,26(10):33-35.
[20]冯盘.食品接触材料中全氟辛酸和全氟辛烷磺酰基化合物的检测和溶出迁移规律研究[D].杭州:浙江大学,2011.
[21]王杰明,史亚利,潘媛媛,等.北京市售肉类食品中全氟化合物的污染水平研究[J].科学通报,2010,55(23),2360.
[22]Chad D Vecitis,Hyunwoong Park,Jie Cheng,et al.Kinetics and mechanismof the sonolytic conversion of the aqueous perfluorinatedsurfactants,perfluorooctanoate(PFOA),and perfluorooctane sulfonate(PFOS)into inorganic products[J].The journal of physical chemistry,2008,112(18):4261-4270.
[23]Moriwaki H,Takagi Y,Tanaka M,et al.Sonochemical decomposition of perfluorooctane sulfonate and perfluorooctanoic acid[J].Environ Sci Technol,2005,39(9):3388-3392.
[24]罗海英,蔡依军,冼燕萍,等.液相色谱-串联质谱法测定鱼肉中的7种全氟有机物[J].食品工业科技,2011,32(2):325-327.
Determ ination of seven perfluorinated com pounds in fast food papers by solid phase extraction coup le w ith solid phase extraction and liquid chromatography-mass spectrometry
XU Rui1,2,TAN Hong2,YANG Hong-bo2,*,SUN Hai-da2,HE Jin-lin2
(1.Guizhou University,Guiyang 550002,China;2.Guizhou Academy of Analysis Test,Guiyang 550002,China)
A method was estab lished for the determ ination of 7 perfluorinated com pounds(PFCS),inc luding perfluorohexanoicacid(PFHxA),perfluorohep tanoic acid(PFHpA),perfluorooctanoic acid(PFOA),perfluorononanoic acid(PFNA),perfluorododecanoicacid(PFDoA),perfluorotetradec-anoicacid(PFTA),perfluorooctane sulphonate(PFOS)in fast food papers by solid phase extraction coup led w ith solid phase extraction and liquid chromatography-mass spec trometry(SPE-LC-MS/MS).Samp les were extracted w ith 1%form ic acidmethanol by ultrasonic wave and c leaned up on C18SPE column.7 PFCs were separated on a C8reversedphase column using g rad ient elution w ith acetonitrile and 2mmol/L ammonium acetate and analyzed by LC-MS/MS ESI(-)under MRM mode w ith the external standard phase.The results showed that four kinds of PFCs were detected.The lim its of detection,average recovery rates,and the RSD(n=6)were 0.008~0.104μg/kg,80.2%~106.0%,2.2%~8.1%,respectively.The method was simp le,accurate and sensitive for the determ ination and confirmation of PFCs in fast food papers and othermaterials used as food packaging.
LC-MS/MS;fast food papers;PFCs;determ ination
TS206.4
A
1002-0306(2015)06-0049-05
10.13386/j.issn1002-0306.2015.06.001
2014-06-18
徐睿(1989-),女,在读硕士研究生,研究方向:食品分析。
杨鸿波(1976-),男,博士,研究员,研究方向:有机化学分析。
国际合作项目(2011DFB41640);国家重大科学仪器设备开发专项项目(2011YQ12003506);黔科合外G字[2012]7033号;中国科学院院地合作项目资助。

