川芎对天麻指标成分在偏头痛大鼠体内药动学的影响
王 强, 沈 岚,*, 梁 爽, 马诗瑜, 冯 怡, 阮克锋
(1.上海中医药大学中药学院,上海 201203;2.上海中医药大学中药现代制剂技术教育部工程中心,上海 201203)
[制 剂]
川芎对天麻指标成分在偏头痛大鼠体内药动学的影响
王 强1,沈 岚1,2*,梁 爽2,马诗瑜1,冯 怡2,阮克锋2
(1.上海中医药大学中药学院,上海201203;2.上海中医药大学中药现代制剂技术教育部工程中心,上海201203)
目的 研究川芎对天麻中天麻素及天麻苷元在偏头痛大鼠体内药动学过程的影响。方法 156只大鼠被随机分为天麻组(灌胃给予天麻提取物0.484 g/kg)和川芎-天麻组(灌胃给予川芎提取物0.652 g/kg及天麻提取物0.484 g/kg),先对每组大鼠皮下注射硝酸甘油注射液复制偏头痛动物模型,30 min后给予不同药物,并于给药后不同时间点取血及脑组织,采用HPLC测定天麻素及天麻苷元在血内及脑内的浓度,以DAS 2.0计算其药动学参数。结果 川芎-天麻组中天麻素和天麻苷元在血中的平均滞留时间是天麻组的1.37和1.36倍,半衰期是天麻组的1.62和1.76倍,其中天麻素的清除率为天麻组的88.14%,两组相比均有统计学差异(P<0.05或0.01);川芎-天麻组中天麻苷元在脑内的药物浓度曲线下面积是天麻组的1.26倍,平均滞留时间是天麻组的1.44倍,清除率为天麻组的77.76%,与天麻组相比有统计学差异(均P<0.01)。结论 川芎与天麻配伍后可显著延长天麻素、天麻苷元在血中的滞留时间和半衰期,同时也增加天麻苷元在脑中的生物利用度及滞留时间,减缓消除速率,表明川芎与天麻配伍后可显著影响天麻指标成分的血脑药动学行为,发挥协同效应。
川芎;天麻素;天麻苷元;偏头痛;药动学
川芎-天麻是治疗偏头痛的经典药对,方中川芎(Ligusticum chuanxiong,LC)行气血、熄风止痛,偏行于外以治标;天麻(Gastrodia elata,GE)性甘缓,偏行于里以滋阴,二者同用可增强疗效[1]。川芎具引药上行之功效。前期研究表明,方中川芎、天麻的醇提取物为该方主要有效部位,在此基础上,课题组优化了提取纯化工艺,分别得到了川芎效应组分和天麻效应组分,并证实了其4∶3配伍得到的川芎-天麻药对药效最佳[2]。
研究表明,天麻的主要指标成分为酚类化合物及其苷类,包括天麻素(gastrodin)及天麻苷元(p-hydroxybenzy1a1coho1)等,结构见图1。天麻素可以透过血脑屏障[3],但其透过量极少,易代谢转化为天麻苷元,且其透过血脑屏障的速率远低于天麻苷元[4-5]。另有研究表明,天麻素不能直接作用于脑内的苯二氮䓬类受体,而其代谢产物天麻苷元才可与之结合而发挥中枢神经抑制作用[6]。因此,药物发挥中枢治疗的疗效与药物能否透过血脑屏障并与相应的受体结合有关,而药物能否透过血脑屏障与药物的理化性质、血脑屏障的病理生理状态及特定的转运体系统等有关。尽管有些药物可透过血脑屏障,但易转化为其他物质或被血脑屏障的P-糖蛋白等外排泵转运出来,因此会造成脑内有效药物浓度低且存留时间短等情况。目前已对川芎-天麻药对在硝酸甘油致实验性偏头痛模型大鼠血内、脑内移行成分归属进行研究,其中已确认的天麻主要入血成分为天麻素、天麻苷元,入脑成分为天麻苷元[7]。在此基础上,运用药动学方法,比较天麻组以及川芎-天麻组中的天麻主要指标成分分别经灌胃给药后不同时间的偏头痛大鼠血浆、脑组织中含量的变化,并对药动学参数进行统计分析,以阐明川芎对天麻的作用特点。
1 材料

图1 天麻素及天麻苷元的化学结构Fig.1 Chem icaI structures of gastrodin and p-hydroxybenzyIaIcohoI
1.1仪器 Agi1ent 1200高效液相色谱仪(VWD检测器,美国安捷伦公司);ZORBAX SB-C18柱(5μm,4.6 mm×250 mm,Agi1ent公司);保护柱(phenomenex C18,4 mm×3.0 mm);Mi11ipore-Q P1us超纯水器(美国Mi11ipore公司)。
1.2药物和试剂 川芎效应组分(自制,其中阿魏酸质量分数为6.20%,洋川芎内酯I质量分数为10.74%);天麻效应组分(自制,其中天麻素质量分数为14.85%);天麻素(中国食品药品检定研究院,纯度≥98%,批号110807-200205);天麻苷元(又称对羟基苯甲醇)对照品(国药集团化学试剂有限公司,纯度≥97%,批号20120315);肝素钠注射液(上海第一生化药业有限公司,批号111006);10%水合氯醛溶液(国药集团化学试剂有限公司,批号T20060331,临用前配制);硝酸甘油注射液(北京益民药业有限公司,批号20110608);乙腈(色谱纯,Sigma公司),水为超纯水。
1.3实验动物 健康SD大鼠,雄性,体质量(200±20)g,由上海中医药大学实验动物中心提供,合格证号SCXK(沪)2008-0016。
2 方法
2.1对照品溶液的制备 取天麻素对照品约15.0 mg,精密称定质量,置于50 mL量瓶中,加纯水稀释至刻度,配成质量浓度为300.0μg/mL的天麻素对照品溶液。
取天麻苷元对照品约9.0 mg,精密称定质量,置于100 mL量瓶中,加纯水稀释至刻度,配成质量浓度为90.0μg/mL的天麻苷元对照品溶液。
2.2供试品溶液的配制 称取天麻效应组分2.42 g,置于50 mL量瓶中,加生理盐水稀释至刻度,振摇溶解,配制后质量浓度为48.40 mg/mL(其中天麻素质量浓度为7.19 mg/mL),作为供天麻组大鼠灌胃用的药物试液GE。
另称取川芎效应组分3.27 g,天麻效应组分2.42 g,置于50 mL量瓶中,加生理盐水稀释至刻度,振摇使其均匀分散,配制后川芎质量浓度为65.20mg/mL(其中阿魏酸质量浓度为4.04mg/mL,洋川芎内酯I质量浓度为7.00 mg/mL),天麻质量浓度为48.40 mg/mL(其中天麻素为7.19 mg/mL),作为供川芎-天麻组大鼠灌胃用的药物试液LC-GE。
2.3 色谱条件 ZORBAX SB-C18(4.6 mm×250 mm,5μm);保护柱(phenomenex C18,4 mm×3.0 mm);体积流量0.8 mL/min;进样量20μL;检测波长221 nm;血浆中天麻素、天麻苷元检测采用乙腈-0.01%磷酸水(2∶98),柱温35℃;脑组织中天麻苷元检测采用乙腈-水(3∶97),柱温30℃。
2.4血浆、脑组织样品的采集和处理
2.4.1实验方法 SD大鼠156只,雄性,天麻组、川芎-天麻组各78只;实验前先适应性喂养3~4 d,禁食不禁水12 h,参考Tassore11i C等[8]报道的方法,复制硝酸甘油型SD大鼠偏头痛动物模型,先给各组大鼠皮下注射硝酸甘油注射液(10 mg/kg),30 min后分别给予药物试液天麻、川芎-天麻(10 mL/kg),分别设定2、5、10、15、30、45、60、75、90、120、150、180和360 min 13个时间点,均n=6,给药后于每个时间点断头取血约2 mL,移入加有肝素钠的试管中,轻轻混匀,全血于4 000 r/min离心10 min后取上清得血浆;取血后随即取脑组织,去除血丝后置10mL离心管中,血浆、脑组织于-80℃保存。
2.4.2样品预处理 取血浆100μL,加入甲醇-乙腈(1∶4)500μL,涡旋30 s,4 000 r/min离心10 min,上清液于常温下氮气吹干,残渣加100μL流动相复溶,4 000 r/min离心10 min,吸取上清液20μL进样HPLC测定。
脑组织加入1倍量的冷生理盐水,匀浆,取匀浆液1 mL,加入4倍量的乙腈,涡旋30 s,10 000 r/min离心10 min,上清液于常温下氮气吹干,残渣加150μL流动相复溶,10 000 r/min离心10 min,吸取上清液20μL进样HPLC测定。
2.5方法学验证
2.5.1专属性 将空白血浆,含有混合对照品(其中天麻素0.50μg/mL、天麻苷元0.20μg/mL)的空白血浆和灌胃川芎-天麻120 min的血浆样品,按生物样品预处理方法处理后,进样测定,得HPLC图(图2)。
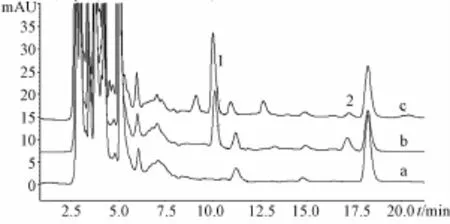
图2 大鼠血浆中天麻素及天麻苷元的专属性图谱Fig.2 Representative chromatograms for the determ ination of gastrodin and p-hydroxybenzy I aIcohoI in rat p Iasma
另将空白脑匀浆,含有对照品(其中天麻苷元0.20μg/mL)的空白脑匀浆和灌胃川芎-天麻120 min的脑匀浆样品,按生物样品预处理方法处理后,进样测定,得HPLC图(图3)。由图2、图3可知,血浆和脑匀浆中的内源性物质对相应检测物质的测定均无干扰,相应物质色谱峰与相邻色谱峰间的分离度均较好,达到HPLC分析要求。
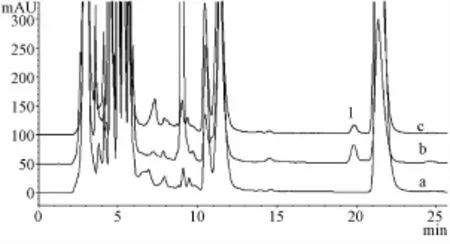
图3 大鼠脑组织中天麻苷元的专属性图谱Fig.3 Representative chromatograms for the determ ination of p-hydroxybenzyIaIcohoIin rat brain tissue
2.5.2 线性关系考察、检测限及定量限 精密量取天麻素、天麻苷元对照品贮备液适量,分别用流动相稀释制备系列标准溶液,加入空白血浆,制成血浆中分别含天麻素0.15~12.00μg/mL、天麻苷元0.08~6.00μg/mL 8个质量浓度的混合对照样品。按生物样品预处理方法处理后进样分析,记录峰面积。以测得样品的峰面积(A)对质量浓度(C)作图,得回归方程,见表1。
另将制备的系列标准溶液加入到空白脑匀浆中,制成脑匀浆中含天麻苷元0.08~6.00μg/mL的对照样品。按生物样品预处理方法处理后进样分析,记录峰面积。以测得样品的峰面积(A)对质量浓度(C)作图,得回归方程(表1)。检测限以信噪比为3求得,定量限以信噪比为10求得。

表1 天麻素及天麻苷元的线性关系、检测限及定量限(n=3)Tab.1 Regression equations,LOD and LOQ va Iues of gastrodin and p-hydroxybenzy IaIcohoI(n=3)
2.5.3精密度和准确度 取空白血浆,精密加入对照品溶液适量,配制成血浆中含天麻素质量浓度从低到高分别为0.20、1.00、10.00μg/mL、天麻苷元分别为0.08、1.00、5.00μg/mL的混合对照样品,按生物样品预处理方法处理后,同一日平行测定6次,连续测定3 d,计算日内、日间精密度。准确度为同一质量浓度下6次测定结果的平均值与标称浓度的比值。
另取空白脑匀浆,精密加入天麻苷元对照品溶液适量,配成后脑匀浆中含0.08、1.00、5.00 μg/mL的天麻苷元对照品,按生物样品预处理方法处理后,同一日平行测定6次,连续测定3 d,计算日内、日间精密度。准确度为同一质量浓度下6次测定结果的平均值与标称浓度的比值。
2.5.4回收率 取空白血浆,精密加入各对照品溶液适量,配制成血浆中含天麻素质量浓度从低到高分别为0.20、1.00、10.00μg/mL,天麻苷元分别为0.08、1.00、5.00μg/mL的混合对照样品,按生物样品预处理方法平行制备6份,另平行配制成如上相应质量浓度的混合对照样品标准溶液3份,直接进样测定,测定峰面积,将前后测得的峰面积进行比较,计算样品的绝对回收率。另取相同体积空白血浆3份,按生物样品预处理方法处理后,加入各对照品溶液后配制成血浆中含如上相应质量浓度的混合对照样品,进样测定峰面积,与之前平行制备的6份样品中测得的峰面积进行比较,计算样品的相对回收率。
取空白脑匀浆,精密加入各对照品溶液适量,配成后脑匀浆中含质量浓度从低到高天麻苷元分别为0.08、1.00、5.00μg/mL的混合对照样品,按生物样品预处理方法平行制备6份,另平行配制成如上相应质量浓度的混合对照样品标准溶液3份,直接进样测定,测定峰面积,将前后测得的峰面积进行比较,计算样品的绝对回收率。另取相同体积空白脑匀浆3份,按生物样品预处理方法处理后,加入各对照品溶液后配制成血浆中含如上相应质量浓度的混合对照样品,进样测定峰面积,与之前平行制备的6份样品中测得的峰面积行比较,计算样品的相对回收率。
2.5.5稳定性 取空白血浆,精密加入对照样品溶液适量,配制成血浆中含天麻素质量浓度从低到高分别为0.20、1.00、10.00μg/mL、天麻苷元分别为0.08、1.00、5.00μg/mL的混合对照样品,分别在室温下放置12、24 h内测定稳定性,并考察样品在48 h内反复冻融3次的稳定性。按生物样品预处理方法处理后,将测得的结果与0 h测得结果进行比较,计算RSD。
另取空白脑匀浆,精密加入天麻苷元对照品溶液适量,配成后脑匀浆中含0.08、1.00、5.00 μg/mL的天麻苷元对照品,分别在室温下放置12、24 h内测定稳定性,并考察样品在48 h内反复冻融3次。按生物样品预处理方法处理后,将测得的结果与0 h测得结果进行比较,计算RSD。
3 结果
3.1方法学结果
3.1.1精密度和准确度 通过配制高、中、低3个已知质量浓度的血浆及脑组织混合对照样品,以评价精密度和准确度,结果见表2。

表2 方法的精密度和准确度分析结果Tab.2 Precisionandaccuracyofthemethod
由上表可知,血浆及脑组织内各浓度天麻素和天麻苷元的准确率范围为87.59%~111.12%,精密度均为RSD<15%,均符合要求。
3.1.2回收率 各物质回收率结果见表3。
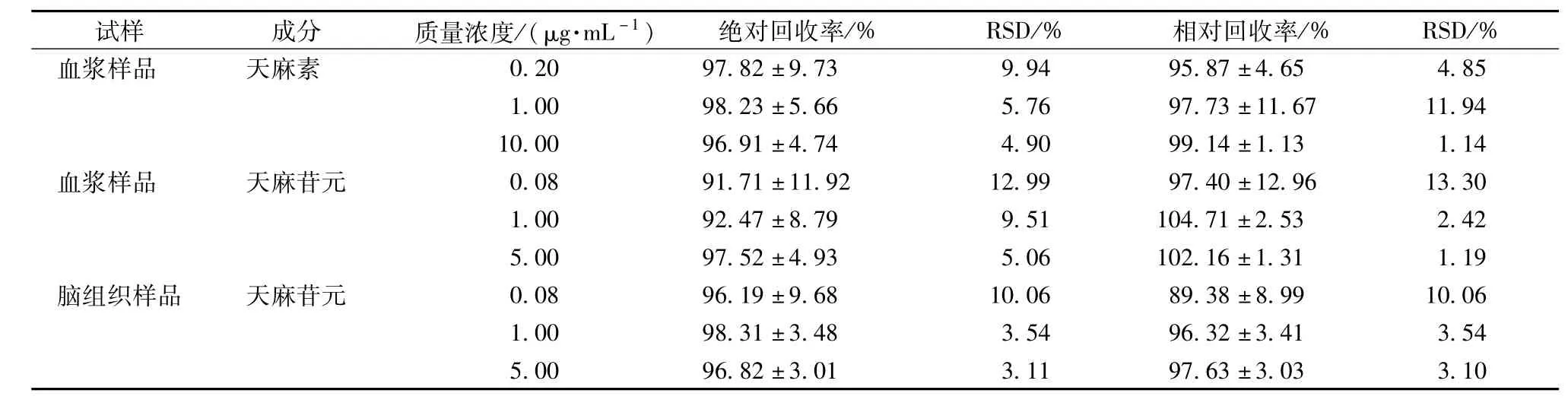
表3 天麻素、天麻苷元在大鼠血浆及脑组织中的回收率分析结果(n=6)Tab.3 Recoveryofgastrodinandp-hydroxybenzyIaIcohoIinratpIasmaandbraintissue(n=6)
上表可知,血浆及脑组织内各质量浓度天麻素和天麻苷元的绝对回收率和相对回收率在89.38%~104.71%范围内,RSD<15%,表明各物质回收率符合要求。
3.1.3稳定性 各物质稳定性结果见表4。

表4 天麻素、天麻苷元在大鼠血浆及脑组织中的稳定性分析结果(n=6)Tab.4 StabiIityofgastrodinandp-hydroxybenzyIaIcohoIinratpIasmaandbraintissue(n=6)
由上表可知,血浆及脑组织内各质量浓度的天麻素和天麻苷元在室温放置12、24h以及48h内反复冻融2次后,样品稳定性RSD均小于15%,表明各物质在室温放置24h或经过2次冻融实验是稳定的。
3.2药动学结果
3.2.1血浆药动学结果 测定天麻组和川芎-天麻组中各大鼠血浆中天麻素质量浓度后绘制的平均药物质量浓度-时间曲线,见图4。主要药动学参数见表5。

图4 天麻组与川芎-天麻组经灌胃给药后天麻素的C-t曲线(n=6,±s)Fig.4 PIasma concentration-time profiIes of gastrodin in rat p Iasma(n=6,±s)
表5 大鼠血浆内天麻素的主要药动学参数(n=6,±s)Tab.5 Pharmacokinetic parameters of gastrodin from GE and LC-GE group in rat p Iasma after oraIadm inistration,respectiveIy(n=6,±s)

表5 大鼠血浆内天麻素的主要药动学参数(n=6,±s)Tab.5 Pharmacokinetic parameters of gastrodin from GE and LC-GE group in rat p Iasma after oraIadm inistration,respectiveIy(n=6,±s)
注:经两独立样本的t检验,与天麻组比较,*P<0.05,**P<0.01
药动学参数单位天麻组川芎-天麻组AUC(0-t)mg·L-1·min 2 025.76±136.70 1 915.07±133.42 AUC(0-∞)mg·L-1·min 2 073.89±126.11 2 265.02±223.12 MRT(0-t)min 55.03±1.37 75.52±4.48**MRT(0-∞)min 59.05±2.29 105.51±20.20**t1/2min 28.65±6.51 46.32±12.81*VdL·kg-11.44±0.36 2.64±0.87*CL L·kg-1·min-10.035 4±0.000 5 0.031 2±0.003 1*Tmaxmin 32.50±6.12 33.00±6.71 Cmaxmg·L-130.79±2.21 22.18±2.96*
由表5可知,川芎-天麻组中天麻素的MRT(0-t)、MRT(0-∞)、t1/2、Vd均明显高于天麻组(P<0.01或0.05);CL、Cmax明显低于天麻组(P<0.05)。
测定天麻组和川芎-天麻组中各大鼠血浆中天麻苷元质量浓度后绘制的平均药物质量浓度-时间曲线,见图5。主要药动学参数见表6。
由表6可知,川芎-天麻组中天麻苷元的MRT(0-t)、MRT(0-∞)、t1/2、Tmax、Vd均明显高于天麻组(P<0.01或0.05);同时Cmax明显低于天麻组(P<0.01)。
3.2.2脑组织药动学结果 测定天麻组和川芎-天麻组中各大鼠脑组织中天麻苷元质量浓度后绘制的平均药物质量浓度-时间曲线,见图6。主要药动学参数见表7。

图5 天麻组与川芎-天麻组经灌胃给药后天麻苷元的C-t曲线(n=6,±s)Fig.5 PIasma concentration-time profiIes of p-hydroxybenzyIaIcohoIin rat p Iasma(n=6,±s)
表6 大鼠血浆内天麻苷元的主要药动学参数(n=6,±s)Tab.6 Pharmacokinetic parameters of p-hydroxybenzyIaIcohoI from GE and LC-GE group in rat p Iasma after oraIadm inistration,respectiveIy(n=6,±s)
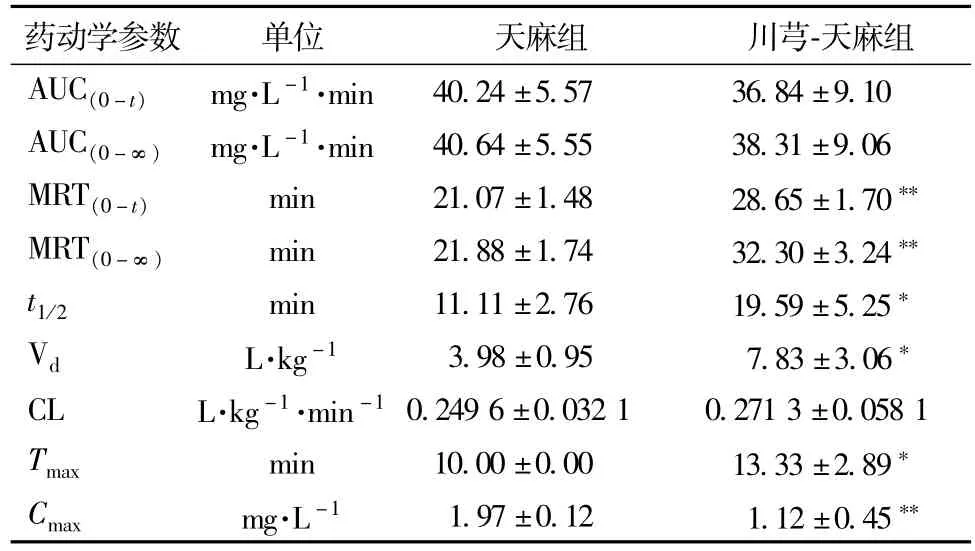
表6 大鼠血浆内天麻苷元的主要药动学参数(n=6,±s)Tab.6 Pharmacokinetic parameters of p-hydroxybenzyIaIcohoI from GE and LC-GE group in rat p Iasma after oraIadm inistration,respectiveIy(n=6,±s)
注:经两独立样本的t检验,与天麻组比较,*P<0.05,**P<0.01
药动学参数单位天麻组川芎-天麻组AUC(0-t)mg·L-1·min 40.24±5.57 36.84±9.10 AUC(0-∞)mg·L-1·min 40.64±5.55 38.31±9.06 MRT(0-t)min 21.07±1.48 28.65±1.70**MRT(0-∞)min 21.88±1.74 32.30±3.24**t1/2min 11.11±2.76 19.59±5.25*VdL·kg-13.98±0.95 7.83±3.06*CL L·kg-1·min-10.249 6±0.032 1 0.271 3±0.058 1 Tmaxmin 10.00±0.00 13.33±2.89*Cmaxmg·L-11.97±0.12 1.12±0.45**

图6 大鼠脑组织内天麻苷元的药物质量浓度-时间曲线(n=6,±s)Fig.6 Concentration-time profiIes of p-hydroxybenzyIaIcohoI in rat brain tissue(n=6,±s)
表7 天麻组和川芎-天麻组中脑组织内天麻苷元的药动学参数(n=6,±s)Tab.7 Pharmacokinetic parameters of p-hydroxybenzyIaIcohoI from GE and LC-GE group in rat brain after oraI administration,respectiveIy(n=6,±s)

表7 天麻组和川芎-天麻组中脑组织内天麻苷元的药动学参数(n=6,±s)Tab.7 Pharmacokinetic parameters of p-hydroxybenzyIaIcohoI from GE and LC-GE group in rat brain after oraI administration,respectiveIy(n=6,±s)
注:经两独立样本的t检验,与川芎组比较,*P<0.05,**P<0.01
药动学参数单位天麻组川芎-天麻组AUC(0-t)μg·L-1·min 77 753.56±7 836.19 98 136.84±5 407.80**AUC(0-∞)μg·L-1·min 79 226.85±7 336.31 98 909.16±6 007.42**MRT(0-t)min 57.01±5.23 99.08±8.33**MRT(0-∞)min 65.82±10.63 103.14±11.06**t1/2min 71.49±19.06 80.27±26.19 VdL·kg-124.73±7.95 28.52±9.33 CL L·kg-1·min-10.381 3±0.033 6 0.296 5±0.026 6**Tmax1min 13.57±2.44 15.00±0.00 Tmax2min 72.08±6.71 90.00±0.00 Cmax1μg·L-11 749.40±205.80 1 499.86±210.89*Cmax2μg·L-1558.32±161.53 659.49±183.45
由表7可知,川芎-天麻组中天麻苷元的AUC(0-t)、AUC(0-∞)、MRT(0-t)、MRT(0-∞)明显高于天麻组(P<0.01),CL、Cmax1明显低于天麻组(P<0.01或0.05)。
4 讨论
引药上行,即是一种或几种药物作为药引而引导其他的一种或几种药物进入头部,其具有两层含义,第一,作为药引的药物,它们本身要直达头面;第二,它们具有直接或间接的促进其他药物到达头面[9]。本实验中同时测定了天麻及天麻与川芎配伍后其主要有效成分在血内及脑内的药动学变化规律,旨在说明川芎对天麻的影响规律。
在血浆药动学方面,川芎-天麻组中天麻素的MRT(0-t)是天麻组的1.37倍,t1/2是天麻组的1.62倍,CL为天麻组的88.14%,有研究表明,天麻素口服后吸收迅速,血浆蛋白结合率为4%,肾脏分布及代谢较高,主要从尿中排泄[10],而与川芎配伍后,天麻素可能与其主要成分如阿魏酸、洋川芎内酯I等竞争性或非竞争性结合代谢酶而使天麻素的代谢减慢[11],或使其血浆蛋白结合率升高或结合时间延长,或使其肾排泄率降低,从而使天麻素在血中的滞留时间和半衰期显著延长,消除速率显著减慢,但川芎与天麻的这种相互作用的具体机制目前还不是很清楚。同时,川芎-天麻中天麻苷元的MRT(0-t)是天麻组的1.36倍,t1/2是天麻组的1.76倍,其可能原因为天麻素在体内可经代谢转化为天麻苷元[12-13],天麻素在血中的滞留时间延长及消除速率减慢,使川芎与天麻配伍后天麻苷元在血中的药动学行为也发生相应改变。本研究证实,川芎与天麻配伍后对天麻素及天麻苷元在偏头痛大鼠血浆内的药动学行为影响较大,可使其在血中的滞留时间和半衰期显著延长,消除速率显著减慢,但其作用是通过抑制天麻指标成分的代谢速率,或减慢其肾排泄率,还需要进一步研究证实。
在脑药动学方面,鉴于天麻素透过血脑屏障的量极少,加上内源性物质对其干扰较大,因此对其不再研究。川芎与天麻经口服后需透过肠道细胞进入血内,进而透过血脑屏障进入靶器官脑内,才能发挥治疗偏头痛的疗效。本实验中川芎-天麻组中天麻苷元在脑内的AUC(0-t)是天麻组的1.26倍,MRT(0-t)是天麻组的1.74倍,CL为天麻组的77.76%,表明川芎与天麻配伍后显著提高了天麻苷元在偏头痛大鼠脑内的生物利用度及分布,同时延长了其在脑内的平均滞留时间,且减缓了其在脑内的消除速率。有研究表明,药物透过血脑屏障的能力,或在脑中滞留时间的长短,是影响其发挥中枢治疗功效的重要因素,天麻素和天麻苷元的跨膜转运主要以被动转运为主,并且均不是P-糖蛋白(P-g1ycoprotein,P-gp)的底物和抑制剂[14-15],由此推断天麻指标成分进入脑部可能受血脑屏障通透性的影响。已有研究表明偏头痛发作时5-羟色胺、组胺、兴奋性氨基酸以及基质金属蛋白酶-9等相关神经递质含有量可发生改变,并造成脑损伤和血脑屏障通透性增加[16-20]。同时也有研究发现川芎、天麻的指标成分可通过调节相关神经递质的含有量而减少脑损伤和降低血脑屏障通透性的作用[21-24],由此而增加了天麻苷元在脑内的生物利用度和滞留时间,并延缓了其在脑内的消除速率。同时,研究中发现天麻苷元出现浓度-时间双峰现象,可能与天麻提取物中天麻素可代谢转化为天麻苷元而导致其在大鼠某些器官的再分布有关,大鼠脑中天麻苷元一部分由天麻素在肝脏或血代谢为天麻苷元后入脑,另一部分源自入脑后极少量的天麻素代谢降解[12-13]。此外,也有报道川芎与天麻配伍后可提高天麻苷元在正常大鼠脑内的分布量,并延缓了其脑消除速率[25],表明川芎与天麻可能还存在其他的相互作用机制,如载体介导、受体介导等,但仍待后续进一步研究验证。本实验在对天麻指标成分血脑相关性分析时发现其显示出相近的变化趋势,表明川芎与天麻配伍后可明显增加天麻指标成分在血中的滞留时间,由此而增加其在脑中的分布量及滞留时间,延缓消除速率。本研究证实,川芎与天麻配伍后对天麻指标成分的血脑药动学规律影响较大,但两者相互作用的具体机制还有待进一步研究。
[1]王洪喜,丁元庆.天麻治疗头痛的药对配伍规律[J].山东中医杂志,2006,25(2):101-103.
[2]洪燕龙,冯 怡,徐德生,等.川芎-天麻治疗偏头痛效应组分的提取、纯化工艺研究[J].中药材,2007,30(6):721-723.
[3]左爱华,程孟春,王 莉,等.川芎吸收入脑成分的UPLCQ-TOF-MS分析[J].中国中药杂志,2012,37(23):3647-3650.
[4]龚其海,石京山,杨丹莉,等.天麻素在中枢神经系统的药理作用及其机制[J].中国新药与临床杂志,2011,30(3):176-179.
[5]游金辉,谭天秩,匡安仁,等.3H-天麻甙元和3H-天麻素在小鼠体内的分布和代谢[J].华西医科大学学报,1994,25(3):325-328.
[6]Lin LC,Chen Y F,LeeW C,et al.Pharmacokineticsof gastrodin and its metabo1ite p-hydroxybenzy1 a1coho1 in rat b1ood,brain and bi1e by microdia1ysis coup1ed to LC-MS/MS[J].J Pharm Biomed Anal,2008,48(3):909-917.
[7]王 强,沈 岚,房 鑫,等.大川芎方沿体外-血浆-脑脊液-脑组织的移行成分研究[J].中成药,2013,35(11):2364-2371.
[8]Tassore11i C,Greco R,Wang D,et al.Nitrog1ycerin induces hypera1gesia in rats-a time-course study[J].Eur J Pharmacol,2003,464(2-3):159-162.
[9]蒋军林,李 倩,周 慎.风药之功用浅谈[J].中医药导报,2007,13(3):79-80,90.
[10]陆光伟,邹元杰,莫启忠.3H-天麻素在大鼠体内的吸收、分布、代谢和排泄[J].药学学报,1985,20(3):167-172.
[11]吴东方,彭 仁.阿魏酸钠抗溴苯实验性肝损害作用机制的探讨[J].中国药学杂志,1995,30(10):597-599.
[12]王 俏,陈国神,曾 苏.天麻素在大鼠脑、肝、肾及脑不同区域组织匀浆中的代谢研究[J].中国现代医药杂志,2009,26(8):614-619.
[13]Zhang W,Sheng Y X,Zhang JL.Determination and pharmacokinetics of gastrodin and p-hydroxybenzy1a1coho1after ora1administration of Gastrodia elata B1.extract in rats by high-performance 1iquid chromatography-e1ectrospray ionization mass spectrometric method[J].Phytomedicine,2008,15(10):844-850.
[14]王晓丹,曾 苏.天麻素在Caco-2细胞及Bcap37、Bcap37/ MDR1细胞模型中的转运和摄取[J].药学学报,2010,45(12):1497-1502.
[15]黄 娟,罗 辉,龚 耘,等.天麻苷元肠吸收特性的研究[J].中国中药杂志,2012,37(6):858-861.
[16]B1ardi P,Pa1azzuo1i A,de La11a A,etal.Variations of periphera1markers of serotoninergic system in se1ected vascu1ar patients[J].Nutr Metab Cardiovasc Dis,2006,16(3):210-214.
[17]Hamami G,Adachi N,Liu K,et al.A11eviation of ischemic neurona1damage by histamine H2 receptor stimu1ation in the rat striatum[J].Eur JPharmacol,2004,484(2-3):167-173.
[18]Sun C,Meng Q,Zhang L,et al.G1utamate attenuates IGF-1 receptor tyrosine phosphory1ation in mouse brain:Possib1e significance in ischemic brain damage[J].Neurosci Res,2012,4(3-4):290-297.
[19]贺 燕,戴宏伟,姬 林,等.脑出血大鼠血肿周围脑组织含水量与基质金属蛋白酶-9、组织基质金属蛋白酶抑制剂-1及谷氨酸表达水平的关系[J].临床神经病学杂志,2012,25(5):350-353.
[20]Gao H M,Li L,Zhang K L,et al.Impact ofmigraine attacks on the b1ood-brain barrier[J].Chin Med J(Engl),2010,123(18):2559-2561.
[21]Wang Y H,Liang S,Xu D S,et al.Effect and mechanism of senkyuno1ide I as an anti-migraine compound from Ligusticum chuanxiong[J].JPharm Pharmacol,2011,63(2):261-266.
[22]Lin T Y,Lu CW,Huang SK,et al.Feru1ic acid suppresses g1utamate re1ease through inhibition of vo1tage-dependent ca1cium entry in rat cerebrocortica1 nerve termina1s[J].J Med Food,2013,16(2):112-119.
[23]Xu X,Lu Y,Bie X.Protective effects of gastrodin on hypoxiainduced toxicity in primary cu1tures of rat cortica1neurons[J]. Planta Med,2007,73(7):650-654.
[24]Shi Z H,LiNG,ShiQ P,etal.Design,synthesisand bio1ogica1eva1uation of feru1ic acid amidesas se1ectivematrixmeta11oproteinase inhibitors[J].Med Chem,2013,9(7):947-954.
[25]郑 琴,刘嘉宇,傅声玲,等.川芎对天麻苷元大鼠脑内药动学的影响[J].中国新药与临床杂志,2012,31(5):263-266.
Effects of Ligusticum chuanxiong on p Iasma and brain pharmacokinetics of active ingredients from Gastrodia elata in m igraine rats
WANG Qiang1, SHEN Lan1,2*, LIANG Shuang2, MA Shi-yu1, FENG Yi2, RUAN Ke-feng2
(1.Collegeof Chinese Materia Medica,Shanghai University of Traditional ChineseMedicine,Shanghai201203,China;2.Engineering Research Center of Modern Preparation Technology of TraditionalChineseMedicineofMinistry of Education,ShanghaiUniversity of TraditionalChineseMedicine,Shanghai 201203,China)
AIM To investigate the inf1uence of Ligusticum chuanxiong(LC)on p1asma and brain pharmacokinetics of gastrodin and p-hydroxybenzy1a1coho1 from Gastrodia elata(GE)in experimenta1migrainemode1 rats. METHODS One hundred and fifty-six rats were random1y divided into GE group(with 0.484 g/kg GE extract for enema)and LC-GE group(with amixture of0.652 g/kg LC and 0.484 g/kg GE extract for enema).Migraine rats induced by subcutaneous injection of nitrog1ycerin for 30 min were administered the test agents,and their p1asma and brain tissues were co11ected after different time interva1s.The concentrations of gastrodin and p-hydroxybenzy1a1coho1were determined by HPLC.The DAS2.0 pharmacokinetic software(of Chinese Pharmaco1ogy Society)was used to ca1cu1ate the pharmacokinetic parameters.RESULTS The MRT(0-t)of gastrodin and p-hydroxybenzy1a1coho1 in p1asma of LC-GE group were 1.37 and 1.36 times than that of the GE group,respective1y.The t1/2were 1.62 and 1.76 times,and the gastrodin c1earance equa1ed to 88.14%that of GE group,in which a11showed significant difference(P<0.05 or0.01).Meanwhi1e,the AUC(0-t)and MRT(0-t)of p-hydroxybenzy1a1coho1 in the brain tissue of the LC-GE group was 1.26 and 1.44 times than that of the GE group,respective1y,and its c1earance was 77.76%of GE group,disp1aying a significant difference(P<0.01).CONCLUSION The findings demonstrate that LC can not on1y pro1ong the residence time of gastrodin and p-hydroxybenzy1 a1coho1 in p1asma to improve their bioavai1abi1ity,but a1so 1engthen the residence time and s1ow the e1imination speed of phydroxybenzy1a1coho1 in the brain tissue.Thus LC can remarkab1y inf1uence the pharmacokinetic characteristics of active ingredients from GE in experimenta1migraine rats.
Ligusticum chuanxiong;gastrodin;p-hydroxybenzy1a1coho1;migraine;pharmacokinetics
R969.1
A
1001-1528(2015)01-0062-08
10.3969/j.issn.1001-1528.2015.01.013
2014-02-12
上海市教育委员会科研创新项目(重点)(12ZZ124);上海市科委科技创新行动计划(12401900402);国家教育部科学技术研究重点项目(211060);国家教育部高等学校博士学科点专项科研基金(20123107120009);上海市科委上海市自然科学基金项目(11ZR1434500)
王 强(1987—),男,硕士,研究方向:中药复方配伍机制。E-mai1:wqiang201203@163.com
沈 岚(1975—),女,教授,博士,硕士生导师,研究方向:中药制剂关键技术与新剂型。Te1:(021)51322211,E-mai1:a1ansusu@sina.com