益气化瘀化痰养阴方对肝纤维化大鼠PPARγ与DLK1的影响
陈文龙, 曹文富, 李 强, 高世娇, 何 英
(重庆医科大学附属第一医院中西医结合科,重庆 400016)
益气化瘀化痰养阴方对肝纤维化大鼠PPARγ与DLK1的影响
陈文龙,曹文富*,李 强,高世娇,何 英
(重庆医科大学附属第一医院中西医结合科,重庆400016)
目的 观察益气化瘀化痰养阴方(黄芪、白术、川芎、姜黄、半夏、海藻、白芍、鳖甲)对肝纤维化大鼠肝组织超微结构及过氧化物酶体增殖物激活受体(PPARγ)与De1ta样蛋白1(DLK1)表达的影响。方法 110只雄性大鼠,正常组10只,余100只大鼠采用“皮下注射CC14+高脂低蛋白饲料+酒精饮料”诱导肝纤维化大鼠模型,成模后再随机分为肝纤维化模型组、秋水仙碱治疗组、益气化瘀化痰养阴方低、中及高剂量组。正常组和模型组灌服生理盐水。采用光镜观察肝组织结构,电镜观察肝组织及细胞超微结构,RT-PCR法检测大鼠肝组织PPARγmRNA水平,Western b1ot法检测各组大鼠肝组织PPARγ与DLK1蛋白表达水平。结果 益气化瘀化痰养阴方中、高剂量组及秋水仙碱组肝组织内纤维化程度有不同程度减轻,肝组织PPARγmRNA水平和蛋白表达水平明显增加,DLK1大分子蛋白表达水平显著降低。结论 中、高剂量益气化瘀化痰养阴方可抑制大鼠肝组织纤维化,其作用机理可能与增加肝组织内PPARγ的表达,抑制DLK1大分子表达有关。
益气化瘀化痰养阴方;肝纤维化;肝组织结构;过氧化物酶体增殖物激活受体;De1ta样蛋白1;大鼠
肝纤维化(1iver fibrosis)是各种原因引起的慢性肝脏损伤共同的组织病理学变化,是影响慢性肝病预后的重要环节。临床发现,气阴两虚、痰瘀阻络是肝纤维化非常常见的两种病证分型[1-2],临床观察和前期研究也发现,益气化瘀化痰养阴方煎剂可以降低肝组织内纤维化程度[3]。动物及细胞研究发现,过氧化物酶体增殖物激活受体γ(PPARγ)、De1ta样蛋白1(DLK1)与肝纤维化的发生、发展密切相关[4-5]。本研究旨在观察PPARγ与DLK1在肝纤维化大鼠肝组织内的表达特征,并在既往研究的基础上,进一步研究益气化瘀化痰养阴方对肝纤维化大鼠肝组织PPARγ、DLK1表达的影响,探讨益气化瘀化痰养阴方抗纤维化可能的作用机制。
1 材料与方法
1.1主药药物、试剂与仪器 本实验所需中药饮片均购自重庆桐君阁股份有限公司,秋水仙碱由云南植物药业公司生产;PPARγ一抗、二抗均购自于北京中杉公司,Western b1ot相关试剂均购自碧云天生物技术研究所,Trizo1总RNA提取试剂、逆转录试剂盒、扩增试剂均由Takara公司生产,普通PCR仪、凝胶成像仪为BIO-RAD公司,紫外分光光度仪为Beckman公司,H-7500型电镜为日本日立公司生产。
1.2中药制备 精选黄芪、白术、川芎、姜黄、半夏、海藻、白芍、鳖甲(药物比例2∶1∶1∶1∶1∶1∶1∶2),混合水提并浓缩成益气化瘀化痰养阴方煎剂,低剂量、中剂量及高剂量煎剂,每1 mL分别含生药1、2、4 g。
1.3肝纤维化造模方法 参考文献[6],大鼠皮下注射40%(V/V)CC14橄榄油溶液,首剂量为5 mL/kg体质量,以后每隔3日改为3 mL/kg体质量,持续4周。造模开始前2周给予高脂、低蛋白质复合饲料(猪油20%+胆固醇0.5%+玉米粉79.5%),2周后改用普通饲料,6周造模期间用10%白酒作为唯一饮料。
1.4动物分组与给药 雄性SD大鼠110只,体质量(200±20)g,由重庆医科大学实验动物中心提供(许可证号:【SYXK(渝)2007-0001】),饲养于重庆医科大学SPF级动物实验室。动物在适应性喂养1周后,随机选取10只作为正常对照组,给予正常饮食、饮水,余100只大鼠按照参考文献方法[6]制备肝纤维化模型,造模结束后共87只存活,随机取2只大鼠行肝组织HE染色光镜观察其是否成模。结果显示,所取大鼠肝组织切片检查均符合肝纤维化特征。将剩余的85只大鼠随机分为肝纤维化模型组、秋水仙碱治疗组、益气化瘀化痰养阴低剂量组、中剂量组及高剂量组,每组17只。益气化瘀化痰养阴方低、中、高剂量组分别给予相应剂量中药煎剂(剂量分别为10、20、40 g/kg),秋水仙碱组给予秋水仙碱水溶液灌胃(剂量0.1 mg/kg);正常对照组及肝纤维化模型组灌服等量的生理盐水。12周后处死大鼠。
1.5检测指标与方法 最后一次用药后24 h,10%水合氯醛腹腔注射麻醉大鼠,于冰盒上处死大鼠,摘取肝脏,取部分肝组织分别用10%福尔马林固定和4%戊二醛固定,待做HE染色、Masson染色及电镜检查,其余标本置-196℃液氮中冷冻后再转移到-70℃冰箱中保存。
1.5.1光镜观察 肝组织用10%福尔马林固定,常规脱水、石蜡包埋、切片,脱蜡后行HE及Masson染色,在光镜下观察肝组织病理形态学变化。Masson染色照片采用Image-Pro P1us 6.0图像分析软件进行半定量分析,每张切片随机选取3个视野(×400倍),测定蓝色胶原总面积,取平均值,计算其占视野总面积的百分比。
1.5.2电镜观察 活体大鼠麻醉后取下1 mm3肝组织,立即放入4℃4%戊二醛溶液中固定2 h,0.1 mo1/L PBS液清洗,1%四氧化锇溶液固定,常规乙醇和丙酮梯度脱水,环氧树脂浸透、包埋、固化,制备0.5μm厚度的半薄切片,在光镜下定位后再制备60 nm厚度超薄切片,再经醋酸铀-枸椽酸铅双染色,H-7500型透射电镜观察肝组织及细胞超微结构。
1.5.3RT-PCR法检测肝组织PPARγmRNA表达
根据试剂说明书,提取大鼠肝组织总RNA,紫外分光光度仪检测RNA浓度和纯度,分别根据PPARγ与内参GAPDH基因编码序列,设计其特异性扩增引物(表1),由Takara公司合成。采用RT-PCR三步法,以上述总RNA为模板,42℃20 min条件下逆转录为cDNA。PCR反应条件预变性94℃3 min,94℃30 s,53.8℃30 s,72℃45 s,共30个循环,于72℃延伸5 min,4℃保存。反应结束后取PCR产物在2%琼脂糖凝胶中电泳,并将凝胶置于凝胶成像仪上用Quantityone 4.6图像分析软件进行照相分析。各条带的相对光密度值=目的条带光密度值/内参GAPDH条带光密度值。

表1 PPARγ与内参基因引物序列、退火温度及产物大小Tab.1 Primer sequences and reaction conditions
1.5.4Western-b1ot法检测肝组织PPARγ与DLK1蛋白表达 称取一定量的肝脏组织,加入10倍体积的组织裂解液匀浆,超声破碎细胞,冰浴30 min后,4℃12 000 r/min离心30 min,取上清,BCA试剂盒蛋白定量,组织总蛋白加入上样缓冲液煮沸变性。30 g蛋白经15%SDS-PAGE分离后转移到PVDF膜,3%BSA室温封闭2 h,加入一抗4℃过夜,TBST洗膜后加HRP标记的二抗,室温孵育2 h,显影,进行灰度分析。
1.6统计学处理 所有数据采用SPSS 18.0统计软件进行分析,计量资料用±s表示,对符合参数检验要求的数据进行单因素方差分析,两两比较用LSD检验。以P<0.05确定为差异有统计学意义。
2 结果
2.1各组大鼠一般情况 实验过程中,造模成活率87%,治疗过程中仅正常组大鼠无死亡,各组大鼠存活率无明显差异。正常组大鼠体质量平稳增加,行动自如,反应敏捷,毛发密集有光泽,粪便干燥;模型组大鼠瘦弱,腹部略显饱满,活动明显减少,反应迟钝,食欲差,排稀便,毛色暗淡,皮毛稀松、易脱落,部分大鼠毛发打结,耳部与尾部苍白、发凉,其余各治疗组均较模型组有不同程度好转。
2.2不同剂量益气化瘀化痰养阴法中药对肝组织病理形态的影响
2.2.1肉眼观察 正常组大鼠肝脏颜色红润,形态正常,包膜完整,表面光滑平整,质地柔软,与周围组织无粘连,切面光滑。模型组与中药低剂量组颜色紫暗,部分可见灰白色条纹,表面粗糙有颗粒感,切面油腻,有砂粒感,部分与大网膜粘连。秋水仙碱组肝脏颜色较正常组偏暗,部分与大网膜粘连,中药中剂量与高剂量组肝脏外观接近正常肝脏。
2.2.2HE染色光镜观察 正常组大鼠肝小叶结构完整、清晰,肝细胞以中央静脉为中心呈放射状排列,肝细胞呈多边形,无变性、坏死,有1~2个圆形细胞核,核仁明显,核内染色质稀疏,染色较浅,胞浆丰富;模型组可见肝小叶结构紊乱,肝细胞内大量大小不等空泡,胞浆稀疏,细胞核被挤压到细胞边缘,并可见大量炎性细胞浸润,且以汇管区最为明显;秋水仙碱组可见不完全的纤维间隔,肝细胞内空泡较模型组明显减少,可见少量炎性细胞浸润;益气化瘀化痰养阴方中、高剂量组肝组织未见假小叶形成,肝细胞形态基本正常,仅于汇管区有少量炎性细胞浸润;而益气化瘀化痰养阴方低剂量组与模型组形态较接近。HE染色结果见图1。
2.2.3Masson染色光镜观察 由图2可见,正常组仅有少量胶原表达于中央静脉壁及汇管区。模型组可见大量胶原纤维沉积于汇管区,并沿汇管区向外延伸,形成厚薄不一的纤维间隔,分割包绕肝小叶。与模型组相比,中药中、高剂量组及秋水仙碱组的肝小叶结构基本恢复正常,肝索排列较整齐,胶原沉积明显减少,纤维间隔变薄,而中药中剂量组肝组织形态与模型组较接近,但胶原纤维较模型组有所减少。Masson图像分析(表2)也证实,益气化瘀化痰养阴法中药能显著降低大鼠肝组织胶原纤维的水平(P<0.01)。
表2 益气化瘀化痰养阴方对肝纤维化大鼠肝组织胶原纤维表达(±s)Tab.2 Effects of YHHY on expression Iiver coIIagen percentage of rats with Iiver fibrosis(±s)

表2 益气化瘀化痰养阴方对肝纤维化大鼠肝组织胶原纤维表达(±s)Tab.2 Effects of YHHY on expression Iiver coIIagen percentage of rats with Iiver fibrosis(±s)
组别代号标本数量胶原纤维/%正常组Ⅰ10 6.63±1.14df模型组Ⅱ11 31.22±2.92bf秋水仙碱组Ⅲ15 13.12±1.24bd中药低剂量组Ⅳ13 24.33±3.19bdf中药中剂量组Ⅴ15 10.88±0.96bdf中药高剂量组Ⅵ16 7.08±1.54df
2.2.4电镜观察 正常组肝细胞形态正常,细胞间紧密连接,内质网、线粒体及核蛋白体丰富,毛细胆管微绒毛丰富,形态正常;模型组及中药低剂量组可见肝细胞萎缩,细胞表面绒毛减少,以纤维间隔周围最为明显,其内大量脂滴,细胞核基本正常,线粒体、内质网等细胞器肿胀且数量明显减少,线粒体嵴稀少甚至消失,糖原稀疏,并可见较多成纤维细胞及少量淋巴细胞、嗜酸性粒细胞等多种细胞浸润,周围可见大量纤维沉积,胆小管扩张;秋水仙碱组可见部分肝细胞核固缩,部分线粒体稍肿胀;中药中剂量及高剂量组可见少量线粒体轻微肿胀,未见明显炎性细胞浸润及纤维增生,余形态与正常组较接近。结果见图3。

图1 益气化瘀化痰养阴方对肝纤维化大鼠肝组织病理形态的影响(HE染色,10×40倍)Fig.1 Effects of YHHY on Iiver histopathoIogy in ratsw ith Iiver fibrosis(HE staining,×400)
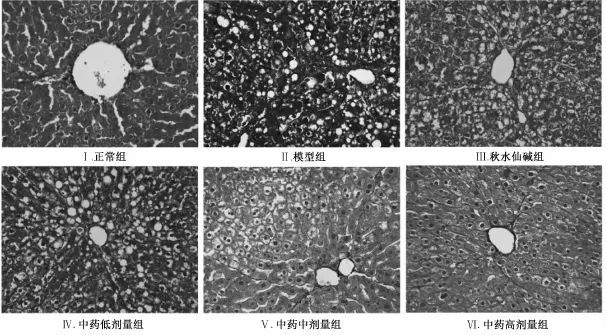
图2 益气化瘀化痰养阴方对肝纤维化大鼠肝组织胶原水平变化的影响(M asson染色,10×40倍)Fig.2 Effects of YHHY on Iiver coIIagen secretion in rats w ith Iiver fibrosis(M asson staining,×400)
2.3益气化瘀化痰养阴方对肝组织PPARγmRNA与蛋白表达的影响 肝组织PPARγmRNA(见图4A)与蛋白表达(见图4B)。由表3可见,益气化瘀化痰养阴方中、高剂量组及秋水仙碱组可明显增加大鼠肝组织细胞中PPARγmRNA与蛋白表达水平,与模型组比较均具有显著差异(P<0.05),益气化瘀化痰养阴方法中、高剂量组与秋水仙碱组比较有非常显著性差异(P<0.01),而益气化瘀化痰养阴方低剂量组PPARγmRNA及蛋白表达水平与模型组相比,差异无统计学意义(P=0.99,P=0.50)。
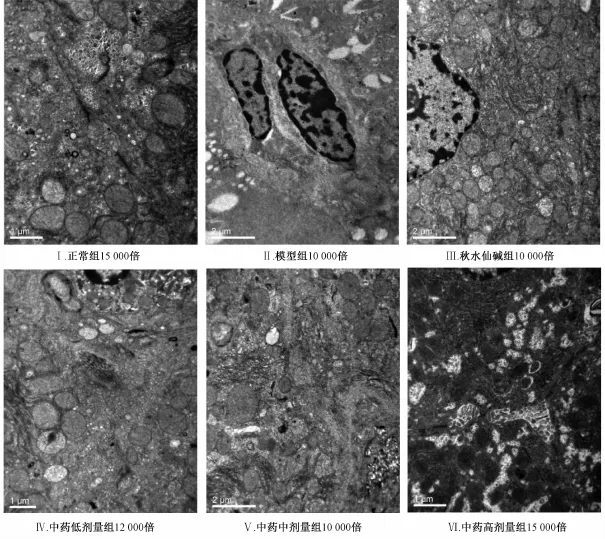
图3 益气化瘀化痰养阴方对肝纤维化大鼠肝组织细胞超微结构的影响Fig.3 Effects of YHHY on u Itrastructure of Iiver tissue and ceIIs in ratsw ith Iiver fibrosis(TEM)
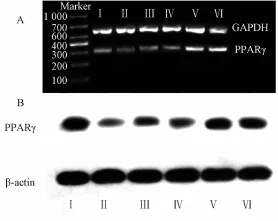
图4 益气化瘀化痰养阴方对大鼠肝组织PPARγm RNA与蛋白表达的影响Fig.4 Effects of YHHY on mRNA and protein expression of PPARγ
2.4益气化瘀化痰养阴方对肝组织DLK1蛋白表达的影响 由图5可见Western b1ot检测到两种DLK1蛋白(DLK1大分子蛋白DLK1-L和DLK1小分子蛋白DLK1-S)。正常组几乎不表达DLK1蛋白。DLK1-S在其余各组表达无明显差异(F= 1.179,P=0.328);而DLK1-L在肝纤维化模型组中明显高于其余各组(与中药低剂量组相比P= 0.031,与其余各组相比P<0.01)。见表3。

图5 益气化瘀化痰养阴方对大鼠肝组织DLK1蛋白表达的影响Fig.5 Effects of YHHY on protein expression of DLK 1
3 讨论
过氧化物酶体增殖物激活受体γ(PPARγ)属于激素核受体超家族,参与脂肪形成,细胞的生长、分化及其他生物过程。研究表明,PPARγ与肝纤维化密切相关。PPARγ参与了肝星状细胞(HSC)活化的TGF-β、肿瘤坏死因子α(TNFα)、血小板源性生长因子(PDGF)、瘦素等多个信号转导通路[7-8],与细胞因子共同调控HSC的增殖及ECM的生成[9]。DLK1是表皮生长因子(EGF)家族的成员之一,又称为脂肪前体细胞因子1(preadipocyte factor 1,Pref-1),是脂肪细胞分化的抑制因子,它能抑制脂质累积以及PPARγ等各种脂肪细胞转录因子的表达[10]。最新试验表明,PPARγ与DLK1都在肝纤维化过程中具有重要意义,且二者有着密切的内在联系,DLK1可通过Wnt信号通路及其下游信号通路,抑制PPARγ表达并使HSC活化[11-12],从而促使肝纤维化形成。
表3 益气化瘀化痰养阴方对肝纤维化大鼠肝组织PPARγ与DLK 1表达的影响(±s)Tab.3 Effects of YHHY on expression of PPARγand DLK1 in rats w ith Iiver fibrosis(±s)

表3 益气化瘀化痰养阴方对肝纤维化大鼠肝组织PPARγ与DLK 1表达的影响(±s)Tab.3 Effects of YHHY on expression of PPARγand DLK1 in rats w ith Iiver fibrosis(±s)
注:与正常组相比较,aP<0.05,bP<0.01;与模型组相比较,cP<0.05,dP<0.01;与秋水仙碱组相比较,eP<0.05,fP<0.01
组别PPARγ PPARγmRNA/GAPDH PPARγ/β -actin正常组0.59±0.10de0.55±0.10bdf0.00±0.00df0.00±0.00 -actin DLK1 DLK1-S/β-actin DLK1-L/β bdf模型组0.42±0.08bf0.28±0.09bf0.17±0.04b0.39±0.07bdf秋水仙碱组0.52±0.06ad0.43±0.09bdf0.19±0.02b0.26±0.07bdf中药低剂量组0.42±0.07bf0.31±0.06f0.19±0.01b0.33±0.11bcf中药中剂量组0.66±0.06adf0.53±0.10df0.18±0.03b0.18±0.04bdf中药高剂量组0.67±0.07adf0.54±0.10df0.18±0.03b0.19±0.07bdf
在本实验中,模型组大鼠PPARγmRNA量和蛋白水平明显降低,而DLK1大分子表达明显增加。其可能的机制是肝脏受到慢性损伤时,肝细胞中DLK1显著表达,导致HSC活化,可能通过经典Wnt信号通路,抑制PPARγmRNA和蛋白表达,从而导致ECM大量堆积,形成肝纤维化。可以认为,PPARγ参与了HSC静止表型的维持,可减轻DLK1的致纤维化作用,可能是治疗肝纤维化的一个靶点。
益气化瘀化痰养阴方治疗肝纤维化,选用黄芪、白术益气健脾、利湿,是临床上最常用的益气药对之一;川芎、姜黄共凑活血祛瘀、行气开郁之效;半夏、海藻燥湿化痰,消痞软坚散结,为化痰要药;白芍养血敛阴,柔肝止痛,配鳖甲滋阴潜阳,软坚散结,又能增强滋养肝阴之效。现代研究表明,上述中药或其有效成分具有抗肝纤维化作用,如黄芪能抑制肝星状细胞(hepatic ste11ate ce11,HSC)活化增殖、促进细胞凋亡、抑制Ⅰ型和Ⅲ型胶原蛋白表达[13]。川芎嗪、姜黄素能抗脂质过氧化,可通过抑制TGF-β1/Smads、瘦素等信号转导通路,抑制HSC的增殖和活化,从而发挥其抗肝纤维化的作用[14-15]。白芍总苷能抑制NF-κB和TGF-β1蛋白表达,抑制HSC分泌透明质酸和Ⅲ型前胶原[16-17]。鳖甲提取物可降低Ⅲ型和Ⅵ型胶原而发挥抗肝纤维化作用[18]。
本实验研究显示,益气化瘀化痰养阴方可改善肝纤维化大鼠肝组织病理损害程度,中、高剂量益气化瘀化痰养阴方可提高大鼠肝组织内PPARγ mRNA和蛋白水平,并抑制DLK1大分子蛋白表达。
[1]王俊文,王天芳,刘建平.肝纤维化中医辨证分型和辨证依据的现代临床文献研究[J].北京中医药大学学报,2008,31(3):210-214.
[2]张广业,徐光福.肝硬化从痰瘀论治[J].中国中医基础医学杂志,2011,17(12):1316-1317.
[3]李 艳,曹文富.益气化瘀化痰养阴方剂对肝纤维化大鼠TGF-β1表达的影响[J].中成药,2012,34(8):1437-1442.
[4]Zhang F,Lu Y,Zheng S.Peroxisome pro1iferator-activated receptor-gamma cross-regu1ation of signa1ing events imp1icated in 1iver fibrogenesis[J].Cell Signal,2012,24(3):596-605.
[5]Pan R,Wang P,Xiang L,et al.De1ta-1ike 1 serves as a new target and contributor to 1iver fibrosis down-regu1ated bymesenchyma1stem ce11transp1antation[J].JBiol Chem,2011,286(14):12340-12348.
[6]马学惠.肝纤维化动物模型的造模方法[J].中华肝脏病杂志,1996,4(1):58-60.
[7]Lin J,Zheng S,Chen A.Curcumin attenuates the effectsof insu1in on stimu1ating hepatic ste11ate ce11 activation by interrupting insu1in signa1ing and attenuating oxidative stress[J].Lab Invest,2009,89(12):1397-1409.
[8]Zhou Y,Jia X,Qin J,et al.Leptin inhibits PPARγgene expression in hepatic ste11ate ce11s in the mouse mode1 of 1iver damage[J].Mol Cell Endocrinol,2010,323(2):193-200.
[9]Wang Z,Xu J,Zheng Y,et al.Peroxisome pro1iferator-activa-ted receptor gamma inhibits hepatic fibrosis in rats[J].Hepatob Pancreat Dis Inte,2011,10(1):64-71.
[10]Su1H S.Minireview:Pref-1:ro1e in adipogenesis and mesenchyma1 ce11 fate[J].Mol Endocrinol,2009,23(11):1717-1725.
[11]Zhu N,Asahina K,Wang J,etal.Hepatic ste11ate ce11-derived de1ta-1ike homo1og 1(DLK1)protein in 1iver regeneration[J]. JBiol Chem,2012,287(13):10355-10367.
[12]Miao C,Yang Y,He X,et al.Wnt signa1ing in 1iver fibrosis:Progress,cha11enges and potentia1 directions[J].Biochimie,2013,95(12):2326-2335.
[13]李 欣,彭小东,张文利,等.四种中药单体的抗肝纤维化作用及其机制[J].中华肝脏病杂志,2008,16(3):193-197.
[14]马 进,郑仕中,陆 茵,等.川芎嗪抑制肝纤维化作用机制的研究进展[J].中国临床药理学杂志,2010,26(5):395-398.
[15]吴惠春,张 斌.姜黄素抗肝纤维化机制研究进展[J].中国中西医结合杂志,2013,33(1):135-137.
[16]路景涛,孙妩弋,刘 浩,等.白芍总苷对免疫性肝纤维化大鼠肝组织NF-κB和TGF-β1蛋白表达的影响[J].中国药理学通报,2008,24(5):588-592.
[17]李瑞麟,马 勇,魏 伟,等.白芍总苷治疗四氯化碳致大鼠肝纤维化的作用与其影响肝星状细胞功能的关系[J].中国新药杂志,2007,16(9):685-689.
[18]唐尹萍,刘焱文,许腊英.中药鳖甲提取物抗肝纤维化的实验研究[J].湖北中医学院学报,2011,13(2):44-46.
Effect of Yiqi Huayu Huatan Yangyin Formu Ia on expression of PPARγand DLK 1 in rats with Iiver fibrosis
CHENWen-1ong, CAOWen-fu*, LIQiang, GAO Shi-jiao, HE Ying
(Department of Integration of Traditional Chinese and Western Medicine,The First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
AIM To eva1uate the anti-fibrotic effect of Yiqi Huayu Huatan Yangyin Formu1a(YHHY)(Astragali Radix,Atractylodismacrocephalae Rhizoma,Chuanxiong Rhizoma,Curcumae longae Rhizoma,Pinelliae Rhizoma,Sargassum,Paeoniae Radix alba,TrionycisCarapax)consisting of four genera1methods of“benefiting qi,removing b1ood stasis,expe11ing ph1egm,and nourish yin”on the expression of peroxisome pro1iferator-activated receptorγ(PPARγ)and de1ta-1ike 1 homo1ogue(DLK1)in ratswith 1iver fibrosis.METHODS One hundred ma1e ratswere injected 40%(V/V)carbon tetrach1oride disso1ved in o1ive hypodermica11y and fed with 1owprotein and high-fat diet to induce 1iver fibrosismode1.The survived rats aftermode1ingwere random1y divided into 1iver fibrosismode1group,co1chicine group,1ow-,moderate-and high-dose YHHY group.The other ten ratswere recruited as norma1contro1group.Rats in norma1 contro1group and themode1group were given sa1ine by gavage. After the corresponding treatment,1iver tissue histo1ogica1examination was carried out to examine the 1iver patho1ogy.PPARγmRNA 1eve1wasmeasured by RT-PCR.The protein expression of PPARγand DLK1 were assessed by Western-b1ot.RESULTS Data from moderate-and high-dose of YHHY group and co1chicine group presented the decrease in 1iver fibrosis to different degrees.PPARγmRNA and protein expression increased whi1e DLk1 proteins decreased in these groups.CONCLUSION Themoderate-and high-dose YHHY Formu1a can intervene the 1iverfibrosis.Theirmechanism may be re1ated to the increase of 1iver expressions of PPARγand the inhibition of DLK1.
YiqiHuayu Huatan Yangyin Formu1a(YHHY);1iver fibrosis;1iver structure;peroxisome pro1iferator-activated receptorγ(PPARγ);de1ta-1ike 1 homo1ogue(DLK1);rat
R285.5
A
1001-1528(2015)01-0028-07
10.3969/j.issn.1001-1528.2015.01.006
2014-01-06
国家自然科学基金预研项目(NSFYY-201108)
陈文龙(1984—),男,硕士生,从事中医药防治器官纤维化研究。Te1:15102314386,E-mai1:niker1ong@163.com
曹文富(1962—),男,医学博士,主任医师,硕士生导师,从事中西医结合内分泌代谢病与肾病基础与临床研究,器官纤维化与衰老的基础与干预研究,中药新药开发研究。Te1:13883658367,E-mai1:caowenfu9316@163.com