波叶青牛胆提取物对糖尿病肾病小鼠药效及急性毒性
马 珍, 黄丹民, 张卫华, 孙 艳, 陈 钧(江苏大学药学院,江苏 镇江 212013)
波叶青牛胆提取物对糖尿病肾病小鼠药效及急性毒性
马 珍,黄丹民,张卫华,孙 艳,陈 钧*
(江苏大学药学院,江苏镇江212013)
目的 研究波叶青牛胆的乙醇提取物和不同极性溶剂萃取部位对Ⅱ型糖尿病肾病小鼠的疗效以及急性毒性。方法 100只采用高脂饮食联合小剂量链脲佐菌素(STZ)复制Ⅱ型糖尿病肾病成功的ICR小鼠分为模型组,乙醇提取物低、中、高剂量组,三氯甲烷部位组,乙酸乙酯部位组,正丁醇部位组,水溶性部位组,以及卡托普利组和消渴丸阳性药组,并设正常对照组。给药6周末测定各组小鼠血清中总胆固醇、尿素氮、肌酐、胱抑素C水平,PAS染色观察肾脏病理变化。结果 乙醇提取物的LD50为4 887 mg/kg。与模型组相比,乙醇提取物高剂量组和正丁醇部位组能显著改善糖尿病肾病小鼠各血清生化指标水平,缓解肾小球肥大,肾小球基底膜增厚及系膜扩张等病理改变。结论波叶青牛胆属于低毒类中草药,在其安全剂量范围内可以降低糖尿病肾病小鼠的血糖、总胆固醇,改善肾功能状态。关键词:波叶青牛胆;半数致死量;糖尿病肾病;小鼠
糖尿病肾病(DN)是糖尿病最常见也是最严重的并发症之一,它的发生是血液动力与代谢因素共同作用的结果[1]。糖尿病微血管病变可导致肾小球血管硬化、肾小球排泄蛋白和滤过异常,并逐渐发展成尿毒症。一般在患糖尿病5年后会出现微量白蛋白尿,肾脏结构的变化主要包括肾小球基底膜增厚,肾小球系膜细胞增多以及系膜膨胀[2-3]。研究报道,临床长期糖尿病肾病患者肾小球滤过率会逐渐下降,但是通过一定的药物治疗可以减缓肾功能的恶化,因此寻找安全有效的治疗糖尿病肾病药物对患者尤为重要[4]。
波叶青牛胆Tinospora crispa L.为防己科,青牛胆属,别名:苦藤、千里找根、绿包藤。主要生长在大部分亚洲和非洲雨林和混合落叶林,主要包括印度、马来西亚、泰国等,我国云南亦有分布[5-6]。波叶青牛胆藤茎富含生物碱类、二萜类、三萜类化合物等[7-9],具有抗菌、降血压、抗疟疾,以及强心等药理作用[10-13]。Ruan等研究发现波叶青牛胆可通过增强胰岛素敏感性降低小鼠血糖,然而目前尚未有波叶青牛胆提取物对糖尿病肾病的具体报道[14-15]。本实验在建立Ⅱ型糖尿病肾病动物模型基础上,通过生化指标、肾脏组织形态病理改变等方面初步探讨波叶青牛胆提取物对糖尿病肾病小鼠肾功能的影响,并测定波叶青牛胆醇提物的LD50,为波叶青牛胆的开发利用以及用药安全提供一定的实验数据。
1 材料
1.1药品与试剂 波叶青牛胆(采集于马来西亚Bionice草本植物园,经药学院陈钧教授鉴定为防己科青牛胆属植物波叶青牛胆的藤茎);卡托普利片(上海普康药业有限公司,批号120901);消渴丸(广州中一药业有限公司,批号R02101);STZ(美国Sigma公司);One Touch U1tra稳豪型血糖试纸(美国强生公司,批号3435584);小鼠胱抑素C酶联免疫试剂盒(上海恒远生物科技有限公司);酶法肌酐测定试剂盒(奥斯邦实验有限公司);UV-GLDH法尿素氮测定试剂盒、COD-CEPAP法总胆固醇测定试剂盒(四川迈克生物科技有限公司)。
1.2主要仪器 TG328A电子分析天平(Sartorius公司);R-205旋转蒸发仪(Buchi公司);SPECTRA MAX 190酶标仪(美国Mo1ecu1er Device公司);COVER-018光学显微镜(日本O1ympus公司);全自动生化分析仪(美国贝克曼库尔特公司);One Touch U1tra稳豪血糖仪(美国强生公司)。
1.3波叶青牛胆提取物的制备 干燥波叶青牛胆藤茎354 g粉碎过20目筛,5倍量95%乙醇和60%乙醇分别加热回流提取3次,每次3 h,合并滤液,减压浓缩成醇提浸膏冷冻干燥成粉末,得醇提物总浸膏粉(TCEE),总浸膏得率24.87%[浸膏粉质量(g)/生药材质量(g)]。取一部分醇提物总浸膏粉依次用石油醚、三氯甲烷、乙酸乙酯、正丁醇萃取,得率分别为:3.94%(石油醚部位),1.94%(三氯甲烷部位),2.00%(乙酸乙酯部位),5.07%(正丁醇部位),11.8%(水溶性部位)。其中,每1 g醇提物总浸膏粉相当于4.02 g生药材。
1.4实验动物 SPF级ICR小鼠,(20±2)g,购于江苏大学实验动物中心,合格证号:SCXK苏(2013-0011)。小鼠饲养条件:室温(22~25)℃,相对湿度65%,12 h明暗交替,自由饮水进食。适应性饲养1周后用于正式实验。
2 方法
2.1急性毒理试验分组 根据改良寇氏法由预试验得出波叶青牛胆醇提物总浸膏粉的100%致死剂量(LD)和0%LD分别为6 000 mg/kg和3 920 mg/kg,相邻组间比为1.112 2,R=(100%LD/ 0%LD)1/n-1,n=5[16]。根据组间比将60只ICR小鼠随机分为6组:6 000 mg/kg(组Ⅰ)、5 393 mg/kg(组Ⅱ)、4 849 mg/kg(组Ⅲ)、4 360 mg/kg(组Ⅳ)、3 920 mg/kg(组Ⅴ)、正常对照组(组Ⅵ)。每组10只,雌雄各半。各给药组采用单次灌胃大剂量醇提物总浸膏粉,正常对照组给予相同体积的蒸馏水,连续观察2周。
2.2糖尿病肾病模型的制备以及分组 雄性ICR小鼠适应性喂养1周,随机抽取10只作为正常对照组,其余作为糖尿病肾病造模组。正常小鼠以标准基础饲料喂养,糖尿病肾病造模组以高脂饲料喂养(猪油10%,蔗糖20%,胆固醇2.5%,胆酸盐1%,基础饲料66.5%)[17]。于6周后造模组一次性腹腔注射STZ 80 mg/kg诱发高血糖,小鼠实验前禁食12 h,STZ临用前以0.1 mmo1/L柠檬酸-柠檬酸钠缓冲液配制成1%的溶液。1周后测定糖尿病肾病小鼠空腹血糖(FBG),挑选FBG≥11.1 mmo1/L的小鼠继续高脂饲料喂养6周,在12周末随机抽取造模组小鼠30只,CO2窒息处死后取出其肾脏,PAS染色,大部分PAS染色结果显示小鼠肾小球肥大且基底膜增厚,系膜区膨胀则视为糖尿病肾病。继而从剩余的造模组中挑选FBG为15~19 mmo1/L的小鼠为糖尿病肾病模型小鼠。根据小鼠体质量以及血糖将100只造模成功的小鼠分为10组:模型组、醇提物总浸膏粉低、中、高剂量组(155,310,620mg/kg)、三氯甲烷部位组(48 mg/kg)、乙酸乙酯部位组(50 mg/kg)、正丁醇部位组(126 mg/kg)、水溶性部位组(295 mg/kg)、卡托普利组(3.13 mg/kg)、消渴丸组(937.5 mg/kg),另设正常对照组。其中,各极性萃取部位给药剂量按照与醇提取物总浸膏粉高剂量所对应的生药材量相等而设定。每组10只,各给药组每日上午给予相应的提取物,正常组和模型组给予相同体积的5%羧甲基纤维素钠溶液,并且根据小鼠体质量每周调节给药剂量。实验期间,模型组与糖尿病组继续高脂饲料喂养。于造模12周后开始给药,连续给药6周。整个实验维持18周。
2.3样本的采集及生化指标测定 急毒试验组小鼠死亡后立即解剖,观察各器官的形态以及病理变化。糖尿病肾病组小鼠尾静脉采血测定不同时间点FBG,于实验18周末禁食12 h,CO2窒息后心脏取血,3 000 r/min离心10 min得血清样本。采用全自动生化分析仪测定血清BUN、Crea、TC等生化指标(由江苏大学附属医院江滨医院测定),ELISA试剂盒测定血清Cys-C。取出各组小鼠的肝脏、肾脏、心脏立即称定质量并计算脏器指数。随后将肾脏固定于10%PBS中性福尔马林溶液中用于PAS染色,光镜下观察组织病理学改变并且运用NIS-E1ements AR 3.0软件系统对图像进行分析。
2.4STZ致小鼠糖尿病肾病模型PAS染色病理分级 0级:光镜观察可见肾小球毛细管及基底膜结构正常,系膜区基质未见沉积以及扩张,毛细管袢间结构清晰,细胞完整,毛细血管结构正常。肾间质未见血管扩张、充血和炎症细胞浸润。
Ⅰ级:肾小球基底膜轻度增厚,肾小球内少量淤血,系膜区少量基质沉积,出现毛细管袢折叠和融合,毛细管袢细胞出现少量变性。
Ⅱ级:肾小球基底膜明显增厚,系膜区有中量基质沉积,出现局灶节段性肾小球硬化毛细管袢见部分折叠和融合,大量出血,渗血,毛细管袢细胞出现部分坏死。
Ⅲ级:肾小球基底膜显著增厚,肾小球内部分淤血,肾小球硬化,肾髓袢细胞减少,坏死,毛细血管阻塞。肾间质局部纤维化伴炎性细胞浸润。
3 结果
3.1波叶青牛胆醇提物的毒性评价 与正常组相比,各给药组小鼠出现倦怠,食欲不振,呼吸急促等现象。在给药24 h内各给药组小鼠开始出现不同比例的死亡,各组小鼠死亡率见表1。解剖死亡小鼠发现肝脏呈现深红色,且胃部膨大。根据SPSS 16.0概率统计分析,得出醇提物的LD50为4 887 mg/kg,95%可信限为(4 587~5 232)mg/kg[18]。
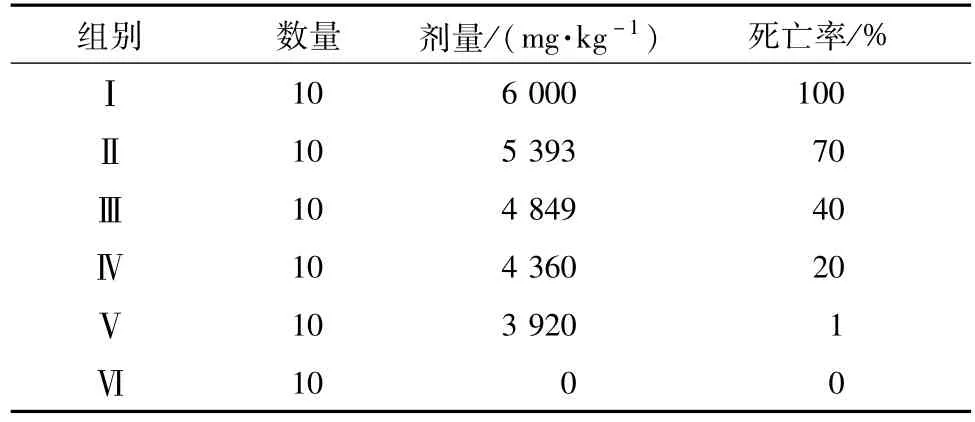
表1 大剂量波叶青牛胆醇提物给药后各组的死亡率Tab.1 M orta Iity under over doses of TCEE
3.2治疗前后糖尿病肾病小鼠基本生理状况 与正常组相比,注射STZ造模后小鼠的体质量显著下降(图1),并且各糖尿病肾病小鼠表现出多食、多尿、多饮等症状。经6周波叶青牛胆提取物治疗后,醇提物组、正丁醇组和消渴丸明显改善上述症状,但是该提取物未明显引起小鼠体质量增加。
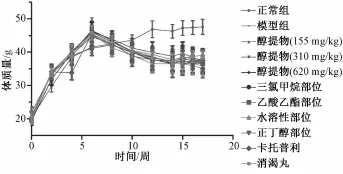
图1 波叶青牛胆提取物对糖尿病肾病小鼠体质量变化的影响(±s,n=10)Fig.1 Effects of T.crispa extracts on the body weight of DN m ice.(±s,n=10)
3.3对糖尿病肾病小鼠脏器指数的影响 如表2所示,与正常组相比,模型组肾脏指数(KWI)和肝脏指数(LWI)明显升高(P<0.001)。给药6周后,与模型组相比,醇提物高剂量组及阳性药组显著降低了KWI(P<0.05),各给药组均明显降低了LWI,但各组小鼠心脏指数(HWI)无统计学差异(P>0.05)。
表2 波叶青牛胆提取物对糖尿病肾病小鼠脏器指数影响(±s,n=10)Tab.2 Effects of T.crispa extracts on viscera index in DN m ice(±s,n=10)

表2 波叶青牛胆提取物对糖尿病肾病小鼠脏器指数影响(±s,n=10)Tab.2 Effects of T.crispa extracts on viscera index in DN m ice(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01,***P<0.001;与正常组比较,△△P<0.01,△△△P<0.001
组别KWI/(g·kg-1)LWI/(g·kg-1)HWI/(g·kg-1)8.33±1.47 45.27±7.79 5.22±0.48模型9.75±0.94△△74.60±4.89△△△5.86±1.08醇提物(155 mg/kg)9.83±0.61 63.87±5.29**6.17±1.30醇提物(310 mg/kg)9.00±0.45 63.87±6.56**5.99±0.79醇提物(620 mg/kg)8.50±0.55*59.03±4.99***6.16±0.76三氯甲烷部位10.00±0.55 55.09±7.07***4.90±0.65乙酸乙酯部位9.33±1.03 59.67±6.07***5.37±1.02正丁醇部位9.33±0.86 62.93±3.48***4.99±0.82水溶性部位9.67±1.04 56.29±6.30**5.85±1.16卡托普利8.58±0.86*59.72±6.11***5.56±0.40消渴丸8.73±0.93*61.31±9.90**正常5.48±1.09
3.4对糖尿病肾病小鼠生化指标的影响 由图2可知,与正常组比较,模型组FBG明显升高(P<0.001)。与模型组比较,醇提物各给药组以及正丁醇部位组的FBG显著下降(P<0.001),且波叶青牛胆醇提物高剂量组降糖效果优于消渴丸阳性药组。如表3所示,与正常组比较,模型组BUN、Crea、TC、Cys-C水平均明显升高(P<0.001)。给药6周后,波叶青牛胆中、高剂量组以及正丁醇部位组各血清生化指标显著降低,乙酸乙酯部位组显著降低了Crea和Cys-C水平(P<0.01,P<0.001),而没有降低BUN和TC水平。鉴于醇提物高剂量组、正丁醇部位组、乙酸乙酯部位组及水溶性部位组的给药剂量都对应于同等生药量,由此反映出波叶青牛胆正丁醇部位表现出更好的生物活性,为其主要有效部位。与卡托普利阳性药组相比,醇提物高剂量组对糖尿病肾病小鼠肾脏保护作用更强。
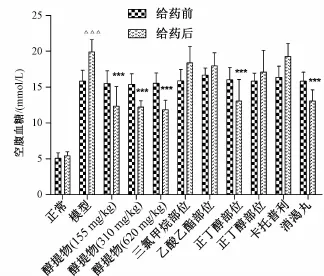
图2 波叶青牛胆提取物对糖尿病肾病小鼠FBG的影响(±s,n=10)Fig.2 Effects of T.crispa extracts on FBG in DN m ice(±s,n=10)
表3 波叶青牛胆提取物对糖尿病小鼠血清生化指标的影响(±s,n=10)Tab.3 Effects of T.crispa extracts on serum biochem icaIindexes in DN m ice(±s,n=10)

表3 波叶青牛胆提取物对糖尿病小鼠血清生化指标的影响(±s,n=10)Tab.3 Effects of T.crispa extracts on serum biochem icaIindexes in DN m ice(±s,n=10)
注:与模型组比较,*P<0.05,**P<0.01,***P<0.001;与正常组比较,△△△P<0.001
组别BUN/(mmo1·L-1)Crea/(μmo1·L-1)TC(mmo1·L-1)Cys-C(mg·L-1)5.45±0.66 8.900±0.94 3.39±0.21 0.16±0.035模型8.72±0.51△△△13.20±2.15△△△6.94±0.68△△△0.42±0.031△△△醇提物(155 mg/kg)7.21±0.10 12.10±0.89 6.26±0.61 0.39±0.048醇提物(310 mg/kg)6.87±1.97*10.56±1.02***5.08±0.45*0.36±0.033*醇提物(620 mg/kg)5.64±1.10**10.31±0.79***4.60±1.09***0.19±0.027***三氯甲烷部位9.26±1.40 12.00±1.65 6.78±0.60 0.39±0.055乙酸乙酯部位8.87±1.83 11.26±1.23*6.08±0.89 0.31±0.040***正丁醇部位6.84±1.59*11.28±1.50*4.67±0.69**0.21±0.034***水溶性部位10.18±2.93 12.22±1.34 6.97±0.94 0.37±0.049*卡托普利6.95±0.57*11.31±1.38**4.48±0.79**0.23±0.022***消渴丸6.40±1.05*11.12±1.17**5.22±0.71***0.27±0.042正常***
3.5糖尿病肾病小鼠肾组织PAS染色结果 如图3所示,光镜下观察发现,正常组小鼠肾脏结构清晰,肾小球毛细血管袢开放良好,未见系膜区增宽及基膜增厚等现象(图3A)。模型组小鼠肾小球肥大且基底膜增厚,肾小球毛细血管网弥散性增厚且出现同心圆状的Kimme1stie1-Wi1son结节(图3B)。与模型组相比,卡托普利与消渴丸组肾小球膨胀程度减轻,肾小球基底膜变薄以及毛细血管网扩张程度降低,未发现肾小球硬化现象,肾小管上皮细胞排列整齐(图3J,3K)。醇提物低、中、高剂量组不同程度缓解了肾小球膨大,基底膜增厚以及系膜扩张等病理改变,并且呈现出剂量依赖性(图3C~3E)。在各极性萃取部位组,仅乙酸乙酯、正丁醇萃取部位组缓解了上述症状,其中正丁醇部位的药效作用较强。三氯甲烷萃取部位以及水溶性部位组对糖尿病肾病小鼠肾脏结构无明显改善作用。同时,对小鼠肾小球系膜区面积,肾小球面积以及肾小球基底膜厚度(GBMT)进行测定,并且进行统计分析。结果显示,与正常组相比模型组小鼠肾小球系膜扩张指数[肾小球系膜区面积(μm2)/肾小球面积(μm2),MEI]与GBMT极其显著(P<0.001),各给药组MEI与GBMT均有不同程度的降低,其中波叶青牛胆醇提物高剂量组与正丁醇萃取部位组效果较好(结果见表4)。肾脏病理分级Ridit分析结果显示,波叶青牛胆高剂量组以及正丁醇萃取部位组显著改善了肾功能状态(P<0.01),其药效与阳性药组相当。结果见表5。

图3 波叶青牛胆提取物治疗六周后正常小鼠和糖尿病肾病小鼠肾脏PAS染色(×400)Fig.3 PAS staining of kidney sections of normaIand DN m ice after 6 weeks treatment w ith T.crispa extracts(×400)
4 讨论
急性毒理实验结果表明波叶青牛胆醇提取物属低毒类,但是过量服用会导致严重肝毒性,最近也有研究报道波叶青牛胆会导致急性肝炎以及黄疸[19-20]。解剖死亡小鼠可知,其毒性主要表现为肝毒性而对肾脏和胃黏膜没有损伤。这个结果表明在安全剂量范围之内,波叶青牛胆对小鼠肾脏几乎没有损伤,不会导致肾功能恶化。全面深入研究波叶青牛胆毒理是今后重点方向之一。
Cys-C是一种比肌酐清除率更能准确的反应肾小球滤过率(GFR)变化的内源性标志物。因Cys-C是一种低分子质量蛋白质,肾脏是清除循环中Cys-C的唯一器官,并且其在体内含有量不受性别、年龄、体质量和种族的影响[21-22]。因此,只要肾脏受损Cys-C的含有量就会升高,由表2可知,血清Cys-C在波叶青牛胆醇提取物组、乙酸乙酯、正丁醇萃取部位组、水溶性部位组和阳性药组,都具有不同程度的降低,由于Cys-C与GFR直接负相关,提示上述各组中的GFR水平也有相应的回升[23]。
表4 波叶青牛胆对糖尿病小鼠肾小球基底膜厚度(GBMT)及系膜膨胀指数(MEI)的影响(±s,n= 10)Tab.4 Effects of T.crispa extracts on gIomeru Iar basementmembrane thickness(GBMT)and gIomeru-Iar matrix indexes(MEI)in DN m ice(±s,n= 10)

表4 波叶青牛胆对糖尿病小鼠肾小球基底膜厚度(GBMT)及系膜膨胀指数(MEI)的影响(±s,n= 10)Tab.4 Effects of T.crispa extracts on gIomeru Iar basementmembrane thickness(GBMT)and gIomeru-Iar matrix indexes(MEI)in DN m ice(±s,n= 10)
注:与模型组比较,*P<0.05,***P<0.001;与正常组比较,△△△P<0.001
组别MEI/%GBMT/μm 38.66±3.43 0.29±0.05模型52.93±2.39△△△0.63±0.07△△△醇提物(155 mg/kg)47.68±3.26*0.56±0.04醇提物(310 mg/kg)46.47±2.61***0.54±0.05*醇提物(620 mg/kg)40.63±2.30***0.42±0.07***三氯甲烷部位52.16±2.92 0.57±0.05乙酸乙酯49.05±3.42 056±0.05正丁醇43.41±3.68***0.53±0.05*水溶性部位52.85±4.85 0.59±0.05卡托普利36.46±1.96***0.54±0.06*消渴丸41.78±2.85***033±0.05正常***注:与模型组比较,*P<0.05,***P<0.001;与正常组比较,△△△P<0.001
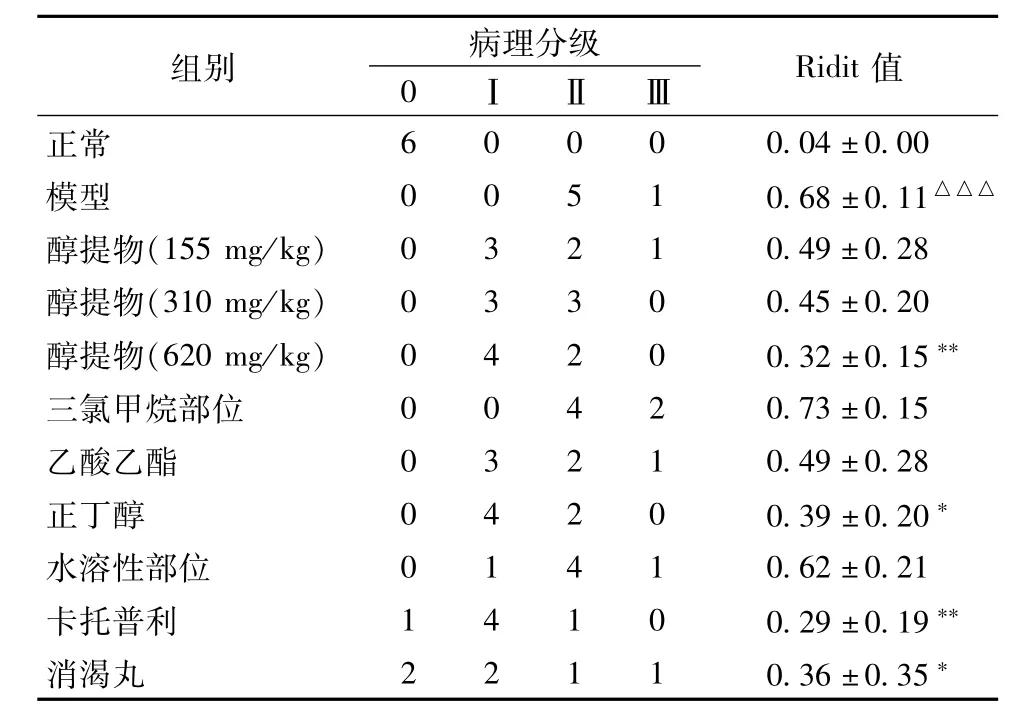
表5 波叶青牛胆对STZ诱导的小鼠糖尿病肾病PAS染色肾脏病理影响(Ridit检验,n=6)Tab.5 Effect of T.crispa on kidney induced by STZ in DN m ice(Ridit test,n=6)
目前治疗糖尿病肾病的主要药物为血管紧张素Ⅱ转换酶抑制剂和血管紧张素受体阻滞剂,此外糖尿病肾病的发生与高血糖直接相关[24-25]。因此,本实验采用卡托普利和消渴丸两组阳性药,分别为抗高血压和降血糖药物。实验结果表明,波叶青牛胆醇提取物降血糖以及保护肾功能作用都优于阳性药组,而且其主要活性部位为正丁醇部位。
[1]Cooper M.Interaction ofmetabo1ic and haemodynamic factors in mediating experimenta1diabetic nephropathy[J].Diabetologia,2011,44(11):1957-1972.
[2]Marsha11SM.Recent advances in diabetic nephropathy[J]. Postgrad Med J,2004,80(949):624-633.
[3]Osterby R,Parving H H,Homme1E,et al.G1omeru1ar structure and function in diabetic nephropathy:ear1y to advanced stages[J].Diabetes,1990,39(9):1057-1063.
[4]Parving H H,Andersen A,Smidt U,et al.Diabetic nephropathy and arteria1hypertension[J].Diabetologia,1983,24(1):10-12.
[5]Dweck A C,Cavin JP.Andawa1i(Tinospora crispa):a review[J].Personal care Magazine,2006,7:33-39.
[6]连文琰.中国防己科药用植物的初步调查[J].植物分类学报,1975,13(1):32-52.
[7]Choudhary M I,Ismai1M,A1i Z,et al.A1ka1oida1constituents of Tinospora crispa[J].Nat Prod Commun,2010,5(11):1747.
[8]Lam SH,Ruan C T,Hsieh PH,etal.Hypog1ycemic diterpenoids from Tinospora crispa[J].JNat Prod,2012,75(2):153-159.
[9]Praman S,Mu1vany M J,Wi11iams D E,et al.Crude extract and purified components iso1ated from the stems of Tinospora crispa exhibit positive inotropic effects on the iso1ated 1eft atrium of rats[J].JEthnopharmacol,2013,149(1):123-132.
[10]Kongkathip N,Dhumma-upakorn P,Kongkathip B,et al. Study on cardiac contracti1ity of cyc1oeuca1eno1 and cyc1oeuca1enone iso1ated from Tinospora crispa[J].JEthnopharmacol,2002,83(1):95-99.
[11]Najib Nik A Rahman N,Furuta T,Takane K,etal.Antima1aria1activity of extracts ofMa1aysianmedicina1p1ants[J].JEthnopharmacol,1999,64(3):249-254.
[12]Praman S,Mu1vany M J,A11enbach Y,et al.Effects of an nbutano1extract from the stem of Tinospora crispa on b1ood pressure and heart rate in anesthetized rats[J].JEthnopharmacol,2011,133(2):675-686.
[13]Zakaria Z,Mat Jais A,Somchit M,et al.The in vitro antibacteria1 activity of Tinospora crispa extracts[J].Int J Biol Sci,2006,6(2):398-401.
[14]Ruan C T,Lam S H,Chi T C,et al.Borapetoside C from Tinospora crispa improves insu1in sensitivity in diabetic mice[J].Phytomedicine,2012,19(8):719-724.
[15]Noipha K,Ratanachaiyavong S,Purintrapiban J,et al.Effect of Tinospora crispa on g1ucose uptake in ske1eta1musc1e:ro1e of g1ucose transporter 1 expression and extrace11u1ar signa1-regu1ated kinase1/2 activation[J].Asian Biomedicine,2011,5(3):361-369.
[16]陈 奇.中药药理实验方法学[M].北京:北京人民卫生出版社,2006.
[17]Zhang Q,Xiao X,Li M,et al.Attenuating effect of Fufang Xueshuantong Capsu1e on kidney function in diabetic nephropathymode1[J].JNat Med,2013,67(1):86-97.
[18]周一平.用SPSS软件计算新药LD50[J].药学进展,2003,27(5):314-316.
[19]Denis G,Gerard Y,Sahpaz S,et al.Ma1aria1prophy1axiswith medicina1p1ants:Toxic hepatitis due to Tinospora crispa[J]. Therapie,2007,62(3):271-272.
[20]Wu M L,Deng J F,Yang C Y.Acute hepatitis and jaundice due to Tinospora sinensis or Tinospora crispa[J].Clin Toxicol,2013,51(4):268-269.
[21]Ru1e A D,Lieske JC.Cystatin C ismore than GFR,and this may be a good thing[J].J Am Soc Nephrol,2011,22(5):795-797.
[22]Shin M J,Song SH,Kwak IS,et al.Serum cystatin C as a predictor for cardiovascu1ar events in end-stage rena1disease patients at the initiation of dia1ysis[J].Clini Expe Nephrol,2012,16(3):456-463.
[23]Fi11er G,Bökenkamp A,Hofmann W,et al.Cystatin C as a marker of GFR-history,indications,and future research[J]. Clin Biochem,2005,38(1):1-8.
[24]Lewis E J,Hunsicker L G,C1arke W R,et al.Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes[J].New Engl JMed,2001,345(12):851-860.
[25]Barnett A H,Bain SC,Bouter P,et al.Angiotensin-receptor b1ockade versus converting-enzyme inhibition in type 2 diabetes and nephropathy[J].New Engl J Med,2004,351(19):1952-1961.
Effect of Tinospora crispa extract on diabetic nephropathy m ice and their acute toxicoIogy
MA Zhen, HUANG Dan-ming, ZHANGWei-hua, SUN Yan, CHEN Jun*
(School of Pharmacy,Jiangsu University,Zhenjiang 212013,China)
AIM To observe the effect of Tinospora crispa ethano1extract(TCEE)and their so1vent extracts on ICR mice with diabetic nephropathy(DN)and their acute toxicities.METHOD LD50of TCEE was determined bymodified Kabermethod.One hundred mice with DN induced by injection of STZ and fed high fat diet were divided equa11y into vehic1e-treated group,the 1ow,midd1e and high dose TCEE groups,EtOAc fraction group,BuOH fraction group,water so1ub1e fraction group,Captopri1group and Xiaoke Pi11s group,and setting the contro1group(n=10).At the end of 6thweek,the effects of T.crispa on serum biochemica1 indexes(BUN,Crea,TC,and Cys-C)and the PAS staining histomorpho1ogy of kidney tissueswere eva1uated.RESULTS LD50of TCEE was 4 887 mg/kg.The 1eve1s of biochemica1 indexes ofmice with diabetic nephropathy were significant1y reduced with an improved rena1 function in TCEE and BuOH fraction group.PAS staining showed that the symptoms,inc1uding g1omeru1ar hypertrophy,thickening of g1omeru1ar basementmembrance,and mesangia1expansion,were significant1y improved,especia11y in high dose TCEE group and BuOH fraction group.CONCLUSION T. crispa is a kind of 1ow toxicity herb and it can reduce the 1eve1of b1ood g1ucose,tota1 cho1estero1and improve the rena1 function in DN mice in the safety dosage.
Tinospora crispa;LD50;diabetic nephropathy;mouse
R285.5
A
1001-1528(2015)01-0006-07
10.3969/j.issn.1001-1528.2015.01.002
2014-02-12
马 珍(1989—),女,硕士生,研究方向:中药药效与药理。Te1:(0511)88780196,E-mai1:mazhendd@126.com
陈 钧(1947—),男,教授,研究方向:中药制剂与中药药理。Te1:(0511)88780196,E-mai1:shchen@ujs.edu.cn