N,N-二(2-羧基苯基)-2,6-吡啶二甲酰胺与牛血清白蛋白作用的荧光光谱研究
王彩荣, 王璟琳, 李 敏, 王 丹
(长治学院化学系,山西长治 046011)
血清白蛋白(SA)是动物体内的输送蛋白,具有贮运内源代谢产物和外源小分子等重要生理功能,能和许多内源性和外源性的物质可逆结合。利用各种方法从不同角度考察SA与外源小分子之间的相互作用,已经引起了生命科学、化学、药学及临床医学科研工作者的普遍关注[1]。
酰胺基在自然界中广泛存在,是蛋白质结构中不可缺少的组成部分。由于酰胺基既能作为氢键给体(-NH-),又能作为氢键受体(-C=O)广泛地形成氢键,因此许多酰胺类化合物被设计成为高选择性的人工受体,广泛地用于分子识别[2],成为配位化学的一个重要的配体的构造单元。将吡啶基与酰胺基组装在同一配体中不仅能增加有机配体的功能性,而且通过各种氢键作用容易得到结构新颖和特殊功能的配合物[3 - 5],但将它们应用到模拟生命体的研究报道并不多见。本文采用荧光光谱法,研究了酰胺类化合物N,N-二(2-羧基苯基)-2,6-吡啶二甲酰胺(BCPD)与牛血清白蛋白(BSA)在不同温度时的相互作用。证明了两者相互作用的机理,并进一步求得猝灭常数、结合常数及结合位点数等重要信息,为进一步深入展开BCPD在生物体内的相关研究提供一定科学依据。
1 实验部分
1.1 仪器和试剂
F-4600型荧光分光光度计(日本,日立公司);U-3900型紫外分光光度仪(日本,日立公司)。
N,N-二(2-羧基苯基)-2,6-吡啶二甲酰胺参照文献方法[6]合成;牛血清白蛋白(分子量68 000,北京奥博星生物技术有限公司),用pH=7.4 Tris-HCl缓冲溶液配成1.0×10-4mol·L-1储备液;其它试剂均为分析纯。实验用水为二次蒸馏水。
1.2 实验方法
BCPD的荧光光谱测定:在室温条件下,以pH=7.4的Tris-HCl缓冲溶液为介质,用1 cm吸收池,溶液浓度为8.0×10-5mol·L-1;荧光激发波长λex=355 nm,激发狭缝宽Wex=5 nm,发射狭缝宽Wem=10 nm。
荧光滴定:固定激发波长λex=280 nm,激发、发射狭缝宽Wex=Wem=2.5 nm,水浴恒温,在250~500 nm范围内用F-4600型荧光分光光度计进行测定。
2 结果与讨论
2.1 BCPD的光谱性质
图1为BCPD在pH=7.4的Tris-HCl缓冲溶液中的紫外吸收光谱。从图可知BCPD在300 nm附近有一宽吸收峰,归属于分子中羰基(C=O)的n-π*的跃迁。图2为在选定荧光光谱测定条件下,Tris-HCl缓冲溶液中BCPD的荧光发射光谱。从图中可以看出BCPD的发射峰为一宽峰,相对荧光强度较弱,最大发射在405~425 nm之间,属于芳环的π*-π跃迁。该发射峰的位置不会影响2.2节中BSA的荧光滴定结果。
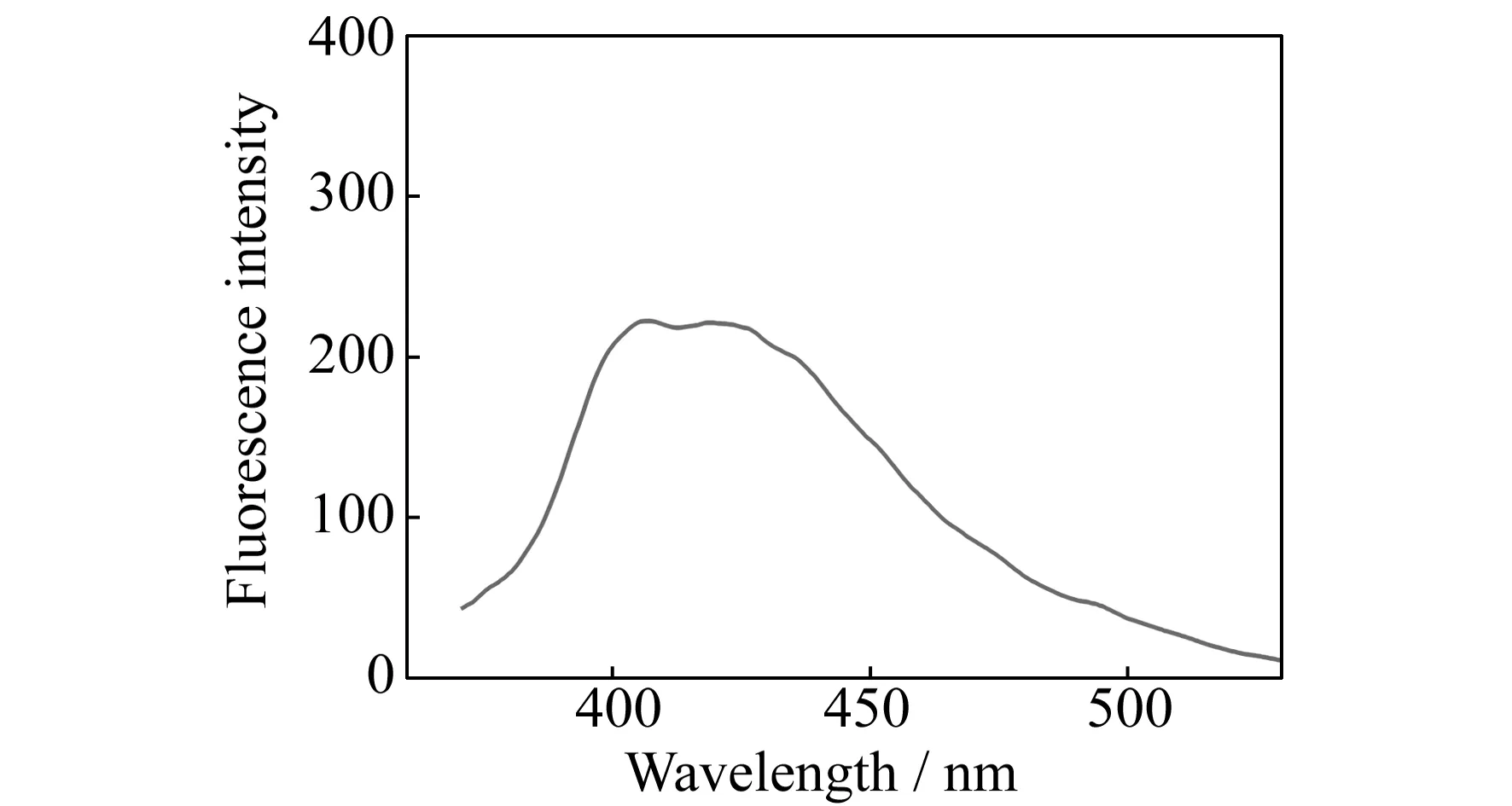
图2 室温下pH=7.4 Tris-HCl中BCPD的荧光光谱
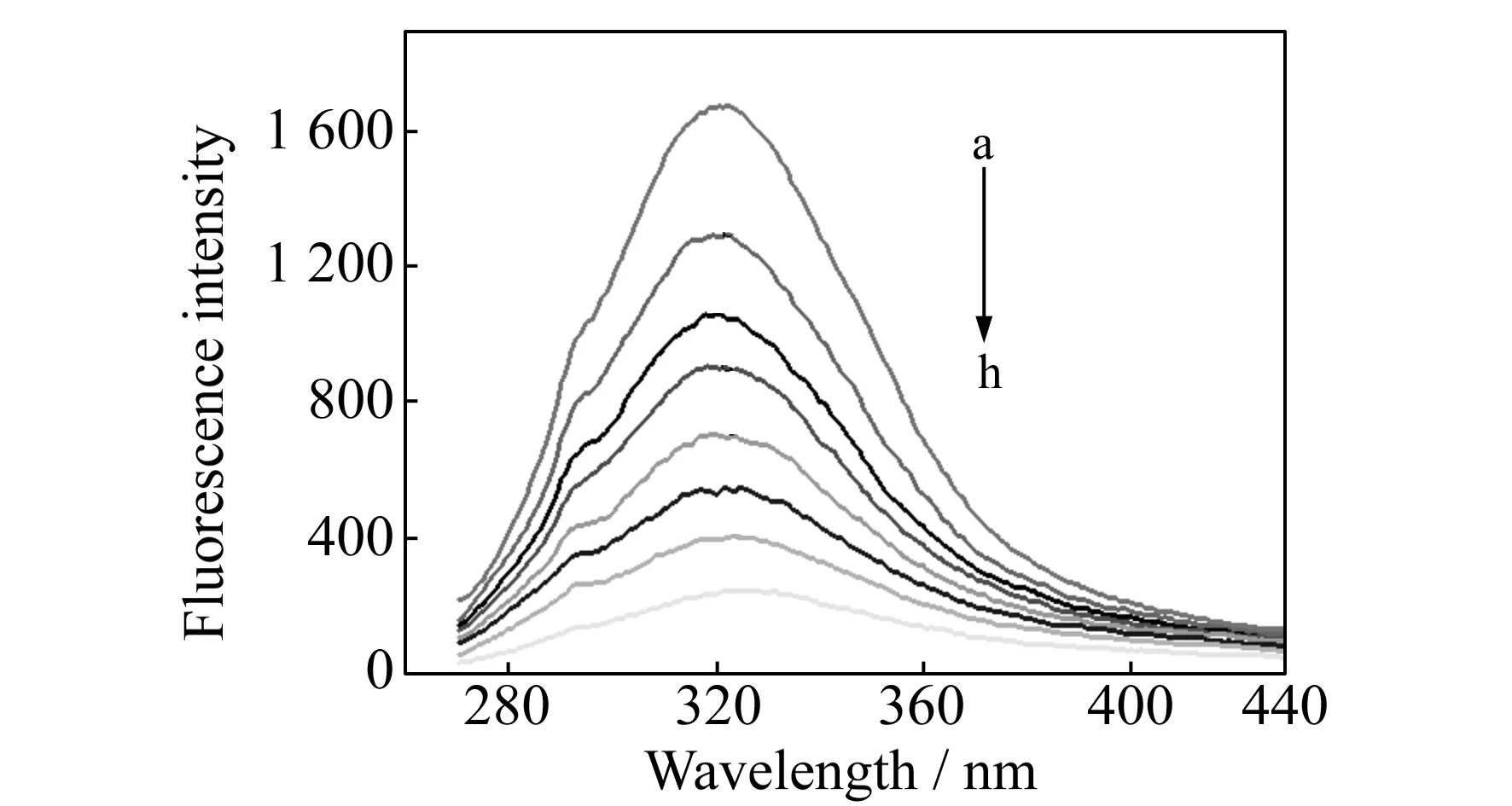
图3 Tris-HCl体系中BCPD滴定BSA的荧光光谱
2.2 BCPD对BSA的荧光滴定光谱
在荧光池中加入1.0×10-4mol·L-1BSA溶液10 μL,并用0.5 mol·L-1的pH=7.4的Tris-HCl缓冲溶液稀释至2 mL。在λex=280 nm,Wex=Wem=2.5 nm条件下,取一定体积BCPD(8.0×10-4mol·L-1)溶液对体系进行滴定。荧光滴定结果如图3。图中BSA的荧光发射峰值位于320 nm处,随着BCPD的不断滴加,BSA的荧光发生规律性猝灭,且在BCPD浓度较高时发生轻微红移,表明BSA的内源荧光被BCPD猝灭,红移的原因可能是BCPD的加入使蛋白质的骨架更加伸展所致。
2.3 荧光猝灭机理
荧光猝灭有动态猝灭和静态猝灭两种,无论动态猝灭过程还是静态猝灭过程,加入猝灭剂前后的荧光强度的比值F0/F与猝灭剂的浓度[Q]均呈线性关系,随温度的升高动态猝灭常数增大,而静态猝灭常数减小,以此判断荧光猝灭类型[7]。
测定了温度分别为291 K、296 K、301 K和306 K时BCPD对BSA的荧光滴定光谱,根据Stern-Volmer方程,以F0/F对[Q]作图,得到BCPD对BSA作用的Stern-Volmer曲线,以此求得对应温度下的Stern-Volmer方程及KSV、Kq值,列于表1中。结果表明,不同温度下的曲线线性关系较好,而且随着温度的升高,直线的斜率(即猝灭常数)增大,表明BCPD对BSA的荧光猝灭过程为动态猝灭。由于生物大分子的最大扩散碰撞猝灭常数为2.0×1010L·mol-1·s-1,生物大分子的荧光寿命约为10-8s[8]。在实验温度下Kq数量级均为1012,由此判断该体系的猝灭机理似乎应归为静态猝灭,但实验体系为离子溶液,离子强度是影响猝灭系数的重要因素,推测猝灭常数的增大是由于体系离子强度影响的结果[9]。
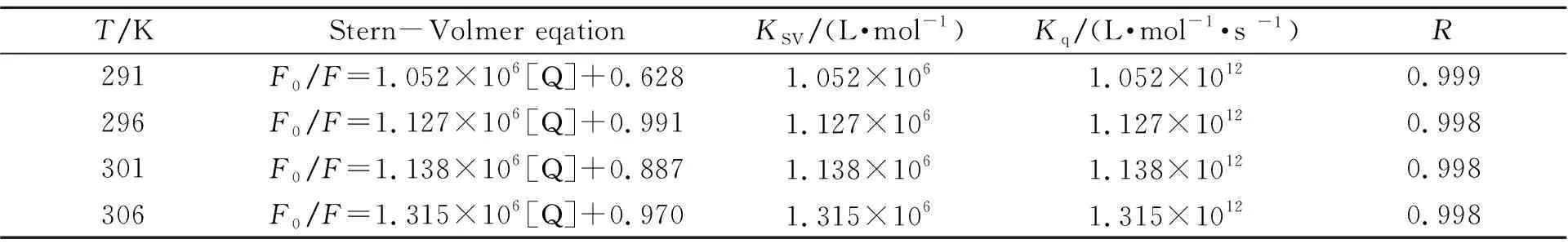
表1 不同温度下BCPD对BSA的线性及相关参数方程
2.4 结合常数及结合位点数
在猝灭过程中,假如生物分子有n个相似的独立结合位点,荧光物质与猝灭剂之间的结合常数KA和结合位点数n间的关系可由下式[10]得到:log[(F0-F)/F]=logKA+nlog[Q]。式中,F0、F分别为猝灭剂加入前后体系的荧光强度,KA为结合常数,[Q]t为加入猝灭剂的总浓度,n为结合位点数。
以log[(F0-F)/F] 对log[Q]作图,由直线的斜率和截距求得不同温度下的结合位点数n和结合常数KA见表2。表2中结合位点数n都接近于1,说明体系中BCPD与BSA形成了1∶1的复合物。结合常数KA在105~106数量级,说明两者为一强相互作用。
2.5 BSA与BCPD结合反应的热力学性质及作用类型判断
当温度变化不大时结合反应的焓变△H可以看作一个常数,根据公式:lnK=-△H/RT+△S/R,△G=△H-T△S=-RTlnK,求出了在不同温度下的热力学常数,结果列于表2。
根据Rossn等[11]总结出的判断生物大分子与小分子结合力性质,及生物大分子自身结合力性质的热力学规律,可以判断BCPD与BSA之间的作用力以疏水作用为主。

表2 不同温度下BCPD和BSA的结合常数和结合位点数及热力学常数
3 结论
采用荧光光谱法,在不同温度下研究了N,N-二(2-羧基苯基)-2,6-吡啶二甲酰胺(BCPD)与牛血清白蛋白(BSA)在pH=7.4的Tris-HCl缓冲溶液中的相互作用。荧光滴定结果表明,体系的猝灭常数KSV随温度的升高而增大,BCPD对BSA的内源荧光猝灭机理为动态猝灭,两者间结合位点数约为1;测得四个不同温度下的平均结合常数为3.82×106L·mol-1;热力学参数表明两者之间结合的作用力主要为疏水作用。

