新一代重离子束治癌的最佳束流选择
聂晶,李贺,李冰燕,裴海龙,周光明
1. 苏州大学医学部放射医学与防护学院,江苏高校放射医学协同创新中心,苏州 215123
2. 中国科学院近代物理研究所,兰州 730000
3. 中国科学院大学,北京 100049
*综 述*
新一代重离子束治癌的最佳束流选择
聂晶1,李贺2,3,李冰燕1,裴海龙1,周光明1
1. 苏州大学医学部放射医学与防护学院,江苏高校放射医学协同创新中心,苏州 215123
2. 中国科学院近代物理研究所,兰州 730000
3. 中国科学院大学,北京 100049
重离子束在肿瘤治疗方面具有独特的物理学特性和生物学优势,临床上采用碳离子束和氖离子束治疗,都取得了很好的疗效。本文通过文献调研和理论计算,从物理学和生物学角度比较了碳、氮、氧、氟、氖等五种离子束的特点。将所有离子的Bragg峰定位在水中30 cm处时,氧离子束比碳离子束的核碎片产额更少、侧散射更小;在生物学特性方面,氧离子束也可能与其它离子束存在差异,氧增比可能更小,对肿瘤干细胞的杀伤力更强,有可能作为新一代肿瘤放疗用束流。
重离子束;肿瘤;放射治疗;RBE;OER
肿瘤是人类三大死因之一[1,2]。世界卫生组织《2014世界癌症报告》显示,2012年中国有220万人死于肿瘤,新增307万癌症患者,新增数量居世界第1位,远高于发达国家[3]。据估计,到2049年我国肿瘤发病率可能达到400/10万人[4]。显然,我国在肿瘤的诊断与防治方面形势严峻、任重而道远。
放射疗法是肿瘤临床治疗的主要方法之一。肿瘤放射治疗的基本原则是将辐照剂量最大限度地、精确地定位到肿瘤靶区,同时将对周围正常组织的损伤尽可能降到最低。X射线、γ射线等低线性能量转移(LinearEnergy Transfer, LET)射线进入人体时,入射路径上的正常组织所遭受的辐照剂量高于肿瘤靶区,而且靶区后部的正常组织也不可避免地遭受到一定的辐射,因而具有较大副作用[5]。重离子束进入人体后,在人体内的能量沉积方式与常规X射线、γ射线不同,呈倒转的剂量分布:即入射处能量损失小,在一定射程内呈现出较为平坦、均一的坪区,在射程的末端能量集中沉积,形成Bragg峰,之后能量沉积迅速下降至极低水平(如图1)。Bragg峰在人体组织中所处的位置与离子束的初始能量呈正相关(如图1A),通过调节重离子束的初始能量,可以将Bragg峰准确定位于肿瘤靶区,使得辐照剂量集中在肿瘤组织内,同时有效降低正常组织(包括入射路径上的正常组织和肿瘤靶区后部的正常组织)的受照剂量[6]。因此,重离子束治癌具有独特的物理学优势。

图1 不同离子在水中的能量沉积分布Fig. 1 Energy deposition of five kinds of heavy ion particles in water Simulation calculation was carried out with Trim9.0. A, initial energy of each kind of heavy ion particles was 500 MeV/u. B, Bragg peak of each kind of heavy ion particles was located at 30 cm far from their entrance into water.
美国劳伦斯伯克利国家实验室(Lawrence Berkeley National Laboratory,LBNL)的Tobias等人于1954年提出重离子束治癌的概念,1975年在世界上首次使用重离子束治疗肿瘤病人[7]。1994年日本放射医学综合研究所的医用重离子加速器HIMAC开始临床应用;1996年德国重离子中心开始临床试验;2006年中国科学院近代物理研究所治疗了第一例病人。迄今为止,重离子束治癌临床和临床前期试验共治疗了逾万例病人,局部控制率和五年生存率等都明显高于其它疗法[8];另外,现有临床结果也初步显示,重离子束治癌复发率和转移率都低于常规放疗[9-11]。如今,日本新建了多家重离子束治癌中心,德国、意大利、中国上海都相继建成了新的重离子束治癌专用装置,奥地利、中国武威和兰州的重离子束治癌装置也在建设中。重离子束治癌在未来几十年将蓬勃发展。
1 重离子束治癌的优势
重离子束治癌具有如下物理学优势:1、独特的剂量分布。重离子束坪区的能量损失少,LET小;随着深度增加,LET也随之增加,并在Bragg峰区达到最大值,峰坪比大;尾部能量沉积急剧降至坪区以下。因此,可以将大部分辐照剂量定位到肿瘤靶区,同时周围正常组织所遭受的剂量小。2、散射小。重离子束能量高、质量大,与体内生物分子碰撞所产生的运动方向改变小,因而不仅具有明确的射程,而且侧向散射小、射程歧离小,有利于Bragg峰区在肿瘤靶区的准确定位。3、发射的正电子有助于Bragg峰区所在位置的跟踪。碳和更重的离子与人体内的生物分子碰撞发生核反应时,发射出正电子,可以通过正电子断层扫描(positive electron tomography,PET)进行跟踪定位,从而提供反馈信号,供治疗计划系统用以验证和调整。
重离子束治癌具有如下生物学优势:1、相对生物效应(relative biological effectiveness, RBE)高。与X射线、γ射线等常规放疗比较,重离子束属于致密电离辐射,LET高,诱导的DNA团簇性损伤难于修复,且修复的正确率低,因而RBE高[12]。2、氧增比(Oxygen Enhancement Ratio,OER)小。由于重离子束属于致密的电离辐射,即便是在乏氧细胞中也可以诱导产生复杂的、难于修复的DNA团簇损伤,因而OER小。X射线等常规辐射的OER为2.5-3[13],质子束与之相近[14],但高LET离子的 OER可以低到1[13]。3、细胞周期依赖性小。对于常规射线而言,合成期细胞具有较强的辐射抗性,而分裂期细胞对辐射比较敏感。但是对于重离子束而言,不同时相细胞的敏感性差别相对于常规射线而言小得多[15]。4、能有效杀灭肿瘤干细胞。最新实验研究证实了肿瘤干细胞的存在[16-20]。肿瘤干细胞假说认为,肿瘤干细胞存在于肿瘤组织中,数量虽然不多,但具有自我更新能力、可以分化为肿瘤细胞的不同亚群,是肿瘤增殖、侵润、转移的根源,其数量与肿瘤的恶性程度和预后密切相关[21]。研究表明,肿瘤干细胞抗氧化活性高、DNA修复能力强、DNA修复以精确度更高的同源重组修复为主[22],因此,肿瘤干细胞对X射线等低LET辐射具有较强的抗性,是肿瘤放疗后复发和转移的主要原因[23,24]。有效杀灭肿瘤干细胞是肿瘤放疗成功的关键。2011年Cui等人首次用实验证明了碳离子束能够有效杀灭肿瘤干细胞[25]。碳离子束对头颈部鳞状腺癌肿瘤干细胞[26]、结肠癌干细胞[27]的致死作用也得到了证实。我们则从神经胶质瘤细胞系M059K和M059J中分别分离出肿瘤干细胞,并采用经典的克隆形成和软琼脂培养两种方法检测了肿瘤干细胞样细胞的辐射敏感性,发现碳离子束对肿瘤干细胞的杀灭作用显著强于相同剂量的X射线。
正是由于这些独特的物理学和生物学优势,重离子束被誉为21世纪最先进的放疗用射线。
2 重离子束治癌束流品质的选择
目前,临床用于治疗的重离子束为碳离子束和氖离子束。碳离子束比质子束的侧向散射少、射程歧离小、剂量分布好[19],而且是适用于PET监测照射精度最轻的离子[28]。随着原子序数的增加,核碎片的反应截面升高,核碎片的入射深度大于主束,对肿瘤后部正常细胞也会有影响。氖等重离子束的坪区生物效应已经很高,Bragg峰区RBE的增加不大,因此,重离子束治癌比较适宜采用比碳重比氖轻的重离子束。美国LBNL最初采用氖离子束治疗病人,取得了不错的疗效[29];目前临床上多采用碳离子束进行肿瘤治疗。然而,比碳重比氖轻的重离子还有氮离子、氧离子、氟离子等,究竟哪一种离子束是肿瘤治疗的最佳束流尚为未知。我们假定肿瘤靶区位于体内30 cm处,人体组织等效为水,然后将这3种离子的物理学、生物学特性与碳、氖离子束进行了比较,以期筛选出适合肿瘤放疗的最佳重离子束流。
2.1 核碎片
高能重离子束与靶物质碰撞发生核反应,产生比入射离子轻的核碎片,核碎片的产额和组成影响重离子束的射程并产生靶后剂量,因而核碎片不宜多。核碎片的产额与组成与重离子束的种类、初始能量、靶材料的成分以及靶的厚度有关。我们假定肿瘤靶区位于体内30 cm处,为了将Bragg峰定位在肿瘤靶区,碳离子束的初始能量应该为423 MeV/u,氮离子束为466.5 MeV/u,氧离子束为510 MeV/u,氟离子束为530 MeV/u,氖离子束为590 MeV/u。我们采用合适碎片计算的软件Fluka进行了碎片产额计算,结果如图2所示。重离子束所产生的核碎片产额与粒子种类有关;碳离子束产生的核碎片最多,氧、氮和氖离子束居中,氟离子束最少。随着原子序数的增加,核碎片的入射深度逐渐增加,对肿瘤靶区后面正常组织的影响也会增加。

图 2 Bragg峰位于体内30cm时五种重离子束所产生的碎片产额利用Fluka软件模拟计算423 MeV/u碳离子束、466.5 MeV/u氮离子束、510 MeV/u氧离子束,530 MeV/u氟离子束、590 MeV/u氖离子束的碎片产额与分布(A) ,及其对射程和LET的影响(B)。Total,碎片总产额。Fig. 2 Fragments induced in water by the five kinds of heavy ion particles with the energy resulting in the localization of their Bragg peaks at 30 cm far from their entrance into water. The data were obtained with Fluka simulation. The energy of carbon ions is 423 MeV/u, nitrogen 466.5 MeV/u, oxygen 510 MeV/u, fluorin 530 MeV/u and neon 590 MeV/u. A, the distribution and yields of fragments induced by the ions. B, Influence of the fragments on LET and range. Total, total yields of the fragments.
2.2 散射
有研究表明,束流穿过8 cm厚的水之后,主束的宽度增幅有限,而碎片的宽度显著增加;与氖离子束等相比,碳离子产生的核碎片少,因此,利用碳离子束可以获得理想的侧向散射[28]。我们采用 Trim9.0软件计算了五种重离子束的射程歧离和侧向散射,结果如图3所示。穿过30 cm厚的水,五种重离子束中氮离子束的射程歧离最小(1.17 cm),氟离子束最大(1.24 cm);氧离子束(1.23 cm)和碳离子束(1.22 cm)居中。五种重离子束中,碳离子束的侧向散射最大(1.87 mm),氖离子束最小(1.36 mm),氧离子束居中(1.57 mm),说明侧向散射与重离子束的原子序数呈负相关,离子越重,侧向散射越小。
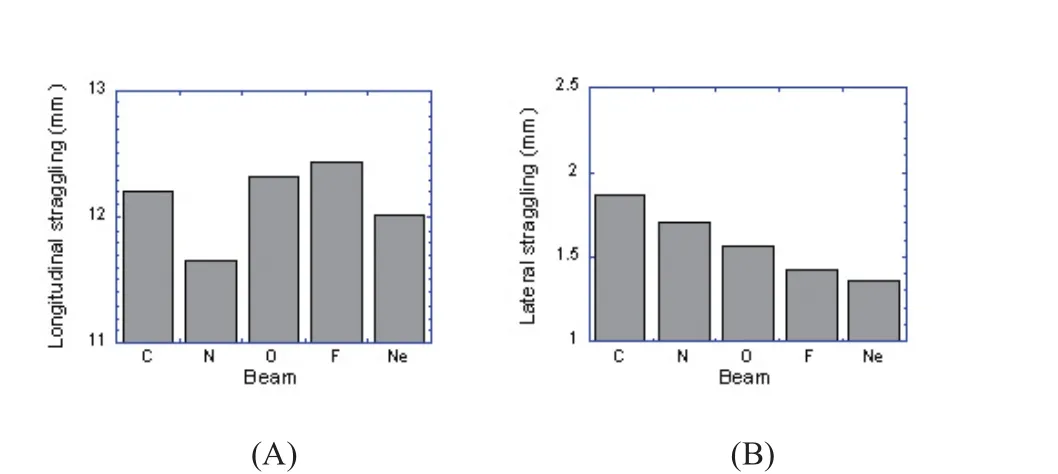
图3 Bragg峰位于体内30cm时,五种重离子束的射程歧离(A)和侧向散射(B)Fig. 3 The longitudinal (A) and lateral (B) straggling of the five kinds of heavy ion particles induced in water when their Bragg peaks were located at 30 cm far from their entrance into water.
2.3 PET跟踪反馈
碳离子是可以产生正电子发射的最轻重离子[28],所以,理论上,氮、氧、氟、氖等重离子束都可以进行PET定位。
2.4 RBE
如图1B所示,较轻离子束坪区的LET小,这类辐射在正常组织中产生的损伤大都是可以修复的,RBE接近1;Bragg峰定位在30 cm处的肿瘤靶区,碳离子束坪区的LET为10.34 keV/μm,氮离子束为13.55 keV/ μm,氧离子束为17.55 keV/μm,氟离子束为21.83 keV/μm,氖离子束为25.89 keV/μm。RBE随着LET的增加而增加,在特定LET范围达到最大值,然后随着LET的进一步增加,RBE值由于过杀效应反而下降。RBE峰值对应的LET跟原子序数密切相关。碳离子束在200 keV/μm时RBE最大,峰区的高剂量被高RBE增强[17],这是采用碳离子束进行肿瘤治疗的一大优势。对于较轻的离子,RBE最大值处于峰区尾部剂量较小的部分,氦离子束在100 keV/μm,质子束在25 keV/μm;对于更重的离子,RBE最大值在峰区之前[19]。理论上说来,氮、氧、氟三种离子坪区的RBE和最大RBE所处LET位置都介于碳离子束和氖离子束之间。遗憾的是,到目前为止还没有文献报道研究这五种离子束的RBE与LET的相关性,虽然这对于临床选择最佳束流非常关键。
2.5 OER
肿瘤靶区内部存在大量的乏氧细胞,这类细胞具有较强的辐射抗性,影响常规放疗的疗效。Hirayama等人报道,细胞存活水平为10%时,X射线的OER为2.8±0.2;而80 keV/μm碳离子束的OER为1.8±0.0[30]。离子越重,OER应该越小,对乏氧细胞和有氧细胞产生的杀灭效应也越接近[31]。到目前为止我们没有检索到氮、氧、氟、氖等重离子束的OER值。但是,氧离子束的OER非常值得关注。氧离子束停留在肿瘤靶区后,不仅像其它重离子束一样,导致生物分子的电离、诱导自由基的产生,而且一方面它自身有可能参与含氧自由基的形成,另一方面也有可能直接导致碱基或脂质等生物分子的氧化,从而在理论上提高对乏氧细胞的致死率。因此,在这五种重离子束中,氧离子束很可能具有最小的OER,对乏氧细胞的杀伤力最强。
2.6 对肿瘤干细胞的致死作用
辐射对肿瘤干细胞的致死效应与辐射品质(radiation quality,包括离子种类和LET等)是密切相关的,但是,不同辐射品质对于肿瘤干细胞的影响研究还是空白。深入研究不同辐射品质对肿瘤干细胞的致死效应,选择最佳的辐照品质,尤其是离子种类,对于重离子束治癌临床治疗计划系统的优化非常重要。肿瘤干细胞具有较强的抗氧化能力,是辐射抗性高的原因之一[31],但氧离子束照射很可能提高自由基的产额,或者直接导致生物分子的氧化,因而使得氧离子束对这类细胞的致死作用很可能比碳离子束更强。
3 展望
重离子束由于其独特的物理学特点和生物学优势,在肿瘤治疗方面显示出广阔的应用前景。目前重离子束治癌临床上采用的束流是碳离子束和氖离子束,碳离子束是否是临床用最佳束流还值得探讨,尤其是开展氮、氧、氟三种离子的生物效应研究,对于选择下一代重离子束治癌最佳束流是非常重要的。根据肿瘤的大小和深度,可以选取不同的离子种类来进行临床治疗。最初人们认为,对于相对较浅的肿瘤,可以用氩粒子;肿瘤深度为25 cm左右时,硅离子束似乎最有利,氖离子束可用于更深部的肿瘤治疗[32];后来人们意识到对于深部肿瘤而言,重离子束治癌应该严格控制为比氖轻的离子[28]。显然,实验研究氮、氧、氟等离子束杀灭肿瘤细胞(尤其是肿瘤干细胞)的RBE、OER,对于重离子束治癌临床治疗计划的优化、提高重离子束治癌的临床疗效是非常必要的。氧离子束不仅跟碳离子束一样是人体基本组成元素、可以用PET进行反馈跟踪,而且跟碳离子束相比,氧离子束的核碎片产额少、侧向散射小;更重要的是,理论上推测,氧离子束很可能比碳离子束OER更小、对肿瘤干细胞的致死作用更强,临床效果更好,很有可能是重离子束治癌的最佳束流。因此,我们需要加强氧离子束对肿瘤细胞(特别是肿瘤干细胞)的生物效应研究。
(References)
[1] Siegel R, Miller K D, Jemal A D. Cancer statistics[J]. CA Cancer J Clin, 2015, 65: 5-29.
[2] 陈万青, 张思维, 郑荣寿, 等. 中国2009年恶性肿瘤发病与死亡分析[J]. 中国肿瘤, 2013, 22(1): 1-11.
[3] Stewart B W , Wild C P. World cancer report 2014[M]. IARC, 2014.
[4] 赵平. 中国癌症流行态势与对策[J]. 医学研究杂志,2013, 42(10):3.
[5] Vogelius I R, Bentzen S M. A literature-based metaanalysis of clinical risk factors for development of radiation induced pneumonitis[J]. Acta Oncol, 2012,51(8): 975-983.
[6] Fokas E, Kraft G, An H, et al. Ion beam radiobiology and c ancer: time to update ourselves[J]. Biochim Biophys Acta,2009, 1796(2): 216-229 .
[7] Schardt D. Tumor therapy with high-energy carbon ion beams[J]. Nuclear Phys A, 2007, 787: 633c-641c.
[8] Schlaff C D, Krauze A, Belard A, et al. Bringing the heavy carbon ion therapy in the radiobiological and clinical context[J]. Radiat Oncol, 2014, 9: 88.
[9] Ohno T. Particle radiotherapy with carbon ion beams[J]. EPMA J, 2013, 4(1): 9.
[10] Allen C, Borak T B, Tsujii H, et al. Heavy charged particle radiobiology using enhanced biological effectiveness andimproved beam focusing to advance cancer therapy[J]. Mutat Res, 2011, 711: 150-157.
[11] Mizoe J, Tsujii H, Hasegawa A, et al. Phase I/II clinical trial of carbon ion radiotherapy for malignant gliomas:combined X-ray radiotherapy, chemotherapy and carbon ion radiotherapy[J]. In J Radiat Oncol Biol Phys, 2007,69(2): 390-396.
[12] Skinner H D, Hong T S, Krishnan S. Charged-particle therapy for hepatocellular carcinoma[J]. Semin Radiat Oncol, 2011, 21(4): 278-286.
[13] Fokas E, Kraft G, An H, Engenhart-Cabillic R. Ion beam radiobiology and cancer: time to update ourselves[J]. Biochim Biophys Acta, 2009, 1796: 216-229.
[14] Kanemoto A, Hirayama R, Moritake T, et al. RBE and OER within the spread-out Bragg peak for proton beam therapy: in vitro study at the Proton Medical Research Center at the University of Tsukuba[J]. J Radiat Res,2014, 55: 1028-1032.
[15] 叶飞, 李强. 重离子治癌相关研究[J]. 原子核物理评论,2010, 27(3): 309-316.
[16] Woll P S, Kjällquist U, Chowdhury O, et al. Myelodysplastic syndromes are propagated by rare and distinct human cancer stem cells in vivo[J]. Cancer Cell, 2014,25(6): 794-808.
[17] Miranda-Lorenzo I, Dorado J, Lonardo E, et al. Intracellular autofluorescence: a biomarker for epithelial cancer stem cells[J]. Nat Methods, 2014,11(11): 1161-1169.
[18] Driessens G, Beck B, Caauwe A, et al. Defining the mode of tumour growth by clonal analysis[J]. Nature, 2012,488: 527-31.
[19] Chen J, Li Y, Yu T S, et al. A restricted cell population propagates glioblastoma growth after chemotherapy[J]. Nature, 2012, 488: 522-7.
[20] Schepers A G, Snippert H J, Stange D E, et al. Lineage tracing reveals Lgr5+ stem cell activity in mouse intestinal adenomas[J]. Science, 2012, 337(6095): 730-5.
[21] Rasheed Z A, Kowalski J, Smith B D, et al. Concise review: emerging concepts in clinical targeting of cancer stem cell[J]. Stem Cells, 2011, 29: 883-887.
[22] Bao S D, Wu Q L, McLendon R E, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J]. Nature, 2006, 444: 756-7601.
[23] Brunner T B, Kunz-Schughart L A, Grosse-Gehling P, et al. Cancer stem cells as a predictive factor in radiotherapy[J]. Semin Radiat Oncol, 2012, 22:151-174.
[24] de Jong MC, Pramana J, van der Wal JE, et al. CD44 expression predicts local recurrence after radiotherapy in larynx cancer[J]. Clin Cancer Res, 2010, 16: 5329-5338.
[25] Cui X, Oonishi K, Tsujii H, et al. Effects of carbon ion beam on putative colon cancer stem cells and its comparison with X-rays[J]. Cancer Res, 2011, 71(10):3676-87.
[26] Bertrand G, Maalouf M, Boivin A, et al. Targeting head and neck cancer stem cells to overcome resistance to photon and carbon ion radiation[J]. Stem Cell Rev Rep,2014, 10: 114-126.
[27] Oonishi K, Cui X, Hirakawa H, et al. Different effects of carbon ion beams and X-rays on clonogenic survival and DNA repair in human pancreatic cancer stem-like cells[J]. Radiother Oncol, 2012, 105(2): 258-65.
[28] Stelzer H. Tumor therapy with heavy ions at GSI[J]. Nuclear Phys B (Proc Suppl), 1998, 61B: 650-657.
[29] 马林, 周桂霞, 冯林春. 恶性肿瘤高LET(重离子、快中子) 放射治疗学[M]. 北京:军事医学科学出版社,2006: 1-5.
[30] Hiraya R, Furusawa Y, Fukawa T, Ando K. Repair kinetics of DNA-DSB induced by X-rays or carbon ions under oxic and hypoxic conditions[J]. J Radiat Res, 2005, 46:325-332.
[31] Diehn M, Cho RW, Lobo NA, et al. Association of reactive oxygen species and radioresistance in cancer stem cells[J]. Nature, 2009, 458(7239): 780-783.
[32] Tobias C A, Lakely E A, Alpen E L, et al. Molecular and cellular radiobiology of heavy ions[J]. Int J Radiat Oncol Biol Phys, 1982, 8: 2109-2120.
Optimal beam for the next generation of heavy ion tumor therapy
NIE Jing1, LI He2,3, LI Bingyan1, PEI Hailong1, ZHOU Guangming1
1. School of Radiation Medicine and Protection, Soochow University, Collaborative Innovation Center of Radiation Medicine,Jiangsu Higher Education Institutions, Suzhou 215123
2. Department of Space Radiobiology, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000
3. University of Chinese Academy of Sciences, Beijing 100049
Heavy ions have been successfully used for tumor therapy and achieved outstanding clinical outcome due to its unique physical and biological characteristics. This paper compared the characteristics of carbon, nitrogen, oxygen, fluorine and neon beams both physically and biologically basing on published literatures and theoretical simulation. When we locate the Bragg peaks at 30 cm far from their entrance into water, oxygen ions induce less fragments and smaller lateral straggling. We take from granted that oxygen ions have lower oxygen enhancement ratio (OER) and stronger ability in killing cancer stem cells. Therefore, it is possible to apply for oxygen ions as next generation of heavy ion tumor radiotherapy.
heavy ion beam; tumor; radiotherapy; RBE; OER
Q691.5
A
10.11966/j.issn.2095-994X.2015.01.03.02
2015-07-01;
2015-07-24
国家自然科学基金(11335011,81372979,31370846)
聂晶,实验师,研究方向为重离子辐射生物学,电子信箱:jingnie@suda.edu.cn;周光明(通信作者),教授,研究方向为重离子辐射生物学,电子信箱:gmzhou@suda.edu.cn
引用格式:聂晶,李贺,李冰燕,等.新一代重离子束治癌的最佳束流选择[J].世界复合医学,2015,1(3):198-202

