A型肉毒毒素对增生性瘢痕中TGF-β1和cyclinD1基因表达影响的研究
武凤莲,朱东来,王嘉欣,汤云阳,王连英
A型肉毒毒素对增生性瘢痕中TGF-β1和cyclinD1基因表达影响的研究
武凤莲,朱东来,王嘉欣,汤云阳,王连英
(秦皇岛市第一医院烧伤整形外科河北秦皇岛066000)
目的:探讨A型肉毒毒素(BTXA)对增生性瘢痕组织成纤维细胞中TGF-β1和cyclinD1表达的影响.方法:组织块法培养增生性瘢痕组织及正常皮肤组织的成纤维细胞,用不同浓度的BTXA作用于体外培养的人增生性瘢痕成纤维细胞,检测MTT值;利用RT-PCR分析用药前后TGF-β1和cyclinD1mRNA表达的变化及其他们的相关性.结果:BTXA在体外能明显抑制增生性瘢痕成纤维细胞的增殖及TGF-β1和cyclinD1mRNA的表达.结论:BTXA对增生性瘢痕组织中成纤维细胞的增殖有明显抑制作用,其作用机制与BTXA能抑制TGF-β1和cyclinD1mRNA的表达有关;同时在抑制成纤维细胞的过程中,TGF-β1和cyclinD1mRNA的表达并无相关性.
A型肉毒毒素;增生性瘢痕;TGF-β1;cyclinD1
目前治疗增生性瘢痕的方法很多,包括压迫法、放疗法、激光与手术切除法、瘢痕内药物注射法等[1],但迄今没有哪一种方法可以完全达到令人满意的效果.而药物注射治疗病理性瘢痕因其操作简单,费用低廉及效果明显的特点而越来越易被患者接受,其中临床常用的有曲安奈德、5-氟尿嘧啶、复方倍他米松注射液等.近来有研究用A型肉毒毒素(BTXA)治疗瘢痕取得了较好的临床治疗效果[2-3].本研究通过对A型肉毒毒素注射治疗增生性瘢痕的成纤维细胞中的TGF-β1和cyclinD1基因表达的影响及其相关性,研究其注射治疗增生性瘢痕的原理,为治疗病理性瘢痕提供理论依据.
1 材料和方法
1.1材料
标本取自本科室瘢痕患者手术切下的增生性瘢痕组织及正常的皮肤组织,患者年龄14岁~45岁,平均年龄32岁;病程4个月~2年,患者3个月内均未经过免疫治疗,放射线治疗及激光治疗,取标本前均得到患者的知情同意.
1.2仪器与试剂
DMEM培养基(Gibco公司USA),BTXA(兰州生物制品研究所),Trizol总RNA提取试剂盒,Promega逆转录试剂盒,taq酶购于日本TAKARA;MTT、DMS0购于SIGMA USA,新生小牛血清,光学显微镜,PCR仪器. 1.3成纤维细胞培养
将手术切下的增生性瘢痕组织及正常的皮肤组织用含100U/ml青霉素和100μg/ml链霉素的PBS缓冲液反复冲洗三次后将其剪成1mmX1mm大小的小组织块,接种于含10%胎牛血清的DMEM培养液的培养方瓶中,在37.0℃,5%(体积分数)的C02、95%空气及饱和湿度的孵箱中静置培养,根据细胞的生长情况,每周更换两到三次培养液,待3周后原代细胞从组织块中长出并爬满培养瓶底后进行传代,采用0.25%胰蛋白酶及0.02%乙二胺四乙酸消化,按1∶4传代,药物实验所用细胞为4代.
1.4MTT比色法
将第四代对数生长期的成纤维细胞制成5X106悬浮液,以每孔100μl的成纤维细胞密度接种于96孔培养板中.置于孵箱中继续孵育24h.待细胞完全贴壁后去除培养液,分别加入含浓度(U/ml)0.1, 0.2,0.4,0.8,1.6 BTXA的10%小牛血清的DMEM 200μl,培养液每组设6个平行孔及空白对照孔,加药后放进孵箱中继续孵育48h.然后每孔加MTT(5mg/ ml)20μl继续孵育3h后,弃掉上清液,每孔加200μl DMS0振荡混匀,用自动酶联免疫分析仪在设定波长492nm时测定其0D值.计算药物的抑制率(IR):
IR=(1-实验组0D值/对照组0D值)X100%
1.5TGF-β1和cyclinD1mRNA表达的检测
将浓度为0.4U/ml的BTXA加入含有1X106个/ml第4代细胞的培养瓶中,放入孵箱中孵育48h,收集细胞.用TRizol试剂提取总RNA,反转录成cDNA.然后采用逆转录-聚合酶链式反应(reverse transcriptionpolymerase chain reation,RTPCR)进行扩增.RT-PCR反应体系为20μl,构成如下:10Xbuffer 2.5μl,dNTP 2μl,Taq酶2.5U,模板4μg,β-actin上下游引物及各特异性引物上下游各1μl,加水至总反应体积20μl.扩增条件: 94℃预变性5min,94℃变性30S,退火温度见下表, 72℃延伸1min,32个循环,最后72℃再延伸8min终止反应.引物设计见表1.
1.6PCR产物分析
取8μl PCR产物在1%琼脂糖凝胶电泳分析,用凝胶扫描成像分析仪处理系统扫描各条带紫外光吸收量(Vol).目的基因Vol值与相应内参βactin Vol值的比值代表每个样本PCR扩增产物mRNA的相对表达量,测定并比较增生性瘢痕与正常皮肤,以及加入肉毒毒素作用后增生性瘢痕TGF-β1及cyclinD1基因的表达的变化.
1.7统计学分析
2 结果
2.1显微镜下成纤维细胞形态变化
增生性瘢痕成纤维细胞原代培养,可见小组织块边缘有梭形的细胞爬出,逐渐布满培养瓶底部,培养液中加入不同浓度的BTXA孵育48h,镜下可见随着BTXA浓度的增加,成纤维细胞凋亡的数量越多(图1~4).
2.2观察BTXA对成纤维细胞增殖的影响
正常皮肤和增生性瘢痕成纤维细胞加入不同浓度的A型肉毒毒素,A型肉毒毒素作用于成纤维细胞48h后,用MTT法检测细胞增殖的变化.结果显示,同一观察时间,随着BTXA浓度的增大,其对成纤维细胞的抑制率显著增高,见表2.

表1 用primer5.0辅助设计引物
表2 不同浓度BTXA对两组细胞的抑制率(±s,n=6)

表2 不同浓度BTXA对两组细胞的抑制率(±s,n=6)
注:对照组与各浓度组比较P<0.001
BTXA浓度(U/ml)抑制率(%)正常皮肤增生性瘢痕0(对照)00 0.15.91±0.01857.94±0.0156 0.215.51±0.02518.93±0.0102 0.432.16±0.04645.35±0.0287 0.853.67±0.04250.05±0.0231 1.680.01±0.01283.48±0.0257

表3 各组细胞周期因子的表达
2.3各组成纤维细胞中TGF-β1及cyclinD1mRNA表达的测定
各组用RT-PCR电泳凝胶条带的Vol值与相对应的β-actin基因Vol值得比值作为各组样本TGF-β1及cyclinD1mRNA的相对表达量,增生性瘢痕组中成纤维细胞的TGF-β1及cyclinD1mRNA的表达量明显高于正常皮肤成纤维细胞组,其差异有统计学意义(P<0.01).增生性瘢痕组成纤维细胞加入浓度为0.4U/ml的BTXA的培养液培养48h,与未加药前比较,TGF-β1及cyclinD1的表达量明显下降,有显著性意义(P<0.01)(表3).各组样本PCR电泳结果表明增生性瘢痕成纤维细胞中的TGF-β1及cyclinD1基因的表达明显高于正常皮肤组;加药物处理组中的TGF-β1、cyclinD1基因表达明显低于未加药前的(图5、6).
3 讨论
增生性瘢痕是病理性瘢痕的一种,由于其具有增生及挛缩的特性,常会给患者造成器官的畸形及功能的障碍,增生瘢痕发生的原理、预防及治疗一直是整形外科的难题.增生性瘢痕的细胞成分主要包括成纤维细胞、成肌纤维细胞、巨噬细胞、中性粒细胞等[4].其中成纤维细胞在增生性瘢痕形成机制中发挥着关键的作用,在组织学上,增生性瘢痕主要是因成纤维细胞的过度增殖以及细胞外基质的过度沉积而形成的,细胞外基质的主要成分是大量的胶原纤维.在增生性瘢痕中成纤维细胞因为缺乏凋亡或者凋亡机制不能够进入正常的程序死亡[5]而导致其过度增殖,使细胞外基质过度聚集[6].同时其中的成肌纤维细胞具有成纤维细胞和平滑肌细胞的的特点和功能作用,在伤口瘢痕愈合的过程中也发挥着重要作用,其在增生性瘢痕形成时大量增生,并可与成纤维细胞之间互相转化及互相影响,在功能上,两者相互协调进行胶原蛋白、细胞外基质和胶原的合成,共同参与瘢痕的形成.在分子生物学上,增生性瘢痕的发生和发展是由多种细胞及细胞周期相关因子异常调控有关[7].转化生长因子TGF-β1在修复创面中扮演重要角色,可以促进成纤维细胞增殖和分泌细胞外基质,又可抑制其降解.同时TGF-β1能够诱导成纤维细胞转化为成肌细胞,同时又兼具促进成肌细胞异常聚集的特点[8-9]. TGF-β1是一种有很强趋化能力的因子,是巨噬细胞、中性粒细胞的有力刺激剂,经自分泌及旁分泌使TGF-β1的局部浓度升高,激活巨噬细胞,同时刺激幼稚细胞增殖,从而进一步促进成纤维细胞增殖及成肌细胞细胞数量的增加[10].有研究报道加入外源性的TGF-β1,其也可以增加创面中的胶原纤维、和炎性细胞的数量,促进瘢痕愈合[11].总之, TGF-β1在组织损伤的修复及组织再生的各个阶段中发挥着重要作用,包括炎性反应、细胞增殖及细胞外基质的沉积[12].CyclinD1基因位于染色体11q13,全长15kb,含5个外显子.CyclinD1是G1期细胞增殖信号的关键蛋白,在增生瘢痕中,其表达均明显高于正常皮肤的表达.CyclinD1蛋白与细胞周期蛋白依赖激酶CDK4/CDK6结合形成复合物,使Rb发生磷酸化而与E2F分离,释放的E2F发挥转录因子的效应,促进细胞G1/S期的转化,促进细胞增殖.而当CyclinD1或CDK4/CDK6表达失控时,超过了细胞限制点,就会导致细胞的增殖异常[13].有研究表明:细胞周期蛋白与细胞周期蛋白依赖性激酶可作为TGF-β1的负性调节的靶蛋白,经TGF-β1调解可以使CyclinD1及CDK4显著降低,使细胞增殖停滞在G1期.同时TGF-β1分泌的增加及作用,通过抑制CyclinD1蛋白的表达而抑制细胞进入S期,使细胞停滞在G1期[14].

图1 增生性瘢痕组织块周围可见成纤维细胞爬出

图2 细胞布满培养瓶底

图3 加入BTXA 0.2U 48h后成纤维细胞

图4 加入BTXA 1.6U 48h后成纤维细胞
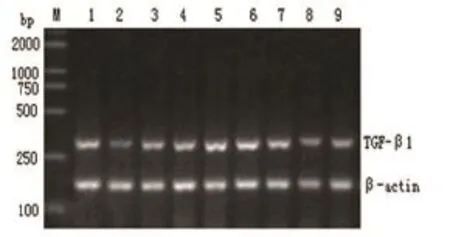
图5 TGF-β1与β-actin电泳

图6 cyclinD1与β-actin电泳
BTXA在当代已广泛应用于美容整形外科领域,由于其微创、安全、效果明显,不用住院,不影响求美者的正常工作及生活而备受青昧.目前主要用其治疗面部皱纹,如额纹、眉间纹、鼻间纹及鱼尾纹.有研究发现BTXA能够抑制前列腺增生,同时促使鼻黏膜细胞凋亡,为我们用BTXA注射治疗增生性瘢痕提供理论依据.近年来也有文献报道,BTXA治疗增生性瘢痕及瘢痕疙瘩取得了较理想的临床效果[15-16],其作用原理可能是抑制瘢痕内成纤维细胞的过度增殖及减少胶原纤维的沉积[3,17];同时还能够抑制成纤维细内的TGF-β1因子[18].本实验发现增生性瘢痕组与正常皮肤组成纤维细胞中的TGF-β 1及CyclinD1mRNA的表达相比较,增生性瘢痕组均高于正常皮肤组.由此推测TGF-β1及CyclinD1mRNA的异常表达是形成增生性瘢痕的重要因素;BTXA作用于增生性瘢痕及正常皮肤组的成纤维细胞后,通过MTT比色法证明BTXA能明显抑制体外的成纤维细胞生长(P<0.01),随着BTXA浓度的增加,对成纤维细胞增殖的抑制作用越明显.选择浓度为0.4μ/ml的BTXA做用于增生性成纤维细胞48h后,RT-PCR检测结果发现TGF-β1及CyclinD1mRNA的表达明显低于未用药的增生性瘢痕成纤维细胞(P<0.05).此实验结果提示BTXA治疗增生性瘢痕的机制可能通过抑制TGF-β1及CyclinD1mRNA的表达抑制细胞进入S期,是成纤维细胞停滞在G1期,从而导致成纤维细胞增殖受到抑制并减少细胞外基质的分泌聚集.然而,在本实验中,增生性瘢痕组中TGF-β1及CyclinD1mRNA的表达都明显升高,用药组的增生性瘢痕组中TGF-β1及CyclinD1mRNA的表达又明显降低,CyclinD1mRNA的表达并未受到TGF-β1的负向调控.说明BTXA在抑制增生性瘢痕成纤维细胞增殖的过程中TGF-β1及CyclinD1并无明显相关性.本实验虽在BTXA治疗及预防增生性瘢痕提供了实验基础,但对其具体机制尚需大量实验研究理论支持,以及对其他参与细胞周期调控因子的影响也有待于进一步的实验研究.
[1]蔡景龙.瘢痕的治疗方法评价及展望[J].中华医学杂志, 2013,93(14):1041-1043.
[2]颜彤彤,陈敏亮,马奎,等.A型肉毒毒素治疗挛缩性瘢痕[J].中华医学美学美容杂志,2013.19(13):196-199.
[3]于波,陈敏亮,刘文阁,等.A型肉毒毒素预防和治疗增生性瘢痕的临床初探[J].中华医学美学美容杂志,2008,14(2): 98-100.
[4]汪良能,高学书.整形外科[M].北京:人民卫生出版社,1996: 318-324.
[5]Igarashi A.Regulation of connective tissue growth factor gene expression in human skin fibroblast and during woung repair[J].Mol Biol Sci,1993,4:637-681.
[6]吴包金,吴建明,林子豪,等.增生性瘢痕退行性变过程中的细胞凋亡和相关基因表达[J].中华烧伤杂志,2006,22(6): 469-470.
[7]张娟娟,吕世军.病理性瘢痕发病机制研究进展[J].医学综述,2007,13(8):580-582.
[8]Thorey IS,Hinz B,Hoeflich A,et al.Trasgenic mice revcal novelactivitiesofgrowthhormoneinwoundrepair, angiogenesisandmyofibroblastdifferentiation[J].JBiol Chem,2004,279(25):26674-26684.
[9]Spyrou GE,Naylor IL.The effect of basic fibroblasts growth factor on scarring[J].Br J Plast Surg,2002,55(4):275-282.
[10]Brandes ME,Mai UE,Ohura K,et al,Type I transforming growthfacror-βreceptorsonneutrophilsmediate chemotaxis to transforming growth factor-β[J].J Immunol, 1991,147(5):1600-1606.
[11]Campaner AB,Ferreira LM.Gragnani A,et al.Upregulation of TGF-betal expression may be necessary but is not sufficient for excessive scarfing[J].J Invest Dermatol,2006, 126(5):1168-1176.
[12]Bottinger EP,Bitzerm.TGF-β1 signaling in renal disease[J]. JAm Soc Nephrol,2002,13(3):2600-2610.
[13]LangeC,HuttnerWB,CalegariF.Cdk4/CyclinD1 Overexpression in Neural Stem Cells Shortens G1,Delays Neurogenesis,andPromotestheGenerationand Expansiong of Basal Progenitors[J].Cell Stem Cell,2009,5 (3):320-331.
[14]余芳,张端莲,陕声国,等.人皮肤血管瘤组织中TGF-β1、CyclinD1的表达及相关性分析[J].武汉大学学报,2005,26 (3):280-285.
[15]ZhiboX,MiaoboZ.Potentialtherapeuticeffectsof botulinum toxin type A in keloid management[J].Med Hypotheses,2008:71(4):623-625.
[16]Uyesugi B,Lippincott B,Dave S.Treatment of a painful keloid with botulinum toix type A[J].Am J Phya Med Rehabil,2010:89(2):153-155.
[17]Xiao Z,Qu G.Effects of botulinum toxin type on collagen deposition in hypertrophic scars[J].Molecules,2012,17(2): 2169-2170.
[18]Xiao Z,Zhang M,Liu Y,et al.Botulinum toxin type A inhibits connevtive tissue growth factor expressiong in fibroblasts derived from hypertrophic scar[J].Aesther Plast Surg,2011,35(5):802-807.
编辑/张惠娟
Study on BTXA on the expression of TGF-β1 and cyclinD1 in hypertrophic scar
WU Feng-lian,ZHU Dong-lai,WANG Jia-xin,TANG Yun-yang,WANG Lian-ying
(Department of Burn and Plastic Surgery,The First Hospital of Qinhuangdao,Qinhuangdao 066000, Hebei,China)
Objective To investigate the effect of botulinum toxin A(BTXA)on the expression of TGF-β 1 and cyclinD1 of hypertrophic scar fibroblast.Methods After treated with different concertrations of BTXA,inhibition rate.The expression and correlation of TGF-β1 of cyclinD1of hypertrophic scar fibroblasts were detected by MTT assay and RT-PCR respectively.Results BTXA can significantly inhibit the proliferation of hypertrophic scar fibroblast,and the expression of TGF-β1 and cyclinD1could be inhibited significantly.ConclusionThe mechanism of BTXA on inhibiting fibroblast of hypertrophic scar may be related with regulation of the expression of TGF-β1 of cyclinD1,and there was no correlation between the expression of TGF-1 and cyclinD1mRNA on inhibiting fibroblast of hypertrophic scar.
botulinum toxin A(BTXA);hypertrophic scar;TGF-β1;cyclinD1
R619+.6
A
1008-6455(2015)06-0037-05
王连英,主任医师,河北省秦皇岛市,秦皇岛市第一医院烧伤整形外科,066000
2014-12-21
2015-03-04

