慢病毒介导脯氨酰寡肽酶过表达抑制硫代乙酰胺诱导的大鼠肝纤维化*
王 晶,周 达,丁永年,彭媛媛,何岭楠,陈源文,范建高
肝纤维化是各种慢性肝病肝损伤发展为肝硬化的必经病理学过程[1],主要表现为大量细胞外基质(ECM)过度沉积。病因治疗是防治慢性肝损伤的根本措施,但不少慢性肝病目前还缺乏有效的防治手段[2~4],抑制肝纤维化进展是阻断慢性肝病不良结局的关键[5,6]。脯氨酰寡肽酶(Prolyl oligopeptidase,POP)是由约 700个氨基酸残基组成的蛋白[7],具有酶和非酶双重功能,体内分布广泛。在大鼠、小鼠与人类之间的同源性极高[8]。POP在肝内有较高的活性,存在于肝细胞和肝内Kupffer细胞内,其水平升高参与促进出生后肝脏成熟、肝切除后肝再生等生理过程,同时它是抗肝纤维化内源性小分子肽N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸生成的关键酶[9,10]。目前,对于POP是否直接参与肝纤维化调控尚未见研究报道。由此,本实验采用慢病毒过表达技术过表达POP,通过门静脉注射慢病毒入肝脏,对硫代乙酰胺诱导的大鼠肝纤维化模型进行干预,初步探究POP对大鼠肝纤维化的影响,为进一步以POP为靶点的抗肝纤维化治疗提供实验依据。
1 材料与方法
1.1 动物与试剂 SPF级健康SD雄性大鼠,体质量180~200g,由上海普希尔-必凯实验生物公司提供。Realtime-PCR引物由上海生工生物工程股份有限公司合成;Trizol、逆转录PCR试剂盒、real-timePCR试剂盒均购自Takara公司;慢病毒过表达载体购自上海吉凯基因化学技术有限公司;HRP标记的羊抗兔Ig G、HRP标记的羊抗小鼠Ig G购自江苏碧云天生物技术研究所;抗POP购自Sigma公司;酸水解法检测羟脯氨酸(Hyp)试剂盒购自南京建成生物工程研究所。
1.2 慢病毒过表达载体的制备 根据GenBank提供的大鼠POP基因序列 NM_031324,筛选和构建慢病毒POP过表达载体,通过测序验证,证实构建成功。经酶切、电泳及Western Blot检测验证,证实POP慢病毒过表达载体过表达成功后,进行慢病毒大规模包装和滴定。
1.3 动物模型制备 取40只大鼠适应性饲养1 w后,随机分为正常对照组、硫代乙酰胺(TAA)模型组、TAA模型+空病毒组、TAA模型+POP慢病毒过表达载体组。对正常对照组(n=10)动物,经腹腔注射生理盐水20mg/100g体质量,2次/w;模型组(n=10)、空病毒组(n=10)、POP组(n=10)均给予 5%TAA(溶剂为生理盐水)20 mg·kg-1体质量腹腔注射,2次/w,注射1 w,制备肝纤维化模型。造模1 w末,在POP组动物,给予5×107TU POP慢病毒过表达载体/只门静脉注射,空病毒组经门静脉注射5×107TU空病毒栽体/只,正常对照组和模型组经门静脉注射等体积生理盐水100μl,共治疗3 w。在治疗结束时(距造模4 w末),正常对照组和POP组各死亡1只大鼠,其余大鼠以2%戊巴比妥钠8mg.kg-1腹腔注射麻醉,经下腔静脉取血10~15ml,分离血清,放置于-80℃冰箱保存备检。取出完整肝脏,取1cm×1cm×1cm大小肝组织,放入4%多聚甲醛溶液中固定,石蜡包埋,制备 4μm切片,行 HE、Masson染色,在光镜下观察;其余肝组织经生理盐水冲洗后剪成组织块,放入冻存管中,储存于-80℃冰箱备用。肝纤维化病理形态学分级参照《病毒性肝炎防治方案》[11],肝组织胶原沉积情况的半定量评分参照2002年肝纤维化疗效诊断及评估共识[12]。
1.4 肝组织 POP mRNA检测 采用实时荧光定量PCR法,按照 Trizol试剂说明提取肝组织总 RNA,用TaKaRa逆转录酶进行逆转录合成cDNA。POP上、下游引物序列分别为5′-AGTGCCGTTTCTTGAGCAGT-3′和 5′-CGTCATCCGACAGAGTGTTG-3′;GAPDH 上、下游引物序列分别为5′-ACAGCAACAGGGTGGTGGAC-3′和 5′-TTTGAGGGTGCAGCGAACTT-3′。反应体系20μl,设立2个复孔,按两步法扩增,预变性:95℃ 30s;PCR 反应:95℃ 5s,60℃ 30s,循环 40 次。反应结束后确认扩增曲线和溶解曲线,以GAPDH为内参,计算目的基因POP mRNA的相对水平,用2-ΔΔCT表示。
1.5 肝组织POP蛋白表达的检测 采用Western blot法,取肝组织30~40mg。用RIPA蛋白裂解液裂解、匀浆,12000 r/m离心10 min,取蛋白上清分装于1.5 ml离心管中,采用BCA法测定蛋白浓度。取总蛋白150μg,行12%SDS-PAGE电泳,经PVDF膜转移,加一抗,4℃中孵育过夜,再与HRP偶联二抗室温中孵育1 h,以增强化学发光法显色系统进行显色。采用Image Lab软件对Westem blot检测结果进行灰度分析,灰度值代表蛋白相对表达量。
1.6 统计学处理 应用SAS8.0统计软件,计量资料以()表示。羟脯氨酸含量、POP蛋白灰度值采用单因素方差分析,组间差异采用LSD法进行比较;对方差不齐资料(POP的mRNA相对表达量),采用Kruskal-Wallis H检验,等级资料(大鼠的病理分级)采用非参数秩和检验。P<0.05时认为差异有统计学意义。
2 结果
2.1 大鼠肝组织病理学改变 正常对照组大鼠肝组织肝小叶结构完整,无炎性细胞浸润,未见明显纤维化;模型组和空病毒组肝脏内炎性细胞浸润,小叶结构紊乱,纤维组织增生,纤维化以II期为主;POP干预组肝小叶结构尚完整,肝纤维化以1期为主,各组纤维化分期差异有统计学意义(P<0.05,表1)。Masson染色显示,正常对照组仅在汇管区或血管周围见少量蓝色阳性沉着;模型组和空病毒组可见除血管和胆管周围着色外,有蓝色胶原纤维从汇管区和中央静脉管壁向肝实质细胞延伸,形成不完全纤维间隔;POP组较模型组纤维沉积程度减轻,纤维间隔短而少(图1)。对各组进行纤维化半定量评分,结果模型组评分(15.2±1.69)明显高于正常组[(1.75±0.63),P<0.05)],POP组(7.75±2.71) 显著低于空病毒组[(15.3±4.62),P<0.05]。
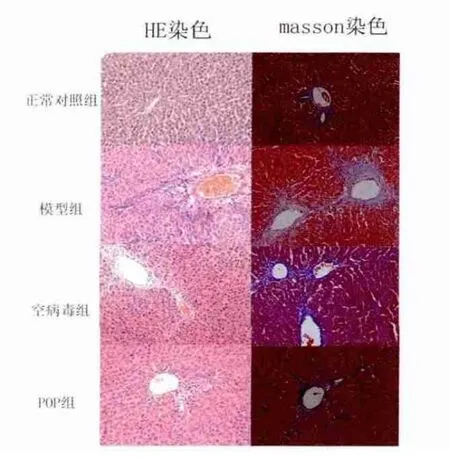
图1 各组大鼠肝组织病理学表现(HE和Masson,200×)
2.2 肝组织羟脯氨酸含量比较 与正常对照组羟脯氨酸水平 [(298.20±47.47)μg/g肝质量]相比,模型组[(504.47±111.15)μg/g 肝质量]和空病毒组[(498.32±90.87)μg/g肝质量]均显著升高,差异具有显著性统计学意义(P<0.05);POP组羟脯氨酸水平为 [(383.52±43.49)μg/g肝质量],显著低于模型组和空病毒组,差异有统计学意义(P<0.05,图 2)。
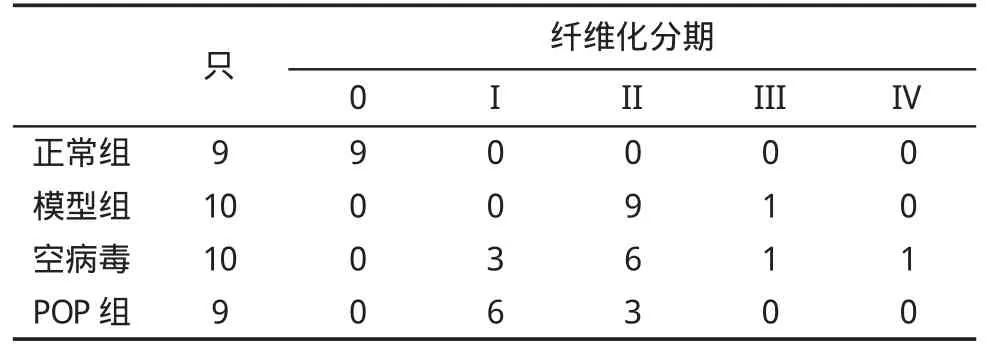
表1 各组大鼠肝纤维化病理学分期
2.3 肝组织POP mRNA和蛋白水平变化 POP组大鼠肝组织POP mRNA水平为正常对照组、模型组和空病毒组的2~5倍(P<0.01),且模型组较正常对照组POP mRNA水平稍有降低(P<0.05);慢病毒介导的POP过表达组大鼠肝组织POP相对表达量明显高于正常对照组、模型组和空病毒组水平,差异有统计学意义(P<0.01),模型组较正常对照组POP蛋白表达也有降低(P<0.05,图 3)。
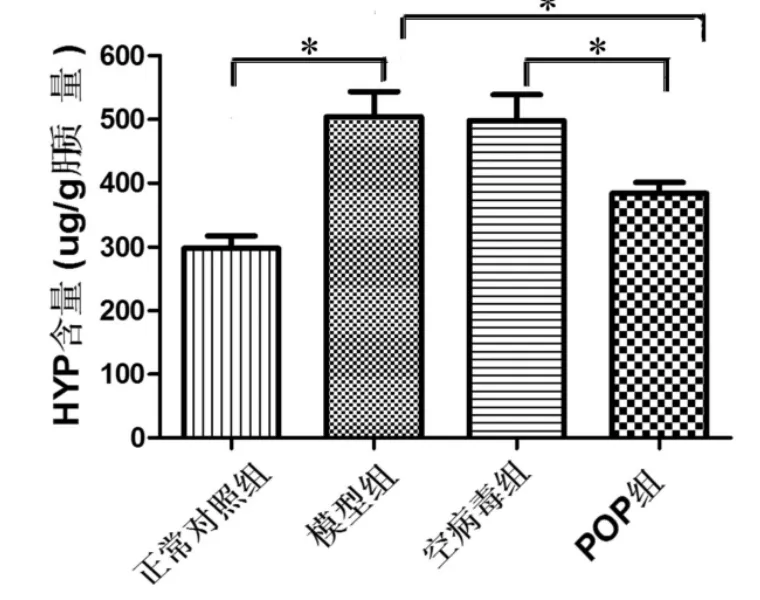
图2 各组肝组织羟脯氨酸含量比较 按肝组织湿重对羟脯氨酸含量进行标化,*:P<0.05
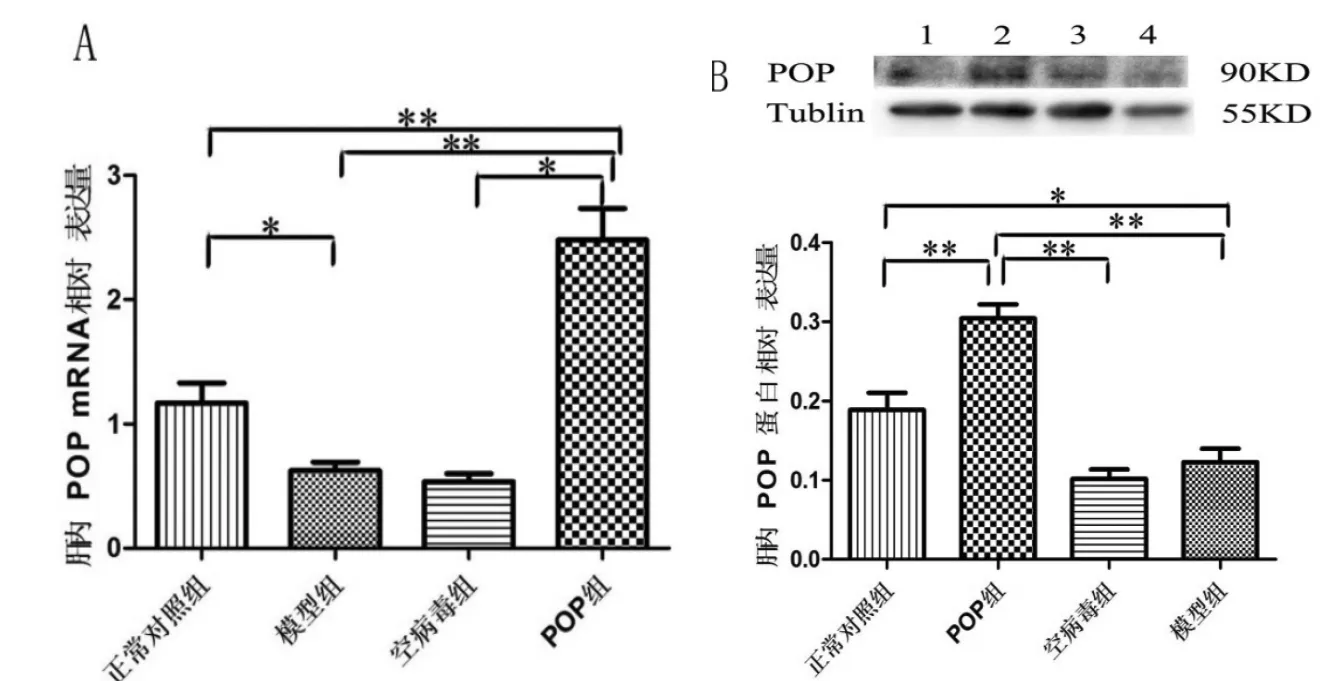
图3 各组肝组织POP mRNA和蛋白表达情况
4 讨论
本研究结果显示,TAA诱导的大鼠肝纤维化时肝内POP水平下调,而携POP基因慢病毒能成功在大鼠肝组织中显著提高POP蛋白水平;上调POP水平能抑制TAA诱导的大鼠肝内炎症,减轻肝内纤维组织沉积,降低肝内羟脯氨酸,提示POP过表达阻抑了大鼠纤维化的发展。
慢性肝损伤时肝脏病理性修复,其重要特征是细胞外基质过度沉积和肝细胞增殖不良,导致肝纤维化和肝硬化[13]。虽然病因治疗是防治慢性肝损伤的根本措施[14],但不少慢性嗜肝病毒感染及非感染性慢性肝病目前还缺乏有效防治手段[15,16],一些慢性肝病即使病因得以控制,但慢性肝损伤仍然不断进展[16],因此,认识慢性肝损伤后肝脏修复的机制和细胞外基质转换失衡的原因,仍是目前肝纤维化和肝硬化防治的重要研究方向。
POP是一种存在于肝脏内的丝氨酸蛋白酶,能专一水解肽链羧基端的脯氨酰键,但底物必须为小于30氨基酸残基的小分子多肽和胺类等小分子物质[17,18]。POP在肝内的生理功能目前认识有限,早年研究发现,在肝脏,POP较均衡地分布于肝细胞和库普弗细胞的胞质和胞核内,而肝细胞与库普弗细胞均是肝损伤修复的关键细胞[19]。已有研究发现,在小鼠部分肝切除后,肝内源性POP活性在术后2天达到最大,术后9天逐渐降至正常组水平,这种活性变化与肝再生水平相关;而抑制POP活性水平后,肝细胞增殖被显著抑制[20]。与此相似,另有二项研究发现POP促进肝脏的生理性发育。研究发现,新生小鼠肝脏内POP活性逐渐升高并在出生第8天出现峰值,而且这种活性变化与新生小鼠肝脏内肝细胞增殖和分化水平相平行[21,22]。以上研究结果均提示POP在调控肝内微环境、促进肝细胞增殖与分化中起关键作用,POP可能是调控肝损伤后肝组织生理性修复的关键蛋白,在肝脏病理性修复中发挥重要作用[23]。
支持这一推测的最早研究结果是发现慢性肝损伤肝纤维化过程中存在POP水平下调的情况,这提示可能POP直接或间接(通过下调N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸)参与肝纤维化的发生,然而这些研究未能提供直接实验依据证实这一推测。在本研究中也观察到POP水平在TAA诱导的大鼠肝纤维化阶段有显著下调,并进一步通过慢病毒介导成功实现在肝组织中过表达POP蛋白,通过提高POP蛋白水平,观察提高POP水平后对TAA诱导的大鼠肝纤维化的直接影响。研究发现过表达POP蛋白后,大鼠肝脏炎症、肝纤维化分级、肝内羟脯氨酸含量等均较模型组显著改善,提示POP能直接抑制慢性肝损伤后肝纤维化的发生与发展。
POP抑制TAA诱导肝纤维化的机制本研究并未能明确。我们推测这一作用可能与促进肝细胞增殖、炎症抑制和调控细胞外基质沉积均相关。如前所述,POP是肝损伤后肝细胞增殖的重要促进蛋白,提高肝内POP水平可能有助于肝细胞增殖与分化。此外,肝内巨噬细胞、库普弗细胞是肝纤维化时肝内炎症和肝细胞增殖的重要介导细胞,有研究发现,肝内巨噬细胞内NF-κB激活是肝细胞增殖的启动因子[24],而POP大量表达于肝内巨噬细胞胞质与胞核内[25],还与增殖中的肝细胞内NF-κB活性密切相关,且可通过N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸抑制炎性反应,通过调控胸腺素β4影响肝内细胞增殖和巨噬细胞胞吞、趋化、分泌等[26]。在慢性肝损伤过程中,除POP蛋白表达下调外,还可能存在POP功能的抑制,例如炎性反应时局部浸润的炎性细胞可通过分泌蛋白酶抑制剂等直接抑制POP功能[27]。以上研究说明,POP可通过影响肝内巨噬细胞功能、NF-κB活性、胸腺素β4与N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸水平等,主导肝损伤修复微环境的调控,其自身亦受炎性活动的负反馈调控。上调POP水平,可能有助于促进肝细胞增殖、抑制巨噬细胞功能和过度炎症反应、调控N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸水平影响炎症与肝星状细胞功能等。具体作用机制有待进一步研究加以证实。
肝纤维化不但病因复杂,其发生机制也亟待明确。本研究证实过表达POP能抑制TAA诱导大鼠肝纤维化后,需要进一步的研究来明确其作用机制、方式与靶细胞等一系列问题,以及其在其它病因介导的肝纤维化中的可能作用。通过完成这一系列后续研究,有望进一步了解肝纤维化的机制,为其防治提供理论基础。
[1]Wells RG.Liver fibrosis:challenges of the new era.Gastroenterology,2009,136:387-388.
[2]Friedman S L.Evolving challenges in hepatic fibrosis.Nat Rev Gastroenterol Hepatol,2010,7(8):425-436.
[3]Thompson A J,Patel K.Antifibrotic therapies:will we ever get there.Curr Gastroenterol Rep,2010,12(1):23-29.
[4]Kim K H,Kim N D,Seong B L.Discovery and development of anti-HBV agents and their resistance.Molecules,2010,15(9):5878-5908.
[5]Mason A L,Zhang G.Linking human beta retrovirus infection with primary biliary cirrhosis.Gastroenterol Clin Biol,2010,34(6-7):359-366.
[6]Schuppan D,Gorrell M D,Klein T,et al.The challenge of developing novel pharmacological therapies for non-alcoholic steatohepatitis.Liver Int,2010,30(6):795-808.
[7]D'agostino G,Kim J D,Liu Z W,et al.Prolyl endopeptidasedeficient mice have reduced synaptic spine density in the CA1 region of the hippocampus,impaired LTP,and spatial learning and memory.Cereb Cortex,2013,23(8):2007-2014.
[8]Goossens F,De Meester I,Vanhoof G,et al.Distribution of prolyl oligopeptidase in human peripheral tissues and body fluids.Eur J Clin Chem Clin Biochem,1996,34(1):17-22.
[9]Chen Y W,Liu B W,Zhang Y J,et al.Preservation of basal AcSDKP attenuates carbon tetrachloride-induced fibrosis in the rat liver.J Hepatol,2010,53(3):528-536.
[10]Suzuki Y,Katagiri F,Sato F,et al.Significant decrease in plasma N-acetyl-seryl-aspartyl-lysyl-proline level in patients with end stage renal disease after kidney transplantation.Biol Pharm Bull,2014,37(6):1075-1079.
[11]中华医学会传染病与寄生虫病学分会、肝病学分会联合修订.病毒性肝炎防治方案.中华内科杂志,2001,40(1):62-688.
[12]中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识.中华肝脏病杂志,2002,10:327-328.
[13]Friedman S L.Liver fibrosis-from bench to bedside.J Hepatol,2003,38 Suppl 1:S38-53.
[14]Thompson AJ,Patel K.Antifibrotic therapies:will we ever get there Curr Gastroenterol Rep,2010,12(1):23-29.
[15]Schuppan D,Gorrell MD,Klein T,et al.The challenge of developing novel pharmacological therapies for non-alcoholic steatohepatitis.Liver Int,2010,30(6):795-808.
[16]Miranda-Mendez A,Lugo-Baruqui A,Armendariz-Borunda J.Molecular basis and current treatment for alcoholic liver disease.Int J Environ Res Public Health,2010,7(5):1872-1888.
[17]Matsubara S,Takahashi T,Kimura A P.Localization and subcellular distribution of prolyl oligopeptidase in the mouse placenta.J Mol Histol,2011,42(3):251-264.
[18]Matsuda T,Sakaguchi M,Tanaka S,et al.Prolyl oligopeptidase is a glyceraldehyde-3-phosphate dehydrogenase-binding protein that regulates genotoxic stress-induced cell death.Int J Biochem Cell Biol,2013,45(4):850-857.
[19]Wynn T A,Barron L.Macrophages:master regulators of inflammation and fibrosis.Semin Liver Dis,2010,30(3):245-257.
[20]Yamakawa N,Shimeno H,Soeda S,et al. Regulation of prolyl oligopeptidase activity in regenerating rat liver.Biochim Biophys Acta,1994,1199(3):279-284.
[21]Matsubara Y,Ono T,Tsubuki S,et al.Transient up-regulation of a prolyl endopeptidase activity in the microsomal fraction of rat liver during postnatal development.Eur J Biochem,1998,252(1):178-183.
[22]Agirregoitia N,Casis L,Gil J,et al.Ontogeny of prolyl endopeptidase and pyroglutamyl peptidase I in rat tissues.Regul Pept,2007,139(1-3):52-58.
[23]Myohanen T T,Venalainen J I,Garcia-Horsman J A,et al.Distribution of prolyl oligopeptidase in the mouse whole-body sections and peripheral tissues.Histochem Cell Biol,2008,130(5):993-1003.
[24]Yang L,Magness ST,Bataller R,et al.NF-kappaB activation in Kupffer cells after partial hepatectomy.Am J Physiol Gastrointest Liver Physiol,2005,289(3):G530-538.
[25]Myohanen TT,Venalainen JI,Garcia-Horsman JA,et al.Distribution of prolyl oligopeptidase in the mouse whole-body sections and peripheral tissues.Histochem Cell Biol,2008,130(5):993-1003.
[26]Rath NC,Kannan L,Liyanage R,et al.Thymosin beta in macrophage.J Endocrinol Reprod,2007,11(2):55-61.
[27]Barrett AJ,Rawlings ND.Oligopeptidases,and the emergence of the prolyl oligopeptidase family.Biol Chem Hoppe Seyler,1992,373(7):353-360.

