Na2CO3、NaHCO3与盐酸反应实验的改进
章建锋+乔丽敏
摘要:针对中学教材中“Na2CO3、NaHCO3与盐酸反应实验”的不足,进行了多种方案的实验改进。分别介绍了“水中实验”、“泡沫实验”、“注射器替代气球”和“石灰水替代气球”四则实验改进方案。这些实验方案具有简约性、趣味性和科学性,能明显提高实验效果。
关键词:Na2CO3;NaHCO3;盐酸;教材方案;实验改进
文章编号:1005–6629(2015)6–0053–03 中图分类号:G633.8 文献标识码:B
Na2CO3与NaHCO3是两种常见的重要钠盐,其中关于Na2CO3、NaHCO3与盐酸反应的对比实验,不同教材实验设置不同。人教版化学必修1中关于该知识点设置了一组演示实验[1]:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g Na2CO3或NaHCO3粉末的小气球分别套在两支试管口,将气球内的Na2CO3和NaHCO3同时倒入试管中,观察反应现象(图1“人教版”方案)。而苏教版化学必修1中关于该知识点设置成探究实验,教材只给出了结论而未给出实验方案,但是教材在介绍Na2CO3与盐酸反应的性质时,给出了实验方案的装置图[2](图1“苏教版”装置图):将胶头滴管中的浓盐酸加入广口瓶中,观察实验现象。因为在教学过程中学生立刻会讨论出方案,可以使用“苏教版”方案让同浓度盐酸同时与等量的Na2CO3和NaHCO3固体或与二者同浓度等体积的溶液反应,对比二者气球变大的情况来进行验证。然而在实验中,出现了一些问题,如:装置的气密性无从验证;两者与盐酸反应都很快,很难通过实验来比较“剧烈程度”;使用小气球膨胀差异的比较虽然有时有一定效果,但是也有学生提出“碳酸钠气球”是否会存在漏气等质疑。针对诸如此类问题,笔者对该实验进行了改进和探讨。
1 “人教版”方案改进
在实验仪器方面,“人教版”方案相对“苏教版”方案要简单一些,两者都具备实验的趣味性,但也存在装置气密性无法检验和实验过程中的漏气问题,实验不够严谨,缺乏可信度。
1.1 “水中实验”方案
笔者在实验准备室里挑选不同口径气球多次进行该实验,发现气球口径稍大则气密性不好,气球太小药品不易装入,相应口径太小也不易套住试管,因此教学演示前需要挑选合适口径的气球。在教学过程中,为了增强实验的可信度,笔者将“人教版”方案实验的环境进行了改进,让其反应过程中的气密性检验在水中进行,即将套在试管上的气球口浸没在盛水的大烧杯中进行实验,为了不让试管上浮,用试管夹夹住气球与试管重叠的部分(图2)。由于笔者事先经过多次挑选,所以在教学演示时能很好地排除“碳酸钠气球”比“碳酸氢钠气球小”不是由于漏气原因所致。
1.2 “泡沫实验”方案
由于Na2CO3、NaHCO3与盐酸反应都很快,不易比较两者的“剧烈程度”,是否可借助其他介质来“放大”实验的现象呢?经反复试验后笔者设计了如下实验:分别将0.3g Na2CO3或NaHCO3粉末置于两支试管中,各加入5mL水溶解,再分别滴入1滴洗洁精,振荡,待泡沫几乎消失后,用两支同型号胶头滴管吸取6 mol/L的盐酸各1滴管,同时滴入两支试管中,观察到Na2CO3溶液中的泡沫上升至试管中上部,而NaHCO3溶液中的泡沫快速冲至试管口甚至溢出,效果如图3所示。该实验操作简单,现象明显且具有较强的趣味性。
2 “苏教版”方案改进
“苏教版”方案展示的装置同样存在气密性无法检验和实验过程中漏气几率较大的问题。漏气原因可能是由于瓶内压强迅速增大,导致胶头滴管的胶头与玻璃管接合处或者是气球与玻璃导管的接合处漏气。
2.1 “注射器替代气球”方案
曾有同行使用了葡萄糖口服液瓶(10mL,带能倒扣的胶塞)的“单注射器”方案[3](图4):瓶中放入0.1g Na2CO3或NaHCO3粉末,用注射器吸入2mL 0.5 mol/L稀盐酸,同时注入瓶中,观察注射器活塞上升的快慢进行判断。该实验方案有药品使用量少,气密性容易检验等优点。笔者尝试该实验方案,发现在将注射器中的盐酸部分注入瓶中时,立刻产生气体,瓶内气压迅速增大,注射器中剩余盐酸注入稍有困难但仍能完成注入,由于“自带胶塞”厚度不大,瓶内压强迅速增大易将胶塞顶起而出现漏气。为了解决这一问题,笔者尝试使用了“双注射器”方案(图4):将该瓶自带胶塞改成实验室专用的厚胶塞,为了防止Na2CO3粉末遇水结块,将0.1g Na2CO3或NaHCO3粉末装入瓶中后,各加入3mL水溶解,为了缩短盐酸的注射时间,使用小量程注射器(5mL)均吸入0.5mL 2 mol/L稀盐酸,同时将稀盐酸注入瓶中后继续抵住活塞,通过同时观察另一注射器活塞向上移动的快慢进行判断。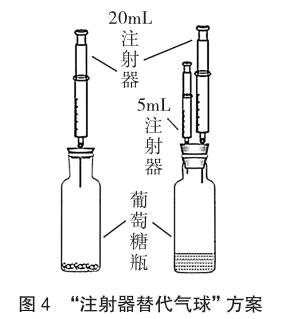
2.2 “石灰水替代气球”方案
笔者通过对“人教版”方案改进成敞口“泡沫实验”方案的过程中,联想到另一种改进方法,如图5所示,将0.1g Na2CO3或NaHCO3粉末装入葡萄糖瓶(10mL)中后,各加入3mL水溶解,使用小量程注射器(5mL)均吸入2mL 0.5 mol/L稀盐酸,试管中盛装6mL澄清石灰水,同时将稀盐酸注入瓶中后,对比同时间内澄清石灰水的浑浊程度来进行判断。
3 实验改进的注意事项
3.1 “固液”反应与“液液”反应
从药品的加入方式上看,“人教版”方案是Na2CO3、NaHCO3粉末“加入”酸(3mL稀盐酸)中,“苏教版”方案是酸(1滴管浓盐酸)“加入”Na2CO3、NaHCO3溶液中。笔者曾在使用“苏教版”方案时尝试改用酸“加入”Na2CO3、NaHCO3粉末中,但是由于Na2CO3粉末遇水容易结块,虽然其溶解度大于NaHCO3,但是其溶解过程没有NaHCO3那样“干脆”,因此将一滴管(1mL左右)盐酸加入Na2CO3粉末中后,部分Na2CO3粉末遇水结块(这一点在做二者溶解实验时也有体现),减小了Na2CO3粉末与盐酸反应的速率,更何况少量盐酸并不能与粉末充分接触,因此等到“实验结束”再去晃动Na2CO3反应的试剂瓶时,又有气泡产生,故设计成溶液间的反应更加适宜。基于这一点,在探究Na2CO3性质时,“苏教版”方案使用了“液液”反应,笔者在实验改进过程中也注意到了这种情况。
3.2 注意盐酸的浓度
在“人教版”方案和“苏教版”方案实验中,由于存在漏气的可能,因此不宜使用浓盐酸,特别是NaHCO3与浓盐酸反应速率很快,该气球容易漏气,因此笔者在使用“水中实验”时采用了1 mol/L稀盐酸。同样为了减小反应的速率,“注射器替代气球”方案、“石灰水替代气球”方案均适当减小稀盐酸的浓度,但是“泡沫实验”方案中,若使用1滴管稀盐酸则泡沫产生不多,使用浓盐酸则二者泡沫均快速产生,因此经过多次实验后“折中”选择了6 mol/L的盐酸进行实验为宜。
化学实验是检验化学理论知识的重要依据,教学过程中不但要求化学实验设置具有趣味性、简约性,更需注意实验的科学性、严谨性,这样才能让学生体会到实际情况与化学理论知识相符,增强可信度。
以上四则实验改进方案是在教材的基础上加以改变,其中不同程度体现了实验的简约性、趣味性、可信性。当然要达到更好的效果,实验药品的用量需要教师通过多次实验尝试来确定。
参考文献:
[1]人民教育出版社化学室.化学必修第一册[M].北京:人民教育出版社,2003:32.
[2]王祖浩主编.普通高中课程标准实验教科书·化学1[M].南京:江苏教育出版社,2010:51~52.
[3]万立新,李凤桃. Na2CO3、NaHCO3与稀盐酸反应实验的改进[J].中小学实验与装备,2006,(1):34.

