磁分散固相微萃取
张咏+陈蕾+黄晓佳+袁东星

摘 要 以甲基丙烯酸为功能单体,乙二醇二甲基丙烯酸酯为交联剂对Fe3O4纳米粒子进行改性,利用红外光谱、元素分析和透射电镜对改性粒子(Fe3O4@MAED)进行表征。同时将Fe3O4@MAED用于萃取环境水样和果汁中苯甲酰脲类杀虫剂,详细考察了磁性粒子用量、解析溶剂、吸附和解析时间、pH值、离子强度等因素对萃取性能的影响。在此基础上,与高效液相色谱/二极管阵列检测器联用,建立了环境水样和果汁中苯甲酰脲类杀虫剂的快速、简便、灵敏的测定方法。在最佳实验条件下,本方法具有较宽的线性范围、良好的线性相关系数(R2>0.99)和理想的灵敏度。对于水样和果汁样品,该杀虫剂的检测限分别在0.10~0.19 μg/L和0.12~0.30 μg/L之间,日内相对标准偏差小于7%,日间相对标准偏差小于11%。在实际环境水和果汁样品中,不同加标浓度苯甲酰脲的回收率在69.4%~118%之间。研究表明,所制备的Fe3O4@MAED可通过疏水、氢键、离子交换等多重作用力实现对目标物的有效萃取。
关键词 磁分散固相微萃取; 高效液相色谱; 苯甲酰脲杀虫剂; 富集
1 引 言
发展于20世纪70年代的苯甲酰脲类杀虫剂(Benzoylurea pesticides, BUs)是一种高效的昆虫生长调节剂,可抑制昆虫表皮几丁质的生物合成,从而阻止昆虫蜕皮,使昆虫不能正常生长发育而死亡[1]。目前,BUs在粮食、蔬菜、水果种植领域广泛应用,但已有研究表明,残留的BUs对人体具有潜在毒性效应[2,3]。因此,建立灵敏、有效、简便的BUs监测方法具有重要的现实意义。迄今为止,高效液相色谱(HPLC)结合其它高灵敏检测手段(如质谱(MS)、串联质谱(MS/MS)和紫外检测器(UV))是分析BUs的常用方法。但鉴于实际样品基底的复杂性和目标化合物的低浓度,在进行色谱分析检测前需进行必要的样品前处理,以去除基底的干扰,实现对目标化合物的富集。
用于测定BUs的样品前处理方法主要包括液液萃取(LLE)[4]、分散液液微萃取(DLLME)[5-6]、单滴微萃取(SDME)[7]、固相萃取(SPE)[8]、纤维束固相微萃取(MMF-SPME)[9]和搅拌饼固相萃取(SCSE)[10],但这些方法存在着一些不足,如LLE需要较多的有机溶剂,DLLME、SDME和MMF-SPME富集容量较低,而SPE和SCSE存在萃取时间较长和操作过程繁琐等不足。因此,对于BUs的残留监测,仍需发展操作简便、萃取容量高、萃取速度快和环境友好的前处理方法。磁分散固相微萃取(Magnetic dispersive solid phase microextraction, MDSPME)具有操作简单、富集速度快、绿色环保等优点,目前在样品前处理中受到广泛关注。本研究以甲基丙烯酸(Methacrylic acid, MA)为功能单体,乙二醇二甲基丙烯酸酯(Ethylene dimethacrylate, EDMA)为交联剂,对Fe3O4磁性纳米粒子进行改性,所得到的改性粒子Fe3O4@MA-co-EDMA (Fe3O4@MAED)可通过多重作用有效富集BUs,同时结合HPLC/DAD,建立了可用于环境水样和果汁中痕量BUs残留测定的高效、灵敏的分析方法。
2 实验部分
2.1 仪器与试剂
高效液相色谱设备: LC-20AB泵、CBA-20A控制器、SPD-M20A DAD 检测器 (日本Shimadzu公司); 7725i进样阀(美国Rheodyne公司); 20 μL定量阀。JEM 2100F透射电镜(日本JEOL公司)。
甲基丙烯酸(MA,99%)、乙二醇二甲基丙烯酸酯(EDMA,97%) 和3-(甲基丙烯酰氧)丙基三甲基硅烷(γ-MAPS,98%)购自Alfa Aesar公司; 正丙醇(97%)和1,4-丁二醇(98%)由上海化学试剂公司提供。实验所用4种苯甲酰脲类农药氟苯脲(Teflubenzuron, TFU)、虱螨脲(Lufenuron, LFU)、氟虫脲(Flufenoxuron, FFU)和氟啶脲(Chlorfluazuron, CFU)的标准品购自北京振翔工贸有限责任公司。全部实验用水均为超纯水(美国Millipore公司),实验中的其它试剂均为分析纯。实际环境水样采自厦门的湖水和农田水,果汁购自厦门当地超市。
2.2 标准溶液的配制
分别称取5.0 mg各标准样品,以甲醇溶解并定容于50 mL棕色瓶中,配制成100 μg/mL的单标储备液,置于4℃保存。使用时,用甲醇稀释液成所需浓度的混标溶液。
2.3 色谱条件
色谱分离柱: Kromasil LC-18 column (250 mm×4.5 mm, 5 μm); 流动相为水-乙腈(22∶78, V/V)等度洗脱; 流速:1.0 mL/min; 检测波长: 260 nm; 进样体积: 20 μL。
2.4 磁吸附剂Fe3O4@MAED的制备
以FeCl3和FeCl2为原料,参照文献[11]制备Fe3O4磁性纳米粒子。取1.0 g Fe3O4纳米粒子,分散至100 mL异丙醇中,室温搅拌状态下逐滴加入5 mL正硅酸乙酯和60 mL 25% 氨水,氮气保护下反应12 h,反应完后用磁铁分离,磁性粒子用甲醇/水洗至中性,真空干燥后得Fe3O4@SiO2。随后,利用γ-MAPS与Fe3O4@SiO2反应,在纳米粒子表面引入双键,有利于与MA和EDMA的共聚反应。磁萃取介质Fe3O4@MAED的制备则是基于MA、EDMA和引发剂的共聚反应。在三口烧瓶中依次加入3.5 g MA、20 g EDMA、15 g正丙醇、8.5 g 1,4-丁二醇和4 g水,搅拌均匀后,加入400 mg上述处理过的Fe3O4@SiO2粒子和200 mg引发剂(偶氮二异丁腈),氮气保护下60℃反应12 h,反应结束后,纳米粒子分别用甲醇洗涤数次,然后用纯水洗涤至中性,60℃真空干燥后,得磁萃取介质Fe3O4@MAED。
2.5 实际样品的MDSPME过程
对于环境水样:取经0.45 μm 滤膜过滤后的水样50 mL于100 mL离心管中,将其调至pH 9.0,然后加入20 mg Fe3O4@MAED纳米粒子,置于恒温摇床中以500 r/min分散萃取9 min。萃取完成后,利用磁铁将磁吸附剂迅速移至离心管的侧壁,弃去样品溶液,加入0.5 mL甲醇,以同样的摇速解析6 min,解析液直接进行HPLC/DAD测定。
对于果汁样品:将果汁以4000 r/min离心10 min,取上层溶液,经1.0 μm 滤膜过滤。取滤液5 mL,用超纯水稀释到50 mL并调至pH 9.0,然后按环境水样的操作过程进行样品处理和测定。
3 结果与讨论
3.1 磁吸附剂Fe3O4@MAED的制备及表征
在MSPME中,磁性纳米粒子的涂层对萃取效果起着至关重要的作用。在BUs分子结构中,含有丰富的氨基和卤素原子,因此BUs属于极性较强的化合物,根据“相似相溶”的原理,本研究选用富含极性基团且价格便宜的甲基丙烯酸为功能单体,合成纳米粒子的涂层。研究表明,在一定条件下,磁吸附剂与目标物除了存在疏水作用外,涂层中的羧基发生解离,可与BUs的氨基发生离子交换作用,因此,Fe3O4@MAED可通过多重作用力实现对BUs的有效富集。通过优化功能单体、交联剂及磁性纳米粒子之间的比例,所合成的Fe3O4@MAED吸附剂不仅具有良好的萃取性能,而且使用寿命较为理想,至少可连续使用50次以上。
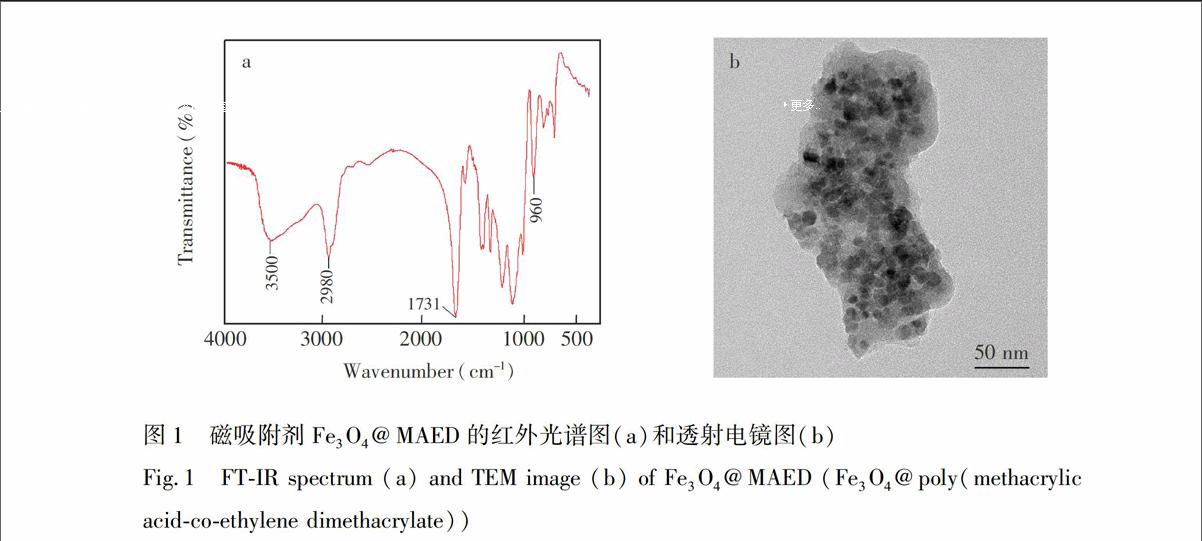
本研究利用元素分析、红外和透射电镜对Fe3O4@MAED吸附剂进行表征。元素分析结果表明,吸附剂中C和H的含量分别为50.2% (w/w)和4.96% (w/w)。从所合成磁吸附剂Fe3O4@MAED的红外光谱(图1a)可见,3500和960 cm
处的吸收峰属于羧基中的羟基吸收峰;2980 cm
附近的吸收峰说明存在CH3和CH2基团;而1731 cm
的强吸收峰则属于CO基团。红外表征表明了MA和EDMA成功地在磁性纳米粒子表面发生了共聚反应。
另外,从图1b可见,磁吸附剂Fe3O4@MAED的粒图1 磁吸附剂Fe3O4@MAED的红外光谱图(a)和透射电镜图(b)
Fig.1 FT-IR spectrum (a) and TEM image (b) of Fe3O4@MAED (Fe3O4@poly(methacrylic acid-co-ethylene dimethacrylate))
径具有较好的均一性。
3.2 萃取条件优化
为了得到MDSPME-Fe3O4@MAED对4种BUs的最佳萃取条件,本研究详细考察了磁吸附剂用量、解析溶剂、萃取和解析时间、样品基底pH值和离子强度等因素对目标物的萃取性能的影响。
3.2.1 磁吸附剂用量的影响
考察了磁吸附剂用量分别为10, 20, 30, 40和50 mg对BUs的萃取性能。研究表明,在其它条件不变时,磁吸附剂用量为20 mg时可得到最佳萃取性能,过多的使用Fe3O4@MAED吸附剂反而不利于对BUs的吸附,因此,本实验Fe3O4@MAED粒子用量为20 mg。
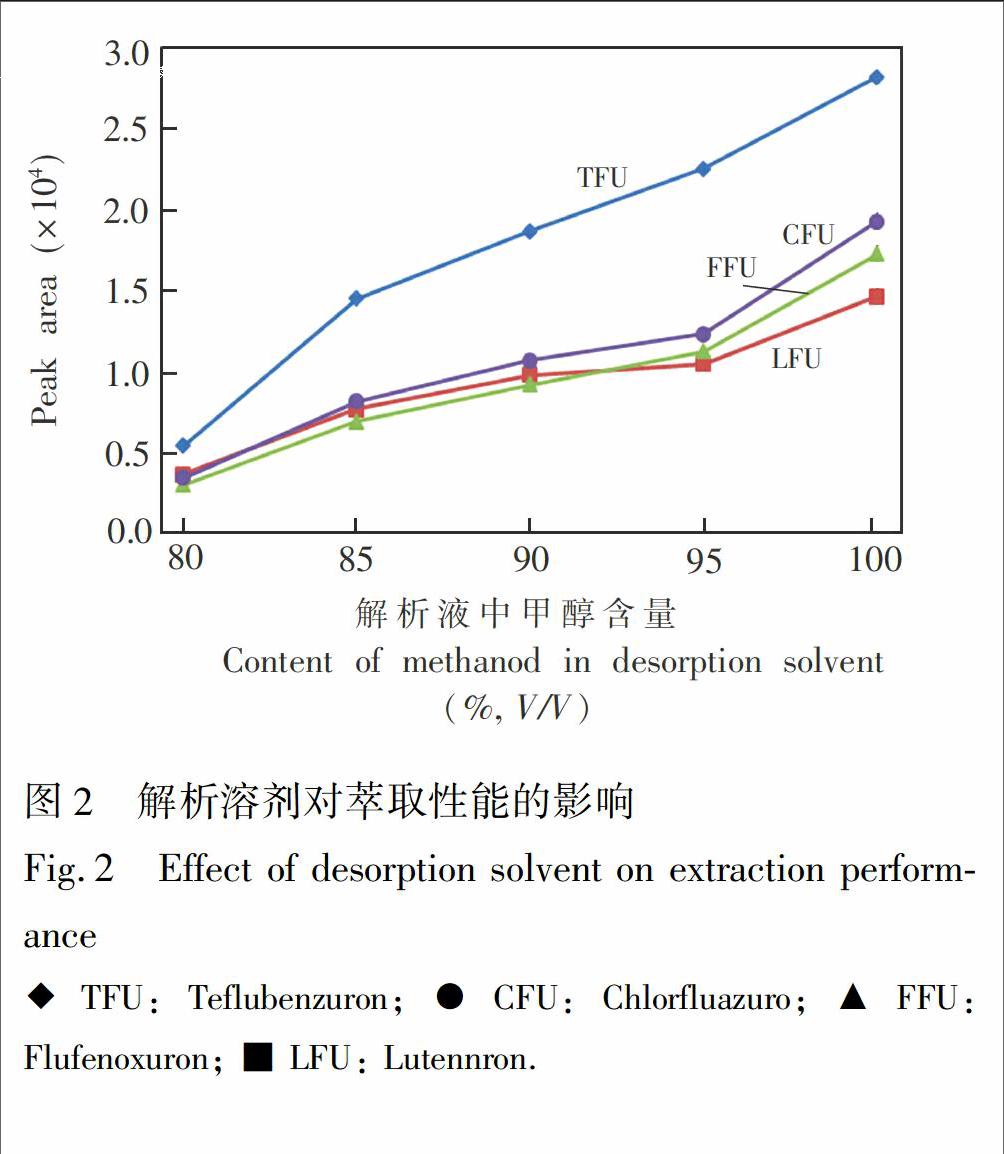
3.2.2 解析溶剂的影响 以甲醇-水混合溶剂为解析液,考察了解析液中甲醇含量对解析效果的影响。从图2可见,提高解析液中甲醇含量有利于将目标物从磁吸附剂中解析,根据实验结果,选择纯甲醇作为解析溶剂。
3.2.3 萃取和解析时间的影响 在其它实验条件保持不变时,考察了萃取时间在3~15 min之间的萃取效果(图3a)。研究表明,MSPME-Fe3O4@MAED对4种BUs的萃取效率随萃取时间的延长而迅速上升,当吸附时间大于9 min时,萃取达到平衡。因此,选择9 min为最佳萃取时间。本研究还考察了解析时间在3~15 min之间的解析效果,结果表明,解析6 min,目标化合物可以从Fe3O4@MAED吸附剂中被完全解析,因此解析时间确定为6 min。
图3 萃取时间(a)和解析时间(b)对萃取性能的影响
Fig.3 Effect of extraction time (a) and desorption time (b) on extraction performance
3.2.4 pH值的影响 图4为样品基底pH值从2.0变化到11.0时,萃取效率随pH值的变化曲线。样品基底pH值对萃取效率有很大影响,pH值从2.0增加到9.0时,萃取效率呈现增加趋势;在样品pH=9时,MSPME-Fe3O4@MAED对4种BUs的萃取效率达到最大值; pH值继续增加时,萃取效率明显下降。其原因可能是:在pH=9.0时,磁吸附剂中的羧基发生解离,与目标物存在着包括离子交换、氢键和疏水作用在内的多重作用力,因此在pH=9.0时可取得理想的萃取效果。根据实验结果,选择pH=9.0。
3.2.5 离子强度的影响 对于极性化合物的萃取,调节样品离子强度同时存在两种作用,其中盐析作用有利于萃取,而静电相互作用会导致萃取效率的影响,因此样品基底离子强度对萃取效率会产生较大影响[12]。本研究通过添加不同量的NaCl改变基底的离子强度,添加量分别为0, 5%, 10%, 15%和20%(w/V)。从图5可见,离子强度的增加不利于BUs的萃取,其原因可能是:随着NaCl浓度增加,促使更多的目标物质与溶液间产生静电作用,增加了目标物在溶液中的溶解,导致萃取率下降,因此在后续实验中将不调节样品的离子强度。
综合上述实验结果,MDSPME-Fe3O4@MAED对4种BUs的最佳萃取条件为:磁吸附剂用量20 mg,甲醇为解析溶剂,吸附和解析时间分别为9.0和6.0 min,基底pH=9.0,不调样品的离子强度。
3.3 方法的有效性
用空白水样和果汁样品配制不同浓度梯度的溶液,在最优条件下,考察方法的线性动力学范围、线性相关系数、检出限、定量限及日内和日间重复性。从表1可知,在水样中, TFU的线性范围为0.50~150.0 μg/L,其它3种BUPs的线性范围为1.0~150.0 μg/L,4种目标化合物均具有较好的线性关系(R2>0.99),检测限(Limit of determination, LOD,信噪比S/N=3)在0.10~0.19 μg/L 之间,定量限(Limit of quantification, LOQ,信噪比S/N=10)在0.33~0.62 μg/L之间。而对于果汁样品, TFU的线性范围为0.50~200.0 μg/L,其它3种BUPs的线性范围为1.0~200.0 μg/L,4种目标化合物线性关系良好(R2>0.99),LOD在0.12~0.30 μg/L 之间,LOQ在0.40~1.00 μg/L之间。同时,本方法的日内和日间的实验重复性良好(RSD<11%)。因此,本方法具有较高的灵敏度和实验重现性。
3.4 实际样品测定及加标回收率实验
用本方法测定了实际水样和果汁中Bus含量,结果如表2所示;图6为实际样品和加标后的样品经Fe3O4@MAED萃取后的色谱图。结果表明,在湖水检测到低浓度的LFU和FFU,而其它的实际样品均未检出BUs。为了进一步考察本方法用于实际样品中4种BUs物质测定的可行性,本研究还测定了实际水样和果汁不同加标量的回收率。从表2可知,对于两种不同浓度加标量(水样加标浓度为5.0和50.0 μg/L,果汁加标浓度为10.0和100.0 μg/L),在不同实际水样和果汁中均取得了理想的回收率,4种目标物在环境水样和果汁中的回收率分别为69.4%~110%和78.8%~118%,加标回收率的RSD<12%。表明本方法对于环境水样和果汁中BUs的检测具有较好的可行性。
3.5 与其它方法的比较
比较了本方法与现有的测定水样和果汁中BUs的方法的LOD值、回收率和样品前处理所用时间(表3),对于水样,在用紫外吸收检测器时,本方法所得到的LOD值低于DLLME-LC/UV所得LOD值[6];对于果汁样品,本实验得到的LOD值也低于SDME-LC/UV[7]和FDME-LC/UV[13]。SCSE-LC/DAD[10]、MMF-SPME-LC/DAD[9]和SPE-HPLC/MS[8]虽可得到较好的检测灵敏度,但其样品前处理时间均较长,如SCSE-LC/DAD所需时间长达180 min。本方法所取得的加标回收率与以前的研究方法处于相同水平,样品处理时间则明显小于除FDME-LC/UV外的其它前处理方法。
4 结 论
本研究利用共聚技术制备了甲基丙烯酸改性的磁吸附剂, 并用于萃取环境水样和果汁中苯甲酰脲类杀虫剂。研究表明,所合成的磁吸附剂可通过包括离子交换、氢键和疏水作用在内的多重作用力实现对苯甲酰脲类化合物的有效萃取。在此基础上,建立了可对实际水样和果汁中BUs残留进行有效监测的MDSPME-Fe3O4@MAED-HPLC/DAD分离分析方法。本方法具有操作简便、灵敏度高、快速和环境友好等特点。
References
1 Matsumura F. Pestic. Biochem. Physiol., 2010, 97(2): 133-139
2 Brutti M, Blasco C, Picó Y. J. Sep. Sci., 2010, 33(1): 1-10
3 Zhou Q X, Zhang X G. J. Sep. Sci., 2010, 33(23-24): 3734-3740
4 WANG Lian-Zhu, ZHOU Yu, CHEN Yong, LI Shu-Ying, WANG Rui-Long, KE Hui-Xian. Journal of Instrumental Analysis, 2010, 29(3): 289-293
王连珠, 周 昱, 陈 泳, 李术英, 王瑞龙, 柯慧贤. 分析测试学报, 2010, 29(3): 289-293
5 Zhou Q X, Wang G Q, Xie G H. J. Sep. Sci., 2013, 36(14): 2323-2329
6 Zhang J H, Li M, Yang M Y, Peng B, Li Y B, Zhou W F, Gao H X, Lu R H. J. Chromatogr. A, 2012, 1254: 23-29
7 ZHOU Jian-Ke, LIU Rui-Ying, SONG Ge, ZHANG Ming-Cui. Food Sci. Technol., 2009, 34(8): 290-293
周建科, 刘瑞英, 宋 歌, 张明翠. 食品科技, 2009, 34(8): 290-293
8 Martínez D B, Galera M M, Vázquez P P, García M D. Chromatographia, 2007, 66: 533-538
9 Mei M, Huang X J, Liao K R, Yuan D X. Anal. Chim. Acta, 2015, 860: 29-36
10 ZHANG Yong, LIU Yi, YU Jie, HUANG Xiao-Jia, YUAN Dong-Xing. Chinese Journal of Chromatography, 2014, 32(9): 981-987
张 咏, 刘 祎, 喻 杰, 黄晓佳, 袁东星. 色谱, 2014, 32(9): 981-987
11 Huang X J, Wang Y L, Liu Y, Yuan D X. J. Sep. Sci., 2013, 36(19): 3210-3219
12 Lord H, Pawliszyn J. J. Chromatogr. A, 2000, 902(1): 17-63
13 Zhou J K, Liu R Y, Song G, Zhang M C. Anal. Lett., 2009, 42: 1805-1819

