硒—汞双元素标记策略识别硒蛋白/多肽
徐明 杨利民 王秋泉


摘 要 提出并发展了一种基于电感耦合等离子体质谱(ICP-MS)的双元素标签标记策略来选择性识别和检测硒蛋白/多肽,其中内源元素硒(Se)作为硒蛋白/多肽分子的识别元素,外源元素汞(Hg)作为硒蛋白/多肽和含硒蛋白/多肽分子的区分元素。通过对硒代半胱氨酸(SeCys)和谷胱甘肽过氧化酶1(GPx1)两种模型分子的研究,外源邻羧基苯硫甲基汞(CH3Hg-THI)动态解离的CH3Hg+能够选择性标记硒代半胱氨酸残基(SeCys)中硒醇基(-SeH),但不能标记含硒蛋白/多肽分子的硒代蛋氨酸残基(SeMet)中的—SeCH3,进而依据Se和Hg的ICP-MS信号识别和检测硒蛋白/多肽。本方法应用于富硒酵母水溶性提取液的分析,结果表明,提取液中的硒蛋白/多肽能够被有效识别和检测,验证了Se-Hg双元素标签标记策略的发展是ICP-MS识别和检测硒蛋白/多肽的一种可行且优越的途径。
关键词 硒; 汞; 硒蛋白/多肽; 电感耦合等离子体质谱
1 引 言
以内源元素分析蛋白质已有很长的历史,130年前发明的凯氏定氮法(Kjeldahl method)就是利用检测蛋白质内源元素氮进行蛋白质分析的经典范例[1]。近二十年来,随着生命科学和分析技术的快速发展,针对生物分子(如蛋白质和多肽)的新元素标签标记研究策略和方法不断涌现,而且还在快速发展进程中[2]。具有优异的元素分析能力(高的灵敏度和选择性)的电感耦合等离子体质谱(ICP-MS)与元素标签策略的有机结合可以实现复杂生物体系中低丰度蛋白质和多肽等生物分子的分析[3~5]。除了内源元素标签,通过人为标记外源元素标签(如镧系元素、Hg、Au等)的研究策略因可以进一步扩展研究范围和弥补内源元素标签的不足,越来越受到重视[6~14]。但是,因为针对目标蛋白质/多肽如何建立起内源元素标签和外源标记元素间的关系还有一定困难,目前报道的研究方法还多集中于单一利用内源或外源元素,同时利用两类元素标签的研究工作还鲜有报道。内源和外源双元素标记识别策略的建立,需要满足以下要求:(1)目标生物分子需要含有内源性共价结合的标签元素;(2)目标生物分子能够被外源性元素标签有效标记,并且所标记的外源元素标签与内源标签元素应发挥各自的识别、区分和检测功能;(3)内源和外源性元素标签能够同时有效地被ICP-MS识别和检测。
在本课题组以前的研究工作中,不但利用内源元素硒(Se)定量地研究了人血浆中的硒蛋白,而且利用外源元素汞(Hg)标签对多种蛋白和多肽分子实现选择性的标记和定量分析[14~19]。Se和Hg是一对典型的在生物体中会产生拮抗效应的元素,并形成特定的硒汞化合物[20~22]。作为一类重要的生物分子,硒蛋白/多肽中Se以硒醇(—SeH)的形式存在于硒代半胱氨酸残基中,这为外源的Hg标签提供了一个理想的标记位点。利用这两种元素作为内源和外源元素标签识别和检测硒蛋白/多肽在理论上是可行的。本研究探讨了利用外源Hg标签标记硒蛋白/多肽的可能性,进而实现Se-Hg双元素标记选择性识别和检测硒蛋白/多肽的目的。
2 实验部分
2.1 仪器与试剂
液相色谱-电喷雾质谱(Esquire LC/ESI-IT-MS,德国布鲁克公司);基质辅助激光解吸电离飞行时间质谱(Microflex LRF MALDI-TOF-MS,德国布鲁克公司);SERIES 200液相色谱-ELAN DRC II电感耦合等离子体质谱(HPLC-ICP-MS,铂金埃尔默公司)。为了消除16O2+对32S+的干扰,在测定S时使用O2(99.999%,北京氦普北分气体工业有限公司)将S在动态反应池中氧化为SO(0.6 mL/min O2;RPQ 0.45),检测32S16O+测定S的含量;监测82Se+和202Hg+用于Se和Hg的测定。
硒代胱氨酸(Seleno-DL-cystine, (SeCys)2),硒代蛋氨酸(L-Selenomethionine, SeMet),二硫苏糖醇(Dithiol dithiothreitol, DTT),邻羧基苯硫酚(Thiosalicylic acid, HOOCC6H4SH),2,5-二羟基苯甲酸(2,5-Dihydroxybenzoic acid)和谷胱甘肽过氧化物酶1(Glutathione peroxidase 1, GPx1)均购于美国Sigma-Aldrich 公司;氯化甲基汞(Methylmercuric chloride, CH3HgCl,德国Dr. Ehrenstorfer GmbH公司);富硒酵母(Sel-Plex,美国Alltech公司);用于尺寸排阻色谱的标准物Pyruvate kinase (237.0 kDa), Bovine serum albumin (66.5 kDa), Ovalbumin (44.3 kDa), Lysozyme (14.3 kDa) 和 Cobalamin (1.4 kDa)购自Sigma-Aldrich公司。其它试剂均为分析纯以上的纯度;高纯水(18 MΩ cm,厦门大学萨本栋微机电中心)。
2.2 实验方法
2.2.1 CH3Hg-THI标记硒蛋白/多肽 将相同摩尔的氯化甲基汞(CH3HgCl)与邻羧基苯硫酚(HOOCC6H4SH)混合反应,获得邻羧基苯硫甲基汞CH3HgS-C6H4COOH(CH3Hg-THI, 4 mmol/L, pH 7.4),并于4℃保存。利用过量的二硫苏糖醇(DTT)将硒代胱氨酸(10
还原为硒代半胱氨酸(SeCys)。CH3Hg-THI(4 mmol/L, 0.2 mL)标记还原所得的SeCys。在缓冲溶液(20 mmol/L NH4COOCH3, pH 7.4)中37℃孵育1 h后,利用ESI-IT-MS进行分析标记产物。同时,作为对照,硒代蛋氨酸(SeMet)也按照上述过程进行处理分析。
谷胱甘肽过氧化物酶1(GPx1)溶于缓冲液(20 mmol/L NH4COOCH3, pH 7.4)作为储备液,并保存于
分别与CH3HgCl和CH3Hg-THI(5 μL, 4 mmol/L)进行反应(37℃, 1 h)。反应结束后,使用SEC/ICP-MS (尺寸排阻色谱柱,Superdex 75 10/300 GL(GE Healthcare);流动相: 5 mmol/L Tris + 100 mmol/L NH3HCO3, pH 7.4; 流速: 0.75 mL/min)和RPLC/ESI-MS VP-ODS C18反相色谱柱(日本Shimadzu公司);流动相A: H2O, 0.05% TFA; 流动相B: Acetonitrile, 0.05% TFA; 流速: 150 μL/min; 洗脱梯度: 0~5 min, 1% B; 5~10 min, 1%~5% B; 10~20 min, 5%~10% B; 20~25 min, 10%~30% B; 25~40 min, 30% B)对标记产物进行分析。每两次分析间隔,利用1% DTT清洗色谱柱30 min。反应产物同时利用MALDI-TOF-MS进行分析。
2.2.2 富硒酵母水溶性提取液的制备和分析 使用5 mL PBS缓冲液(1.4 mmol/L NaCl, 0.27 mmol/L KCl, 1 mmol/L Na2HPO4, 0.18 mmol/L KH2PO4, pH 7.4)于4℃超声萃取富硒酵母(0.5 g)5 min,于4℃以10000 r/min离心30 min 2次,收集上清液,得到富硒酵母水溶性提取液。于50 μL富硒酵母水溶性提取液样品中加入CH3Hg-THI(5 μL, 4 mmol/L)进行标记。反应产物使用PD minitrap G-10进行脱盐处理后,利用SEC/ICP-MS和RPLC/ICP-MS进行检测分析。ICP-MS测定(82Se+, 202Hg+和32S16O+)之前,串联的UV检测器(214 nm)对色谱流出物进行检测。3 结果与讨论
3.1 双元素标记原理
如图1a所示,在蛋白质/多肽分子中,Se有两种存在形式:硒代半胱氨酸(SeCys)和硒代蛋氨酸(SeMet),两者与S的存在形式半胱氨酸(Cys)和蛋氨酸(Met)结构相似。含有SeCys的蛋白/多肽被定义为硒蛋白/多肽,而含有SeMet的蛋白/多肽为含硒的蛋白/多肽,这两类蛋白/多肽具有不同的生理功能[23]。硒蛋白/多肽的SeCys残基中的-SeH可以与CH3Hg-THI动态离解出的CH3Hg+反应, 实现选择性的Hg标记;含有SeMet的含硒蛋白/多肽因Se以-SeCH3的形式存在而不能与Hg反应(图1b)。另一方面,硒醇基-SeH的pKa=5.2低于巯基(-SH)的pKa=8.5大约3个数量级; 相比于-SH,-SeH活性更高,更易与CH3Hg+反应[24,25]。只有被ICP-MS同时检测到Se和Hg的信号又在ESI-IT-MS上呈现Se和Hg的特征同位素分布的分子才被认为是硒蛋白/多肽;而只检测到Se或Hg的信号的分子可能是含硒蛋白/多肽或其它含Cys的蛋白/多肽 (图1c和1d)。这样就可以实现硒蛋白/多肽的特异性识别。
图1 内源和外源Se-Hg双元素标记策略识别硒蛋白和多肽
Fig.1 Endogenous and exogenous Se-Hg dual-labeling strategy for recognizing selenoprotein/peptide
3.2 CH3Hg-THI标记硒醇-SeH
为了研究CH3Hg-THI能否选择性的标记-SeH,首先用DTT还原硒代胱氨酸(SeCys)2得到硒代半胱氨酸SeCys,之后用CH3Hg-THI标记SeCys(图2a)。实验结果表明,通过改变(SeCys)2与DTT的摩尔比,成功地获得SeCys(m/z 167.6)(图2b);其在与CH3Hg-THI反应后,SeCys的质谱信号消失,同时出现了产物CH3Hg-SeCys的质谱信号(m/z 404.6),而且其同位素分布(404.6(23.0%), 402.6(16.3%), 403.5(14.9%), 401.6(12.8%), 406.6(11.3%), 400.5(8.4%), 405.5(6.6%), 408.5(2.9%), 399.5(2.1%), 397.7(0.9%), 398.6(0.8%))与H2NCOOHCHCH2SeHgCH3的理论同位素分布一致(图2c),证明SeCys中的-SeH被成功标记。作为对照,SeMet(m/z 197.9和394.8)质谱信号在标记反应前后并无变化,说明-SeCH3不能被CH3Hg-THI所标记。
图2 (a)硒代胱氨酸(SeCys)2的DTT还原和CH3Hg-THI标记SeCys反应;(b)利用DTT还原硒代胱氨酸(SeCys)2获得硒代半胱氨酸SeCys的ESI-IT-MS质谱图;(c)CH3Hg-THI标记硒代半胱氨酸SeCys和硒代蛋氨酸SeMet的质谱图
Fig.2 (a) Reduction of (SeCys)2 to SeCys by dithiol dithiothreitol (DTT) and labeling with CH3Hg-THI, (b) ESI-IT-MS of the reduction of (SeCys)2 to SeCys by DTT and (c) labelling of the SeCys and SeMet with CH3Hg+ dynamically released from CH3Hg-THI
3.3 CH3Hg-THI标记硒蛋白GPx1
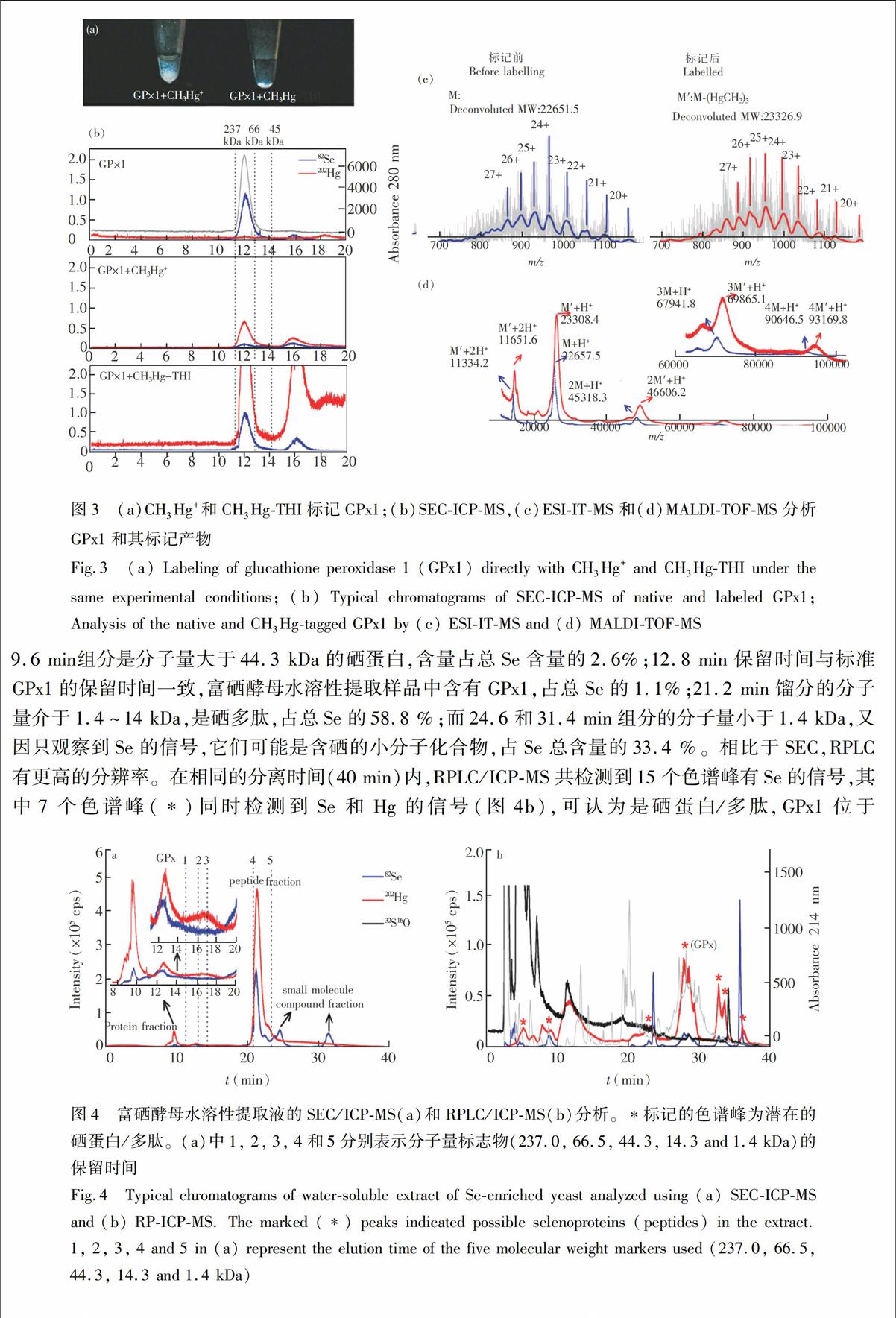
本实验选取了一种典型的硒蛋白GPx1作为模型分子,验证CH3Hg-THI标记GPx1中-SeH反应的可行性。GPx1是硒蛋白家族中的一个重要成员,它能够有效清除生物体中的超氧自由基[26]。GPx1分子由4个Monomer组成,每个Monomer含有1个-SeH基团(SeCys52)和2个-SH基团[27]。作为对照,同时使用CH3Hg+和CH3Hg-THI分别对GPx1进行标记。结果表明,在生理溶液中直接使用CH3Hg+对GPx1进行标记时出现了白色的蛋白沉淀(图3a),说明GPx1的分子构象被破坏,导致其变性。SEC/ICP-MS的分析结果也表明溶液中残存的CH3Hg+标记的GPx1的Se和Hg信号显著降低(图3b)。相比于直接使用CH3Hg+,CH3Hg-THI间接地动态释放CH3Hg+[17],并与GPx1反应,在标记过程中不会导致GPx1变性(图3a),这时SEC/ICP-MS可同时检测到非常强的Se和Hg信号,说明GPx1成功地被CH3Hg-THI标记,并能在生理溶液中稳定存在。
利用SEC/ESI-IT-MS和MALDI-TOF-MS对标记后的GPx1进行了分析(如图3c)。SEC/ESI-IT-MS检测到的标记前后的M(GPx1 monomer)和标记后产物M(M-(HgCH3)3),分子量分别为22651.5 和23326.9 Da,质量差为675.4 Da,说明GPx1 monomer中的-SeH基团和2个-SH基团都被成功标记。MALDI-TOF-MS对相同标记产物的分析结果表明,除GPx1monomer可以被CH3Hg-THI成功标记外,其二聚体、三聚体和四聚体都可以被成功标记,再次证明CH3Hg-THI动态标记有利于保持GPx1分子的稳定性。进一步利用SEC/ICP-MS对标记反应进行了定量分析。基于ICP-MS对202Hg 的检出限(45 pmol/L),GPx1的检出限可以达到10 fmol,较通过对82Se的检测灵敏度(100 fmol)提高1个数量级,说明外源的Hg标签除了能够帮助区分硒蛋白/多肽和含硒蛋白/多肽分子,也能够有效提高硒蛋白/多肽的检测能力,有利于低丰度生物分子的研究。
图3 (a)CH3Hg+和CH3Hg-THI标记GPx1;(b)SEC-ICP-MS,(c)ESI-IT-MS和(d)MALDI-TOF-MS分析GPx1和其标记产物
Fig.3 (a) Labeling of glucathione peroxidase 1 (GPx1) directly with CH3Hg+ and CH3Hg-THI under the same experimental conditions; (b) Typical chromatograms of SEC-ICP-MS of native and labeled GPx1; Analysis of the native and CH3Hg-tagged GPx1 by (c) ESI-IT-MS and (d) MALDI-TOF-MS
3.4 富硒酵母提取物中硒蛋白/多肽的识别和检测
富硒酵母中不但含有硒蛋白/多肽,而且有含硒蛋白/多肽和含硒无机小分子,在平衡生物体内的Se含量和硒蛋白/多肽功能方面发挥着重要作用[28~33]。采用PBS缓冲液超声提取富硒酵母的水溶性组分,对其中硒蛋白/多肽进行识别和检测。需要注意的是,在CH3Hg-THI标记和SEC/ICP-MS和RPLC/ICP-MS检测之前,并未对富硒酵母的水溶性提取液进行还原,避免因还原反应造成二硫键断裂,产生大量SH基团。CH3Hg-THI对富硒酵母水溶性提取液进行标记后,采用两种色谱模式SEC (图4a)和RPLC(图4b)与ICP-MS联用进行分析。SEC/ICP-MS结果表明,在富硒酵母的水溶性提取物主要含有5个含硒馏分(9.6, 12.8, 21.2, 24.6和31.4 min)。因可同时检测到Se和Hg的信号(图4a),9.6,12.8和21.2 min这3个馏分中含有硒蛋白/多肽;与分子量标准物的保留时间相比较,9.6 min组分是分子量大于44.3 kDa的硒蛋白,含量占总Se含量的2.6%;12.8 min保留时间与标准GPx1的保留时间一致,富硒酵母水溶性提取样品中含有GPx1,占总Se的1.1%;21.2 min馏分的分子量介于1.4~14 kDa,是硒多肽,占总Se的58.8 %;而24.6和31.4 min组分的分子量小于1.4 kDa,又因只观察到Se的信号,它们可能是含硒的小分子化合物,占Se总含量的33.4 %。相比于SEC,RPLC有更高的分辨率。在相同的分离时间(40 min)内,RPLC/ICP-MS共检测到15个色谱峰有Se的信号,其中7个色谱峰
图4 富硒酵母水溶性提取液的SEC/ICP-MS(a)和RPLC/ICP-MS(b)分析。*标记的色谱峰为潜在的硒蛋白/多肽。(a)中1, 2, 3, 4和5分别表示分子量标志物(237.0, 66.5, 44.3, 14.3 and 1.4 kDa)的保留时间
Fig.4 Typical chromatograms of water-soluble extract of Se-enriched yeast analyzed using (a) SEC-ICP-MS and (b) RP-ICP-MS. The marked (*) peaks indicated possible selenoproteins (peptides) in the extract. 1, 2, 3, 4 and 5 in (a) represent the elution time of the five molecular weight markers used (237.0, 66.5, 44.3, 14.3 and 1.4 kDa)
(*)同时检测到Se和Hg的信号(图4b),可认为是硒蛋白/多肽,GPx1位于26.5~30.0 min之间。由图4b可见,当检测32S16O+时,高含量组分在10 min前被检测到,这些都是富硒酵母水溶性提取液中高含量的含Cys的蛋白分子(因硒蛋白分子中也可能含有Cys);在这样的高的背景下,本方法仍可以识别硒蛋白/多肽、含硒蛋白/多肽和其他高丰度蛋白/多肽分子,证明了Se-Hg双元素标签标记方法在解决识别和检测硒蛋白/多肽问题上的优越性。值得指出的是,更高分辨能力的多维分离技术和更高分辨率的质谱技术(如FT-ICR-MS)的联合应用将有助于已识别的硒蛋白/多肽的组成和结构的进一步鉴定。
4 结 论
提出并发展了内源和外源双元素标签标记策略,此策略使得ICP-MS在识别和检测硒蛋白/多肽方面展示了前所未有的优越性。随着针对不同重要蛋白/多肽分子的双元素标签标记策略研究的深入开展,此策略将在识别和定量已知和未知蛋白/多肽分子方面发挥重要作用。
References
1 Kjeldahl J Z. Anal. Chem., 1883, 22(1): 366
Symbolm@@ 382
2 Cvetkovic A, Menon A L, Thorgersen M P, Scott J W, Poole F L, Jenney F E, Lancaster W A, Praissman J L, Shanmukh S, Vaccaro B J, Shanmukh S, Vaccaro B J, Trauger S A, Kalisiak E, Apon J V, Siuzdak G, Yannone S M, Tainer J A, Adams M W. Nature, 2010, 466(7307): 779-782
3 XU Ming, YAN Xiao-Wen, YANG Li-Min, WANG Qiu-Quan. Scientia Sininca Chimica, 2011, 41(4): 663-677
徐 明, 严晓文, 杨利民, 王秋泉. 中国科学: 化学, 2011, 41(4): 663-677
4 Yan X W, Yang L M, Wang Q Q. Anal. Bioanal. Chem., 2013, 405(17): 5663-5670
5 WANG Qiu-Quan,TANG Nan-Nan, YANG Li-Min. Scientia Sininca Chimica, 2014, 44(5): 664-671
王秋泉, 唐南南, 杨利民. 中国科学: 化学, 2014, 44(5): 664-671
6 Zhang C, Zhang Z, Yu B, Shi J, Zhang X. Anal. Chem., 2002, 74(1): 96
7 Baranov V I, Quinn Z, Bandura D R, Tanner S D. Anal. Chem., 2002, 74(7): 1629
8 Sanz-Medel A, Montes-Bayon M, Fernandez Sanchez M L. Anal. Bioanal. Chem., 2003, 377(2): 236
9 Szpunar J. Analyst, 2005, 130(4): 442
10 Prange A, Prfrock D. J. Anal. At. Spectrom., 2008, 23(4): 432
11 Bettmer J, Montes Bayón M, Encinar J R, Fernández Sánchez M L, Fernández de la Campa Mdel R, Sanz Medel A. J. Proteomics, 2009, 72(6): 989
12 Mounicou S, Szpunar J, Lobinski R. Chem. Soc. Rev., 2009, 38(4): 1119
13 Wang M,Feng W, Zhao Y, Chai Z. Mass Spectrom. Rev., 2010, 29(2): 326
14 Xu M, Yang LM, Wang Q Q. J. Anal. At. Spectrom., 2008, 23(11): 1545
15 Guo Y F, Chen L Q, Yang L M, Wang Q Q. J. Am. Soc. Mass Spectrom., 2008, 19(8): 1108
16 Guo Y F, Xu M, Yang L M, Wang Q Q. J. Anal. At. Spectrom., 2009, 24(9): 1184
17 Xu M, Yan X W, Xie Q Q. Yang L M, Wang Q Q. Anal. Chem., 2010, 82(5): 1616
18 Xu M, Yang L M, Wang Q Q. Chem. Eur. J., 2012, 18(44): 13989
19 Xu M, Yang L M, Wang Q Q. Metallomics, 2013, 5(7): 855
20 Mounicou S, Shah M, Meija J, Caruso J A, Vonderheide A P, Shann J. J. Anal. At. Spectrom., 2006, 21(4): 404
21 Li Y F, Chen C Y, Li B, Wang Q, Wang J X, Gao Y X, Zhao Y L, Chai Z F. J. Anal. At. Spectrom., 2007, 22(8): 925
22 Li Y F, Dong Z Q, Chen C Y, Li B, Gao Y X, Qu L Y, Wang T C, Fu X, Zhao Y L, Chai Z F. Environ. Sci. Technol., 2012, 46(20): 11313
23 Behne D, Kyriakopoulos A. Annu. Rev. Nutr., 2001, 21(1): 453
24 Huber R E, Criddle R S. Arch. Biochem. Biophys., 1967, 122(1): 164
25 Arnér E S. Exp. Cell Res., 2010, 316(8): 1296
26 Margis R, Dunand C, Teixeira F K, Margis-Pinheiro M. FEBS J., 2008, 275(15): 3959
27 Nakamura W, Hosoda S, Hayashi K. Biochim. Biophys. Acta, 1974, 358(1): 251
28 Lobanov A V, Hatfield D L, Gladyshev V N. Biochim. Biophys. Acta, 2009, 1790(11): 1424
29 Mester Z, Willie S, Yang L, Sturgeon R, Caruso J A, Fernández M L, Fodor P, Goldschmidt R J, Goenaga-Infante H, Lobinski R, Maxwell P, McSheehy S, Polatajko A, Sadi B B, Sanz-Medel A, Scriver C, Szpunar J, Wahlen R, Wolf W. Anal. Bioanal. Chem., 2006, 385(1): 168
30 Rao Y, McCooeye M, Windust A, Bramanti E, D'Ulivo A, Mester Z. Anal. Chem., 2010, 82(19): 8121-8130
31 Bierla K, Szpunar J, Yiannikouris A, Lobinski R. Trends Anal. Chem., 2012, 41: 122
32 Bierla K, Bianga J, Ouerdane L, Szpunar J, Yiannikouris A, Lobinski R. J. Proteomics, 2013, 87: 26
33 Li H M, Luo Y C, Li Z X, Yang L M, Wang Q Q. Anal. Chem., 2012, 84(6): 2974

