功能化Mn掺杂ZnS量子点用于人血清中IgG的低背景磷光检测
朱保砚 杨成雄 严秀平


摘 要 通过Mn掺杂ZnS量子点表面的羧基与人IgG表面的氨基进行酰胺缩合,制备了人IgG功能化的Mn掺杂ZnS量子点(IgG-QDs)。通过金纳米粒子和羊抗人IgG之间的静电相互作用,合成了羊抗人IgG功能化的金纳米粒子。利用IgG-QDs和羊抗人IgG功能化的金纳米粒子之间的荧光共振能量转移效应,建立了人血清中人IgG的室温磷光检测新方法。本方法的线性范围为1~10 μg/mL,检出限为0.45 μg/mL。由于引入了室温磷光检测,本方法有效避免了机体自发荧光和基质散射光等背景信号的干扰,成功实现了人血清样品中人IgG的检测。
关键词 Mn掺杂ZnS量子点; 免疫球蛋白G; 金纳米粒子; 磷光
1 引 言
量子点作为一种新型荧光探针,与有机荧光染料相比,具有吸收光谱宽、发射光谱窄和抗光漂白性好等优点,在诸多领域得到了广泛研究和应用[1~11]。而传统的荧光量子点用于生物传感时,常受到基体自发荧光和基质散射光的干扰[12]。因此,需要将量子点光信号和背景光信号区分开。目前已报道的可避免背景干扰的量子点主要有两类,近红外量子点[13~15]和磷光量子点[16~22]。近红外量子点的发射波长较长,可以避开发射波长在550 nm左右的背景信号干扰。磷光量子点由于发光寿命较长,可在发光时间上避开短寿命的背景信号干扰。
Mn掺杂ZnS量子点是磷光量子点的典型代表,其光学性质优异,在生物传感中具有良好的应用潜力。已有的基于Mn掺杂ZnS量子点的生物传感方法,大多依赖分析物与量子点之间直接[22]或者间接[21]的相互作用。IgG(免疫球蛋白G,IgG)是血清主要的抗体成分,在机体免疫中起保护作用,其指标对疾病诊断具有重要意义。IgG等生物活性蛋白与量子点并没有明显的相互作用,又需要保持其四级结构来执行生物学功能,开发基于Mn掺杂ZnS量子点的可用于人IgG等生物活性蛋白的低背景检测方法具有重要意义。
本研究通过Mn掺杂ZnS量子点表面的羧基与人IgG表面的氨基进行酰胺缩合, 制备了人IgG功能化的Mn掺杂ZnS量子点(IgG-QDs); 通过金纳米粒子和羊抗人IgG之间的静电相互作用, 制备了羊抗人IgG金纳米粒子。利用IgG-QDs和羊抗人IgG功能化的金纳米粒子之间的荧光共振能量转移效应,构建了人体血清中人IgG的室温磷光检测新方法。本方法的线性范围为1~10 μg/mL,检出限为0.45 μg/mL。由于引入了室温磷光检测,本方法可有效避免基体自发荧光和基质散射光等背景信号的干扰。同时,由于引入了IgG-QDs和羊抗人IgG功能化的金纳米粒子之间的荧光共振能量转移效应, 因此本方法可用于高选择性检测生物体液中的人IgG。本方法低毒低背景,有望用于构建其它检测体系, 用于生物体液中的重要生物活性物质的检测。
2 实验部分
2.1 仪器与试剂
Rigaku D/max-2500 X-射线衍射光谱仪(日本理光公司); Tecnai G2 F20高分辨场发射透射电子电镜(荷兰菲利普公司); UV-3600紫外-可见-近红外分光光度计(日本岛津公司); FL-4500荧光光谱仪(日本日立公司)。
所用试剂至少为分析纯。超纯水(电阻率18.2 MΩ cm)由WaterPro水纯化系统(美国Labconco 公司)制备。柠檬酸钠、巯基丙酸(MPA)和氯金酸(阿拉丁试剂); 吐温-20、ZnSO4·7H2O、Mn(Ac)2·4H2O和Na2S·9H2O(天津市光复精细化工研究所);C6H5Na3O7·2H2O(天津富辰化学试剂研究所);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和N-羟基琥珀酰亚胺(NHS),购于上海 Medpep公司;人IgG和羊抗人IgG (Ab,北京拜耳迪生物科技有限公司);氨基酸和人血清白蛋白(HSA)购于北京普博欣试剂公司。
2.2 实验方法
2.2.1 Mn掺杂ZnS量子点的制备
参考文献[23]制备Mn掺杂ZnS量子点。在100 mL圆底三口烧瓶中加入0.5 mmol ZnSO4和0.02 mmol Mn(Ac)2,室温磁力搅拌混合均匀。加入2 mmol MPA,待搅拌均匀后用1.5 mol/L NaOH调至pH 11,以去离子水调节体系总体积至45 mL。室温磁力搅拌下通氩气30 min,在隔绝空气的条件下加入5 mL Na2S溶液(0.05 mmol/L)。反应20 min后,将体系敞开,并在50℃的恒温水浴中陈化2 h。以无水乙醇沉降所得量子点,离心(10000 r/min,10 min),再用无水乙醇洗涤沉淀两次,离心收集沉淀。所得沉淀室温真空干燥24 h,得到Mn掺杂ZnS量子点。
2.2.2 人IgG功能化Mn掺杂ZnS量子点(IgG-QDs)的制备
参考文献[24~26]制备人IgG功能化Mn掺杂ZnS量子点。用10 mmol/L PBS(pH 7.4)稀释人IgG原液,得到5.0 mg/mL人IgG溶液,备用。称取10 mg Mn掺杂ZnS量子点,4 mg EDC和2 mg NHS,溶解在1.0 mL 10 mmol/L PBS(pH 7.4)中。所得混合液在室温下磁力搅拌30 min,使Mn掺杂ZnS量子点表面羧基充分活化。向上述混合液中加入1.0 mL 5.0 mg/mL人IgG溶液,室温下磁力搅拌2 h。随后将反应液于4℃放置过夜,让未反应的EDC水解而失去活性。2500 r/min离心10 min,弃去上清液。将得到的沉淀用10 mmol/L PBS(pH 7.4)洗涤两次。随后将得到的沉淀溶解于20 mL 10 mmol/L PBS缓冲溶液(pH 7.4)中,于4℃放置备用。
2.2.3 金纳米粒子(AuNPs)的制备
参考文献[27~30]制备AuNPs。称取115 mg柠檬酸钠,以10 mL去离子水溶解, 得1%的柠檬酸钠溶液。在100 mL圆底烧瓶中加入25 mL去离子水和250 μL 1% 氯金酸溶液,磁力搅拌下加热至沸腾。向体系中快速加入1 mL 1% 柠檬酸钠溶液,反应2 min后,反应液由金黄色变为酒红色。待反应液保持沸腾10 min后撤去加热源,室温下搅拌15 min,得到所需的AuNPs溶液。
2.2.4 羊抗人IgG功能化AuNPs(Ab-AuNPs)的制备
参考文献[25]制备羊抗人IgG功能化的金纳米粒子。以0.1 mol/L Na2CO3溶液调节AuNPs溶液至pH 9.0,取此溶液10 mL,与300 μL 1 mg/mL 羊抗人IgG溶液混合,室温下磁力搅拌反应1 h。12000 r/min离心30 min,收集沉淀,溶解于10 mL 10 mmol/L硼酸盐缓冲液中。随后向体系中加入60 μL 1 mg/mL HSA溶液,室温磁力搅拌40 min,使AuNPs表面的未结合位点得到封闭。将此反应液12000 r/min离心30 min,倾出上层清液。收集红色沉淀,溶解于5 mL 10 mmol/L硼酸盐缓冲液中,得Ab-AuNPs溶液,于4℃放置备用。
2.2.5 测定条件的优化
在1.5 mL 离心管中加入10 μL IgG-QDs溶液和不同量(0, 50, 100, 150, 200和250 μL)的Ab-AuNPs溶液,用含0.05% 吐温-20的10 mmol/L PBS溶液(pH 7.4)调节体积至500 μL。将离心管放入37℃的摇床中,振荡反应1 h后,进行荧光光谱测定(PMT电压950 V,激发波长300 nm,激发和发射狭缝宽度均为10.0 nm)。
2.2.6 人IgG的测定
在1.5 mL 离心管中加入150 μL Ab-AuNPs溶液和不同体积(0, 20, 50, 100, 150 , 200, 250和300 μL)的25 μg/mL人IgG溶液。用含 0.05% 吐温-20的10 mmol/L PBS溶液(pH 7.4)调节体积至490 μL。将离心管放入37℃的摇床中,振荡反应1 h后,加入10 μL IgG-QDs溶液,于37℃的摇床中继续振荡反应1 h。反应结束后,进行荧光光谱测定(PMT电压950 V,激发波长300 nm,激发和发射狭缝宽度均为10.0 nm)。
2.2.7 共存干扰实验
在1.5 mL 离心管中加入150 μL Ab-AuNPs溶液、100 μL 25 μg/mL人IgG溶液和适量的共存干扰物溶液。用含0.05% 吐温-20的10 mmol/L PBS溶液(pH 7.4)调节体积至490 μL。将离心管放入37℃摇床中振荡反应1 h后,加入10 μL IgG-QDs溶液,于37℃的摇床中继续振荡反应1 h。反应结束后,进行荧光光谱测定(PMT电压950 V,激发波长300 nm,激发和发射狭缝宽度均为10.0 nm)。
2.2.8 实际样品的测定
6份人血清样品取自当地医院。将血清样品用含0.05% 吐温-20的10 mmol/L PBS溶液(pH 7.4)稀释400倍。在1.5 mL 离心管中加入150 μL Ab-AuNPs溶液,250 μL 待测样品和适量(0, 20和40 μL) 25 μg/mL人IgG溶液。用含0.05%吐温-20的10 mmol/L PBS溶液(pH 7.4)调节体积至490 μL。将离心管放入37℃的摇床中,振荡反应1 h后,加入10 μL IgG-QDs溶液,于37℃的摇床中继续振荡反应1 h。反应结束后,进行荧光光谱测定(PMT电压950 V,激发波长300 nm,激发和发射狭缝宽度均为10.0 nm)。3 结果与讨论
3.1 Mn掺杂ZnS量子点和AuNPs的表征
SEM结果表明Mn掺杂ZnS量子点颗粒接近球形,粒径约3.5 nm(图1A)。XRD谱图中衍射峰有明显的宽化现象,表明所合成的Mn掺杂ZnS量子点粒子粒径较小。3个衍射峰分别对应于立方型闪锌矿结构的(111)、(220)和(311)3个晶面的衍射,说明所制备的Mn掺杂ZnS量子点为立方形结构。
图1 Mn掺杂ZnS量子点的(A)SEM和(B)XRD图
Fig.1 (A) SEM image and (B) XRD pattem of Mn doped ZnS quantum dots (QDs)
Mn掺杂ZnS量子点的室温磷光发射(RTP)在与IgG偶联后,峰形几乎不变,光强略微降低(图2A)。AuNPs的紫外光谱吸收峰在与羊抗人IgG偶联后有所红移,强度略微降低(图2B)。IgG-QDs的RTP发射光谱和Ab-AuNPs的紫外吸收光谱有部分重叠,有可能发生荧光共振能量转移(FRET)作用(图2C)。
图2 (A)Mn掺杂ZnS量子点(…)和IgG-QDs(—)的RTP发射光谱;(B)AuNPs(…)和Ab-AuNPs(—)的紫外吸收光谱;(C)IgG-QDs的室温磷光(RTP)发射光谱和Ab-AuNPs的紫外吸收光谱
Fig.2 (A) Room temperature phosphorescence (RTP) emission spectra of Mn-doped ZnS QDs and IgG-QDs; (B) Absorption spectra of AuNPs and Ab-AuNPs; (C) RTP emission spectrum of IgG-QDs and absorption spectrum of Ab-AuNPs
3.2 Ab-AuNPs和IgG-QDs比例优化
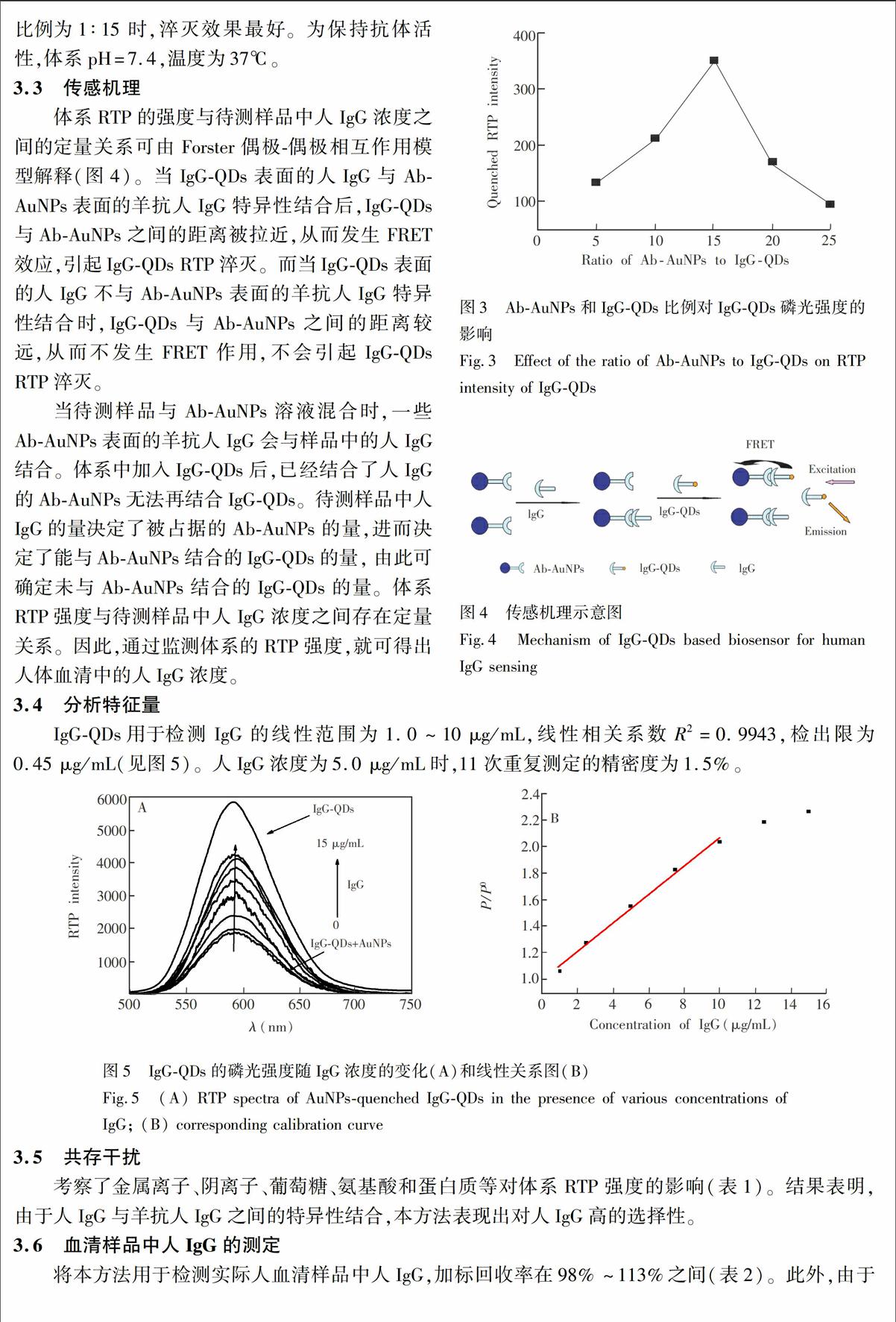
考察了Ab-AuNPs和IgG-QDs比例对IgG-QDs磷光淬灭的影响(图3),当IgG-QDs和Ab-AuNPs的比例为1∶15时,淬灭效果最好。为保持抗体活性,体系pH=7.4,温度为37℃。
图3 Ab-AuNPs和IgG-QDs比例对IgG-QDs磷光强度的影响
Fig.3 Effect of the ratio of Ab-AuNPs to IgG-QDs on RTP intensity of IgG-QDs
3.3 传感机理
体系RTP的强度与待测样品中人IgG浓度之间的定量关系可由Forster偶极-偶极相互作用模型解释(图4)。当IgG-QDs表面的人IgG与Ab-AuNPs表面的羊抗人IgG特异性结合后,IgG-QDs与Ab-AuNPs之间的距离被拉近,从而发生FRET效应,引起IgG-QDs RTP淬灭。而当IgG-QDs表面的人IgG不与Ab-AuNPs表面的羊抗人IgG特异性结合时,IgG-QDs与Ab-AuNPs之间的距离较远,从而不发生FRET作用,不会引起IgG-QDs RTP淬灭。
当待测样品与Ab-AuNPs溶液混合时,一些Ab-AuNPs表面的羊抗人IgG会与样品中的人IgG结合。体系中加入IgG-QDs后,已经结合了人IgG的Ab-AuNPs无法再结合IgG-QDs。待测样品中人IgG的量决定了被占据的Ab-AuNPs的量,进而决定了能与Ab-AuNPs结合的IgG-QDs的量, 由此可确定未与Ab-AuNPs结合的IgG-QDs的量。体系RTP强度与待测样品中人IgG浓度之间存在定量关系。因此,通过监测体系的RTP强度,就可得出人体血清中的人IgG浓度。
3.4 分析特征量
IgG-QDs用于检测IgG的线性范围为1.0~10 μg/mL,线性相关系数R2=0.9943,检出限为0.45 μg/mL(见图5)。人IgG浓度为5.0 μg/mL时,11次重复测定的精密度为1.5%。
图5 IgG-QDs的磷光强度随IgG浓度的变化(A)和线性关系图(B)
Fig.5 (A) RTP spectra of AuNPs-quenched IgG-QDs in the presence of various concentrations of IgG; (B) corresponding calibration curve
3.5 共存干扰
考察了金属离子、阴离子、葡萄糖、氨基酸和蛋白质等对体系RTP强度的影响(表1)。结果表明,由于人IgG与羊抗人IgG之间的特异性结合,本方法表现出对人IgG高的选择性。
3.6 血清样品中人IgG的测定
将本方法用于检测实际人血清样品中人IgG,加标回收率在98%~113%之间(表2)。此外,由于采用磷光模式检测可以消除血清样品背景干扰,而荧光模式下血清样品背景干扰比较明显(图6)。
2.1[BHDFG1*2,WKZQ0W][BG)W][HT5][]
4 结 论
制备了IgG-QDs和羊抗人IgG功能化的金纳米粒子,利用IgG-QDs和羊抗人IgG功能化的金纳米粒子之间的荧光共振能量转移效应,构建了人体血清中人IgG的室温磷光检测新方法。本方法可有效避免基体自发荧光和基质散射光等背景信号的干扰,可用于高选择性检测生物体液中的人IgG。
References
1 Bruchez M, Moronne M, Gin P, Weiss S, Alivisatos A P. Science, 1998, 281(5385): 2013-2016
2 Green M. Angew. Chem. Int. Ed., 2004, 43(32): 4129-4131
3 Medintz I L, Uyeda H T, Goldman E R, Mattoussi H. Nat. Mater., 2005, 4(6): 435-446
4 Michalet X, Pinaud F F, Bentolila L A, Tsay J M, Doose S, Li J J, Sundaresan G, Wu A M, Gambhir S S, Weiss S. Science, 2005, 307(5709): 538-544
5 Pathak S, Davidson M C, Silva G A. Nano Lett., 2007, 7(7): 1839-1845
6 XING Shi-Ge, XIONG Qi-Rong, ZHONG Qiang, ZHANG Yue, BIAN Su-Min, JIN Yong, CHU Xiao-Gang. Chinese J. Anal. Chem., 2013, 43(6): 949-955
邢仕歌, 熊奇荣, 钟 强, 张 悦, 卞素敏, 金 涌, 储晓刚. 分析化学, 2013, 41(6): 949-955
7 Ruedas-Rama M J, Hall E A H. Anal. Chem., 2008, 80(21): 8260-8268
8 Smith A M, Nie S. Acc. Chem. Res., 2010, 43(2): 190-200
9 Wang X, Ruedas-Rama M J, Hall E A H. Anal. Lett., 2007, 40(8): 1497-1520
10 Zhong W W. Anal. Bioanal. Chem., 2009, 394(1): 47-59
11 Zrazhevskiy P, Sena M, Gao X. Chem. Soc. Rev., 2010, 39(11): 4326-4354
12 Ambrosi A, Castaneda M T, Killard A J, Smyth M R, Alegret S, Merkoci A. Anal. Chem., 2007, 79(14): 5232-5240
13 Chen S J, Chang H T. Anal. Chem., 2004, 76(13): 3727-3734
14 Thomas J, Sherman D B, Amiss T J, Andaluz S A, Pitner J B. Bioconjugate Chem., 2007, 18(6): 1841-1846
15 Zhang Y, Li Y, Yan X P. Anal. Chem., 2009, 81(12): 5001-5007
16 He Y, Wang H F, Yan X P. Anal. Chem., 2008, 80(10): 3832-3837
17 Ren H B, Wu B Y, Chen J T, Yan X P. Anal. Chem., 2011, 83(21): 8239-8244
18 CHEN Juan, SUN Jie-Fang, GUO Lei, XIE Jian-Wei, SUN Guo-Xiang. Chinese J. Anal. Chem., 2012, 40(11): 1680-1685
陈 娟, 孙洁芳, 郭 磊, 谢剑炜, 孙国祥. 分析化学, 2012, 40(11): 1680-1685
19 Wang H F, He Y, Ji T R, Yan X P. Anal. Chem., 2009, 81(4): 1615-1621
20 DU Bao-An, LIU Cheng, CAO Yu-Hong, CHEN Li-Na. Spectroscopy and Spectral Analysis, 2014, 34(4): 1070-1074
杜保安, 刘 澄, 曹雨虹, 陈丽娜. 光谱学与光谱分析, 2014, 34(4): 1070-1074
21 Wang H F, Li Y, Wu Y Y, He Y, Yan X P. Chem. Eur. J., 2010, 16(43): 12988-12994
22 Wu P, He Y, Wang H F, Yan X P. Anal. Chem., 2010, 82(4): 1427-1433
23 Yan H, Wang H F. Anal. Chem., 2011, 83(22): 8589-8595
24 Zhuang J Q, Zhang X D, Wang G, Li D M, Yang W S, Li T J. J. Mater. Chem., 2003, 13(7): 1853-1857
25 Liang G X, Pan H C, Li Y, Jiang L P, Zhang J R, Zhu J J. Biosen. Bioelectron., 2009, 24(12): 3693-3697
26 Wang S P, Mamedova N, Kotov N A, Chen W, Studer J. Nano Lett., 2002, 2(8): 817-822
27 Zhu D, Jiang X X, Zhao C, Sun X L, Zhang J R, Zhu J J. Chem. Commun., 2010, 46(29): 5226-5228
28 Liu J M, Li Y, Jiang Y, Yan X P. J. Proteome Res., 2010, 9(7): 3545-3550
29 Ojea-Jimenez I, Puntes V. J. Am. Chem. Soc., 2009, 131(37): 13320-13327
30 Zhang C, Wu F B, Zhang Y Y, Wang X, Zhang X R. J. Anal. At. Spectrom., 2001, 16(12): 1393-1396

