溶氧对红曲菌发酵生物合成橙色素的影响
张慧娟, 朱效刚, 毛 鹏, 牛国强, 赵 杰, 许赣荣,*
(1.深圳万乐药业有限公司,广东深圳 518029;2.山东梁山正大菱花生物科技有限公司,山东济宁 272600;3.江南大学生物工程学院,江苏无锡 214122)
溶氧对红曲菌发酵生物合成橙色素的影响
张慧娟1, 朱效刚2, 毛 鹏3, 牛国强3, 赵 杰2, 许赣荣3,*
(1.深圳万乐药业有限公司,广东深圳 518029;2.山东梁山正大菱花生物科技有限公司,山东济宁 272600;3.江南大学生物工程学院,江苏无锡 214122)
研究了溶氧对红曲菌在发酵罐中生物合成橙色素的影响。分别采用不同通气量和搅拌转速以达到不同溶氧水平,考察不同溶氧水平下红曲菌w1夏在10 L发酵罐中生产橙色素的情况,并将优化后条件放大至50 L发酵罐中。结果表明,不同通气量水平下底物消耗、pH值和溶氧情况相似,但最终橙色素色价不同,基本上呈现出随通气量增加,色价呈现上升趋势;搅拌转速升高,菌体量和色价均随之升高,但涨幅不大;50 L罐中菌体生长和橙色素合成结果验证了10 L罐结果。在大规模生产时应尽可能采用高的通气量和适宜的搅拌转速,达到较高的溶氧水平,以利于菌体生长和橙色素合成。
红曲;橙色素;发酵条件;色价;溶氧
随着消费者对合成色素在食用安全方面的潜在危害的不断重视,近年来天然色素在食品工业中的应用逐年增加[1]。天然色素中使用最广泛的就是红曲色素,红曲产品在食品中的应用已有上千年历史[2]。在红曲色素的混合物中,从感观上来看,橙色素是最为鲜艳夺目的色素,因其颜色较为独特、醒目,在众多需要着色剂的产品中都可找到其应用前景。另外,橙色素除色素本身的功能以外,还具有抑菌性及增强免疫力、抗疲劳、降血脂、抗肥胖及降血糖的功效[3-6],因此是值得开发的红曲色素品种。目前国内对红曲橙色素的研究极少,仅限于小样试制,尚未实现大规模生产。
红曲霉生产红曲色素不仅受培养基组成的影响,培养条件对色素种类和色价也有显著影响[7-8],尤其溶氧条件是需氧发酵控制最重要的参数之一[9]。氧在水中的溶解度很小,在发酵液中亦是如此,因此,发酵过程中需要不断通气和搅拌,才能满足红曲橙色素对氧的需求。不同通气量和搅拌转速直接影响溶氧水平的高低,进而对菌体生长和色素生成产生不同的影响。从发酵工程专业的角度来说,机械搅拌发酵罐进行放大实验时,搅拌转速和通风量是影响溶氧的两个关键参数,因此在发酵时必须研究。
张慧娟等[10-12]最早对红曲橙色素基本性质、液态发酵及红曲橙色素的制备方法等方面做了详细的研究。近年来国内对红曲橙色素的研究逐渐增多,但研究方向多偏向于橙色素的合成机制、特性、检测方法、功能、分子结构及作用活性等方面。从橙色素的生产方法看,大多采用红曲米固态发酵,通过浸提法生产橙色素[13-17]。虽然张慧娟等开始了液态法生产橙色素,但试验仅限于摇瓶发酵,且当时发酵水平总体较低,关于溶氧对红曲菌液态发酵生产橙色素的影响这一专题还缺乏深入研究。因此,为了确定溶氧对发酵生产橙色素的影响,本研究设计了不同通气量及搅拌转速等影响溶氧的条件,研究了发酵罐橙色素色价生产情况。
1 材料与方法
1.1 菌种
红曲霉菌种编号为红曲菌w1夏,江南大学固态发酵研究室保藏菌种,该菌株具有良好的橙色素生产能力。
1.2 材料与试剂
PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20,自然pH值。
种子培养基(g/L):玉米淀粉40,玉米浆粉10,酵母膏10,KH2PO42.0,K2HPO42.0,MgSO4·7H2O 0.5,初始pH值为4.0。
发酵基本培养基(g/L):玉米淀粉60,硫酸铵5.0,KH2PO42.0,K2HPO42.0,MgSO4·7H2O 0.5,CaCl20.1,FeSO4·7H2O 0.01,ZnSO4·7H2O 0.01,MnSO4·H2O 0.03,NaNO32.0,初始pH值为4.0。
1.3 仪器与设备
HY-G-a型回旋式恒温调速摇床柜,上海跃进医疗器械厂;U3900型紫外可见分光光度计,日立高新技术公司;PYX-XHS-405型电热恒温培养箱,上海跃进医疗器械厂;KDC-16H型台式高速冷冻离心机,Sigma公司。GS-8100型10 L发酵罐、GS-8100型50 L发酵罐,上海广世生物工程设备有限公司。
1.4 实验方法
1.4.1 菌种的培养
将PDA培养基上的斜面菌种在30℃下恒温培养7~10 d,刮取斜面孢子,制备孢子悬浮液,接种于种子培养基中,在30℃,180 r/min培养2~3 d后即为种子液。
1.4.2 10 L发酵罐中通气量对橙色素发酵影响实验
红曲橙色素液态发酵方法参照许赣荣专利[17]。
发酵罐装液量约60%,培养基体积为5.6 L,种子液体积为200 mL;培养温度为30℃;转速为150 r/min;培养周期为6 d;在培养过程中分别设通气量为0.5∶1,1∶2,1∶3三个梯度,考察不同通气量对橙色素生产的影响。
1.4.3 10 L发酵罐中转速对橙色素发酵影响实验
通气量为1∶3;培养周期为6 d;在培养时分别控制搅拌转速为100,200,300 r/min三个梯度,考察不同转速对橙色素生产的影响。其他条件同1.3.2。
1.4.4 优化溶氧条件后放大至50 L发酵罐中发酵方法
装液量约60%,培养基体积为28 L,种子液体积为1 L;培养温度为30℃;转速为200 r/min;通气量1∶0.9(50 L罐最大通气量水平);培养周期为6 d。
1.4.5 菌体量的测定
将发酵液充分混合均匀后精确量取10 mL过滤,滤渣用蒸馏水洗涤3次,用烘干至恒重的滤纸(m1)抽滤,105℃烘干至恒重。用电子天平称菌体和滤纸总重量,记作m2。菌体量记作X,见式(1)。

1.4.6 发酵液色价及色调的测定[18]
将发酵液研磨混匀后取5 mL于50 mL比色管中,用75%的乙醇定容至50 mL,置于55℃恒温水浴中浸提1 h。冷却至室温后在6 000 r/min转速下离心5 min。用相同浓度的乙醇稀释,并以同种乙醇为空白对照,在465 nm处进行全波长扫描,测定OD值,见式(2)、式(3)。
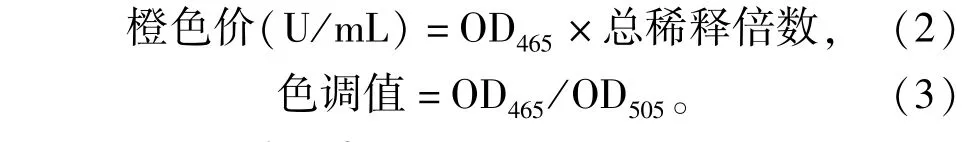
1.4.7 总糖的测定
本实验碳源是玉米淀粉,采用苯酚硫酸法测定发酵液中的总糖含量[19]。
1.4.8 氮源测定
采用凯氏定氮法测定发酵液中的氮源含量。
2 结果与分析
2.1 10 L罐中红曲橙色素发酵实验结果分析
分别对不同通气量和不同搅拌转速时的底物消耗、发酵过程中pH值和溶氧变化等情况进行分析。
2.1.1 10 L罐中通气量对橙色素发酵底物消耗及色价的影响
图1为3个不同通气量水平下碳氮源消耗及橙色素色价情况。由图1(a)可见,通气量为1∶0.5时碳氮源消耗较慢,发酵第7天时残糖质量浓度依然在15 g/L以上,氮源硫酸铵也有1/3残余;由图1(b)、(c)可见,通气量为1∶2和1∶3时,氧的供应相对充足,发酵第7天时发酵底物碳氮源均消耗殆尽。
另外,各通气量情况下橙色素色价增长均呈现相似趋势。48 h前基本无橙色素产出,色价基本持续为0;48 h后随着菌体生长进入对数生长期后,橙色素也开始产出,且菌体量快速增加,橙色素的产出速率也不断增加。不同通气量水平最终导致橙色素色价有所不同,基本上是随通气量增加,色价呈现上升趋势。
总之,随着通气量的不断增加,碳氮源消耗速率也相应加快,底物消耗殆尽的时间也不断提前。1∶3最大通气量时,碳源在第4天即降至接近零水平,氮源在发酵至第7天接近零水平;橙色素色价随着通气量增加也不断升高,最大通气量1∶3时发酵至第7天,色价达到369.1 U/mL。

图1 不同通气量时碳氮源消耗及产物产出情况Fig.1 Change of substrate consumption and production under 0.5∶1,1∶2 and 1∶3 ventilation
2.1.2 10 L罐中通气量对橙色素发酵过程pH值和溶氧等参数的影响
图2为3个不同通气量水平下溶氧及pH值变化情况。由图2可见,3种通气水平时溶氧变化趋势基本一致。在30 h前,菌体生长处于延滞期,生长缓慢,需氧量不大,发酵液中溶氧保持在较高水平,基本在90%以上;在30~60 h,伴随着菌体生长进入对数生长期,菌体的快速生长需要消耗大量氧气,以至于发酵液中溶氧水平急剧下降。除1∶3通气量时供氧量相对较高外,其他降低组溶氧水平在60 h后将至10%以下,说明通气量相对于菌体生长略显不足;在132 h后溶氧水平又呈现出略有回升的趋势,这是因为菌体在生长后期,生长活力下降,菌体开始进入衰亡期,相应需氧量降低,在不变的通气量情况下,发酵液中的溶氧开始回升。
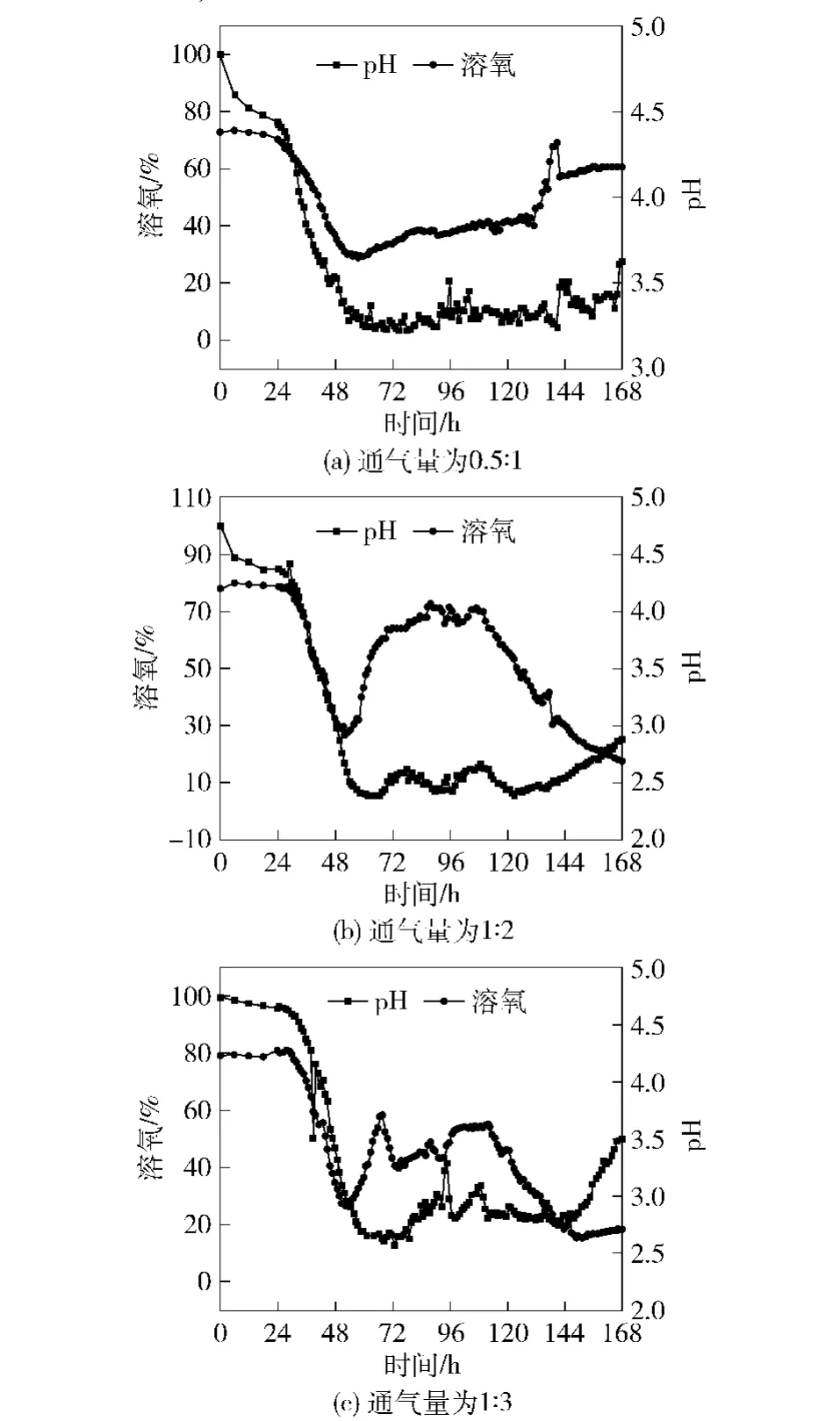
图2 不同通气量时溶氧及pH值变化Fig.2 Change of DO and pH under 0.5∶1,1∶2 and 1∶3 ventilation
3种通气水平时pH值变化在前期基本相似。30 h之前菌体处于延滞期,pH值基本维持在设定的4.0左右;在30~54 h,随着菌体进入对数生长期,发酵液中碳源大量被利用,菌体生长代谢产生乳酸等酸性代谢产物,导致发酵液pH值呈现快速下降趋势。54 h后,随着发酵液中碳源的不断减少,碳源即成为菌体生长的限制性因素。在直接碳源不足的情况下,菌体会利用含氨基酸的氮源及代谢产物乳酸等作为碳源供菌体生长。由于氨基酸代谢及乳酸的利用均会增加pH值,所以后期pH值又呈现回升趋势。发酵结束,通气量为0.5∶1时,相对于高通气量的1∶2和1∶3组,因为通气量较小,菌体生长缓慢,橙色素产出同时消耗的碳氮源底物相对较低。最终结束时氮源利用尚不完全,所以pH值仍维持在4.0~4.5。高通气量组因为溶氧一直处于相对充足的水平,菌体生长直至发酵液中碳氮源底物均消耗殆尽,所以最终发酵结束时pH值较低,仅有2.7左右。
2.1.3 10 L罐搅拌转速对橙色素发酵的影响
搅拌可以防止气泡聚集,使液体形成湍流,增加气液接触时间,将空气通过搅拌桨叶端的高速剪切力破碎成小气泡。从而明显增大有效气液传递面积,增大液体流动速度,减少双膜理论中气液界面滞留层的厚度,降低传质阻力,改善溶氧[20]。因此,需在合理范围内控制搅拌转速。
在1∶3通气条件下,分别设定发酵转速为100,200,300 r/min,考察了转速对菌体量和橙色素色价的影响,结果见图3。图3显示,转速升高,最终菌体量和橙色素色价也随之升高,但涨幅不大。3个搅拌转速下,发酵6 d,橙色素色价分别达到317,336,350 U/mL。通气量一定的条件下,随着转速升高,发酵液内的溶氧也相应提高。红曲菌代谢对氧的需求量大,较高的溶氧条件下,糖消耗快,相对更有利于菌体的生长及色素的产生。搅拌转速达到200 r/min后,随着搅拌转速的增加,菌体和橙色素色价增长幅度不大,说明转速并不是越大越好。另外,盲目提高转速不仅会大幅增加搅拌功率,同时会使菌体受到剪切力的破坏,不利于发酵的进行。
2.2 优化溶氧条件放大至50 L发酵罐中发酵结果
根据10 L发酵罐中溶氧条件试验结果可知,通气量和搅拌转速增加后溶氧水平会相应提高,对菌体生长和橙色素合成有利。在此结论基础上,根据50 L罐的最大允许设置条件,确定50 L罐上通气量为1∶0.9,转速为200 r/min,发酵结果见图4和图5。

图3 不同搅拌转速下菌体量及色价的变化Fig.3 Biomass and color value under different stirring speed

图4 50 L罐发酵过程中总糖、菌体量和色价的变化Fig.4 Change of total sugar,biomass and color value in 50 L bioreactor
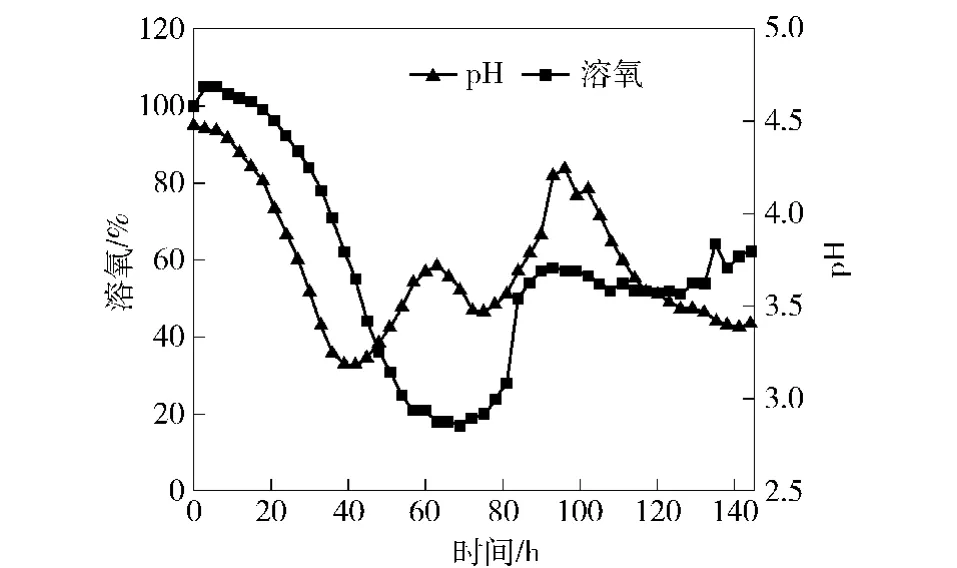
图5 50 L罐发酵过程中pH值和溶氧变化Fig.5 Change of DO and pH in 50 L bioreactor
由图4、图5可知,50 L罐中底物消耗(总糖)情况与10 L罐中1∶2和1∶3通气量时相似。72 h前底物随着菌体量的对数生长期快速增加而迅速消耗,总糖浓度快速下降;72 h后随着菌体量达到最大值且处于稳定期后,橙色素色价开始快速增加;直到144 h底物消耗殆尽,菌体生长处于衰亡期,色价已没有明显增加趋势。结束发酵时最终橙色素色价达到347 U/mL。
发酵过程中,pH值和溶氧变化也基本与10 L罐中相似。发酵全程中pH值维持在3.0以上,在24 h之前菌体处于延滞期,pH值变化不大;24~40 h菌体处于对数生长期,随着菌体的快速生长及底物碳源的不断利用,pH值迅速下降;随着氮源的不断利用及发酵过程中乳酸的再利用,使得pH值呈现波动状况,最终结束时pH值为3.4。溶氧全程在15%以上,说明所采用的通气量和搅拌转速足以维持菌体生长所需的溶氧。同样在菌体达到最大值时,溶氧最低为17%;随着菌体生长变慢,需氧量降低,溶氧逐渐呈现回升状态,最终结束发酵时溶氧在62%左右。
总之,50 L罐中菌体生长和橙色素生产情况与10 L罐中采用较高通气量和适宜转速时结果一致。
3 讨 论
红曲橙色素的液态发酵法生产具有机械化、自动化程度高,易于控制,生产色素含量高,杂质少,应用范围广等优点。液态发酵时采用的培养基、培养液pH值及溶氧等水平都会影响菌体生长和橙色素的合成,因此,需要针对不同菌种及色素种类优化相应的发酵条件。
发酵液中的溶氧浓度是影响发酵的关键因素,对菌体的生长和色素的合成都有重要的影响,需要根据氧的溶解特性及菌体对氧的需求,分析溶氧对发酵和产物的影响,进而确定溶氧量的控制,使生产效益最大化[21]。
红曲橙色素生物合成过程为典型的好氧发酵,溶氧水平的高低会直接影响色素色价,因此,在发酵过程中需要不断通风和搅拌。本实验通过在10 L发酵罐中分别采用不同通气量和不同搅拌转速获得不同溶氧水平,考察不同溶氧水平对红曲菌w1夏生产橙色素的影响,结果发现不同通气量水平时,底物消耗、pH值和DO的变化趋势相似,但最终橙色素色价不同,基本上呈现出随通气量增加,色价呈现上升趋势;搅拌转速升高,色价也随之升高,但涨幅不大;该结果同样在50 L罐中得到验证。50 L罐采用所能设置的最大通气量(1∶0.9)和200 r/min搅拌转速,菌体生长和橙色素合成结果均达到10 L罐结果。50 L罐中橙色素色价达到347 U/mL,远超过目前文献上报道的液态发酵生产红曲色素的色价123.8 U/mL[22]和170.6 U/mL[23]。
4 结 论
本实验结果可以说明,在红曲橙色素生产时,溶氧是关键影响因素之一,而提高溶氧的措施就是提高搅拌转速和增加通气量。应尽可能在不影响菌体生长的前提下采用高的通气量和适宜的搅拌转速。较高的通气量和适宜的搅拌转速可以达到较高的溶氧水平,以利于菌体生长和橙色素合成。影响红曲橙色素生物合成的培养条件很多,除溶氧外,发酵液的pH值控制、温度控制以及补料策略等都会对菌体生长和色素形成产生影响。随着色素工业化生产的要求的不断提高,可以在溶氧条件的基础上更科学的优化其他发酵条件,将橙色素色价不断提高。
[1] Rose M,Anderson C,Francielo V.Monascus pigment production in bioreactor using a co-product of biodiesel as substrate[J].Tecnologia de Alimentos,2013,33(1):9-13.
[2] Hsu L C,Liang Y H,Hsu Y W.Anti-inflammatory properties of yellow and orange pigments from Monascus purpureus NTU 568[J].Agric Food Chem,2013,61(11):2796-802.
[3] Treiber L R,Reamer R A,Rooney C S,et al.Origin of Monacolin L.from Aspergillus terreus cultures[J].J antibiot,1989,42(1):30-36.
[4] 宫慧梅,赵树欣.红曲中橙色素的研究[J].食品研究与开发,2002,23:24-26.
[5] 邹宇,侯红漫.红曲霉抑菌活性物质与桔霉素的研究进展[J].食品研究与开发,2005,26(1):20-22.
[6] Choe D,Lee J,Woo S,et al.Evaluation of the amine derivatives of Monascus pigment with anti-obesity activities[J].Food Chemistry,2012,134:315-323.
[7] 郭红珍,王秋芬,马立芝.不同培养条件对红曲霉产红曲色素的研究[J].食品科学,2008,29(1):215-218.
[8] 邱鹏,袁永俊,豆剑伟,等.培养条件对红曲色素发酵过程中生物量与色价的影响[J].广东化工,2015,42(2):10-12.
[9] 张智,滕婷婷.工业发酵中溶氧因素的探讨[J].中国酿造,2008,23(12):4-6.
[10] 张慧娟,沈良俊,许赣荣.红曲橙色素的提取及其稳定性研究[J].食品与发酵工业,2005,31(12):129-133.
[11] 张慧娟,陶冠军,陈蕴,等.红曲色素的制备及HPLC和LC/MS检测方法[J].食品研究与开发,2006,27(4):112-115.
[12] 张慧娟.红曲橙色素的研究[D].无锡:江南大学,2006.
[13] Liu Yi,Wu Li,Lü Qingzhang.DFT/TDDFT study on the photodissociation mechanism of the original Monascus red and orange pigments[J].Spectrochimica Acta Part A,2015,145:181-187.
[14] 连喜军,陈学军,罗庆丰,等.用喷雾质谱法分析2种红曲霉所产橙色素的组成[J].生物技术通讯,2005,16(6):642-644.
[15] Hsu Y W,Hsu L C,Liang Y H,et al.New bioactive orange pigments with yellow fluorescence from Monascus fermented dioscorea[J].Journal of Agricultural and Food Chemistry,59(9):4512-4518.
[16] Feng Yanli,Shao Yanchun,Chen Fusheng.Monascus pigments[J].Applied Microbiology and Biotechnology,96(6):1421-1440.
[17] 许赣荣,黄艳,毛鹏,等.一种偶联原位发酵萃取红曲橙色素的双液相发酵方法:中国.201410117001.4[P].2014-03-27.
[18] Lian X J,Wang C L,Guo K L.Identification of new red pigments produced by Monascus ruber[J].Dyes Pigments,2007(73):121-125.
[19] 姜琼,谢妤.苯酚-硫酸法测定多糖方法的改进[J].江苏农业科学,2013,41(12):316-318.
[20] 黄荣.发酵过程中溶氧的影响及调控[J].生物技术世界,2013(3):68.
[21] 张智,滕婷婷,王淼.溶氧对发酵的影响及控制[J].科技视野,2008,21:63-64.
[22] 游玟娟,鄢东.采用响应曲面法优化红曲色素液态发酵条件[J].中国调味品,2011,36(8):24-27.
[23] 季鸿飞.红色红曲菌pksCT基因缺失株的构建及其固液态发酵生产红曲色素的研究[D].南昌:南昌大学,2008.
Effects of Dissolved Oxygen on Biosynthesis of Orange Pigments in Monascus Fermentation
ZHANG Huijuan1, ZHU Xiaogang2, MAO Peng3, NIU Guoqiang3, ZHAO Jie2, XU Ganrong3,*
(1.Shenzhen Main Luck Pharmaceuticals Inc.,Shenzhen,518029,China;2.Liangshan Chia Tai Ling Hua Bio-Tech Co.Ltd.,Jining 272600,China;3.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Effect of dissolved oxygen(DO)on the biosynthesis of orange pigments in Monascus fermentation was investigated in this study.The orange pigments production of the w1 Xia strain in a 10 L bioreactor under different DO levels obtained using different ventilatory volumes and stirring speeds were studied.And the optimized conditions were applied in a 50 L bioreactor.The results showed that the changing trend of substrate consumption,pH,and DO was similar under different ventilatory volume conditions,but the color value of orange pigments increased along with the ventilatory volume augment.The stirring speed did not have significantly effects on the biomass and color value of orange pigments.Meanwhile,the orange pigments production in a 50 L bioreactor was similar to that in a bioreactor.In conclusion,the higher ventilatory volume and adapted stirring speed were beneficial to the biomass and orange pigments production.
Monascus;orange pigment;fermentation conditions;color value;dissolved oxygen
TS202;Q815
A
(责任编辑:叶红波)
10.3969/j.issn.2095-6002.2015.06.012
2095-6002(2015)06-0072-06
张慧娟,朱效刚,毛鹏,等.溶氧对红曲菌发酵生物合成橙色素的影响[J].食品科学技术学报,2015,33(6):72-77.
ZHANG Huijuan,ZHU Xiaogang,MAO Peng,et al.Effects of dissolved oxygen on biosynthesis of orange pigments in Monascus fermentation[J].Journal of Food Science and Technology,2015,33(6):72-77.
2015-04-17
“十二五”国家科技支撑计划项目(2011BAD23B02)。
张慧娟,女,工程师,硕士,主要从事发酵工程方面的研究;
*许赣荣,男,教授,主要从事微生物发酵方面的研究。通信作者。

