苦荞籽粒黄酮的提取纯化及抗氧化活性研究
李 飞, 任 清, 季 超, 侯 昌
(北京工商大学食品学院,北京 100048)
苦荞籽粒黄酮的提取纯化及抗氧化活性研究
李 飞, 任 清*, 季 超, 侯 昌
(北京工商大学食品学院,北京 100048)
利用响应面分析法对苦荞籽粒总黄酮提取工艺进行研究。以苦荞粉为原料,通过单因素实验考察液料比、乙醇浓度、提取温度、提取时间4个因素对黄酮提取率的影响,利用Design-Expert 8.0.6软件中的Box-Behnken中心组合设计进行响应面试验,建立二次回归方程,得到苦荞籽粒黄酮的较佳提取工艺为:液料比(mL/g)20∶1,乙醇体积分数75%,提取温度70℃,提取时间4 h,此条件下提取率为2.632%。通过测定纯化后苦荞籽粒黄酮对O-2·的清除率、抗脂质过氧化能力、还原力和DPPH自由基清除率,分析其抗氧化能力,并用抗坏血酸做阳性对照,结果显示苦荞籽粒总黄酮具有还原力。通过SPSS软件分析,得到其抗脂质过氧化能力、清除O-2·能力和清除DPPH能力的IC50值分别1.115,0.498,2.235 μg/mL,表明苦荞籽粒黄酮具有较强的抗氧化活性。
苦荞籽粒;黄酮;响应面分析;抗氧化活性
苦荞(Fagopyrum tataricum)是一年生的双子叶作物,蓼科(Polygonaceae),荞麦属(Fagopyrum)。它是一种药食两用作物,含有的蛋白质、氨基酸、淀粉、粗纤维和黄酮类化合物等都高于普通荞麦[1]。苦荞中还富含酚类、无机盐和微量元素等多种活性成分,其中主要是黄酮类化合物和糖醇[2]。这些活性物质的存在赋予了苦荞降血脂、降血糖[3-4]等功效。
苦荞黄酮类是苦荞中一种重要的活性物质,有抗氧化、抗肿瘤降血脂、降血压、增强心血管功能[5]的特殊功效,因此通过对苦荞籽粒黄酮提取条件的优化来提高苦荞黄酮的提取率有非常重要的意义。响应面法越来越多地应用于各种优化试验中,它可以通过较少的试验次数得到最优的提取条件[6]。对自由基的清除率及物质的还原力是反映该种物质抗氧化能力强弱的重要指标。许多研究表明,氧自由基及其引起的脂质过氧化反应与一些免疫性损伤和炎性损伤有很大的关系。而黄酮类物质作为一种天然的抗氧化剂,具有很高的研究价值和应用价值。
本实验以溶液浸提法在脱脂苦荞粉中提取黄酮,通过单因素实验,采用统计软件Design-Expert 8.0.6中响应曲面法的Box-Behnken模式对苦荞黄酮的提取条件进行优化,确定苦荞黄酮最佳的提取工艺;通过测定样品清除O-2·的能力、抗脂质过氧化能力、还原力和清除DPPH自由基的能力4个方面来分析和评价苦荞籽粒黄酮的抗氧化活性,为苦荞黄酮天然抗氧化剂的开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
苦荞麦产于河北张家口市农业科学院。大孔吸附树脂,北京迪朗生化科技有限公司;芦丁对照品(98%),百灵威科技有限公司;抗坏血酸,北京拜尔迪生物技术有限公司。
DPPH为进口分装试剂,三氯乙酸(TCA)、硫代巴比妥酸(TBA)、硫酸亚铁、铁氰化钾、邻苯三酚、磷酸盐缓冲液(PBS)、Tris-HCl、三氯化铁、水杨酸等均为国产分析纯。
1.2 仪器与设备
FW-100型高速万能粉碎机,北京中兴伟业仪器有限公司;DSHZ-300A型水浴恒温振荡器,太仓市实验设备厂;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;T6型新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司;TDL-5-A型离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 苦荞黄酮的提取[7]
将苦荞籽粒清洗,50℃烘箱干燥24 h,粉碎,过100目筛,60~90℃石油醚于恒温水浴摇床中60℃脱脂9 h,减压抽滤,干燥,得脱脂苦荞粉。准确称取4.00 g脱脂苦荞粉,加入不同浓度的乙醇溶液,于恒温水浴摇床中提取一定时间,提取液减压抽滤后得苦荞黄酮样品液。样品液经真空浓缩、冷冻干燥得到苦荞黄酮粗提物。将苦荞黄酮粗提物以一定浓度复溶于去离子水中,大孔树脂吸附纯化得苦荞总黄酮。
1.3.2 黄酮含量的测定
将黄酮样品液用体积分数70%乙醇溶液定容至一定体积,混匀,以芦丁为对照品,采用NaNO2-Al(NO3)3-NaOH分光光度法[8]测定样品液中的黄酮含量。
1.3.3 芦丁标准溶液的配制和标准曲线的制作
1.3.3.1 标准溶液的配制
将芦丁标准品于120℃烘箱中烘至恒重,于干燥器中冷却,精密称取0.030 g冷却后的芦丁标准品,用体积分数70%的乙醇溶解,定容至100 mL,得质量浓度为0.300 mg/mL芦丁标准液。
1.3.3.2 标准曲线的制备[9]
分别准确吸取芦丁标准液0,1.0,2.0,3.0,4.0,5.0,6.0 mL于25 mL比色管中,用70%乙醇定容至12.5 mL,加入质量分数为5%的NaNO2溶液0.7 mL,混匀,静置5 min后加入质量分数为10%的Al(NO3)3溶液0.7 mL,静置6分钟后加入浓度为1 mol/L的NaOH溶液5 mL,70%乙醇定容至25 mL,混匀,静置10 min后用1 cm比色皿于510 nm波长处测定吸光度,同时用70%乙醇溶液代替芦丁标准液作为参比,以所测得的吸光度A为横坐标,芦丁质量浓度Y(mg/mL)为纵坐标绘制标准曲线。求得芦丁质量浓度Y与吸光度A的回归方程:Y=2.005A+0.007 2,方程R2为0.999 6,说明该方程在0~1.8 mg/mL呈良好的线性关系。
1.3.4 总黄酮含量的测定
准确吸取1.0 mL稀释一定倍数的苦荞黄酮粗样品液于25 mL比色管中,按照1.3.3.2节方法测定吸光度,根据回归方程得出苦荞黄酮的质量浓度,计算出苦荞中总黄酮的提取率,见式(1)。
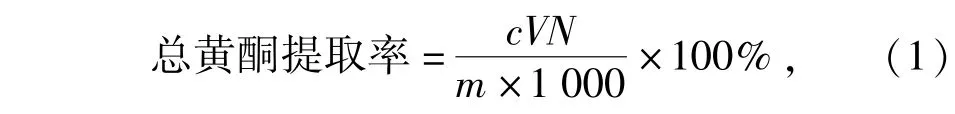
式(1)中,c为计算得出的黄酮质量浓度,mg/mL;V为定容的体积,mL;N为样品稀释倍数;m为脱脂苦荞粉的质量,g。
1.4 单因素实验
液料比的确定:取脱脂苦荞粉4.00 g,按液料比(mL/g)分别为5∶1,10∶1,15∶1,20∶1,25∶1加入体积分数为70%的乙醇,于水浴恒温振荡器中70℃提取4 h,减压抽滤,测浸提液中黄酮含量。
乙醇浓度的确定:取脱脂苦荞粉4.00 g,按液料比15∶1分别加入体积分数为50%,60%,70%,80%,90%的乙醇,于水浴恒温振荡器中70℃提取4 h,减压抽滤,测浸提液中黄酮含量。
提取温度的确定:取脱脂苦荞粉4.00 g,按液料比15∶1分别加入体积分数为70%的乙醇于水浴恒温振荡器中分别在50,60,70,80℃条件下提取4 h,减压抽滤,测浸提液中黄酮含量。
提取时间的确定:取脱脂苦荞粉4.00 g,按液料比15∶1分别加入体积分数为70%的乙醇于水浴恒温振荡器中,70℃分别提取2,3,4,5,6 h,减压抽滤,测浸提液中黄酮含量。
1.5 苦荞籽粒黄酮提取响应面法优化分析
本试验采用Design-Expert 8.0.6软件中的Box-Behnken中心组合试验设计原理设计响应面实验。实验选取液料比、乙醇浓度、提取温度、提取时间4个对苦荞黄酮提取率影响较大的因素,根据单因素实验结果对提取工艺进行四因素三水平的响应面试验设计与分析。
1.6 AB-8型树脂纯化工艺
1.6.1 树脂的预处理
将大孔树脂于一定量体积分数为95%乙醇溶液中浸泡24 h,用乙醇洗至留出液加水不浑浊,去离子水浸泡,洗至无醇味后备用[10]。
1.6.2 AB-8型大孔树脂的静态吸附及解析
准确称取处理好的AB-8型树脂,按比例加入已知浓度的苦荞籽粒粗黄酮溶液,室温下吸附6 h,每隔一定时间用分光光度法测定吸附后溶液中黄酮含量。吸附后溶液减压抽滤,得吸附后树脂,加入一定量70%乙醇溶液,室温解析4 h,每隔一定时间测定解吸溶液中的黄酮含量。将解析液进行减压抽滤,滤液经真空浓缩除去乙醇,冷冻干燥,得纯化后的苦荞籽粒黄酮,按1.3.2的方法测定黄酮纯度。吸附量Q(mg/g)和解析率(%)的计算公式如式(2):

式(2)中,Q为每克树脂的吸附量,mg/g;P为树脂的解析率,%;C0为初始溶液质量浓度,mg/mL;Ct为吸附后溶液质量浓度,mg/mL;Cp为解析后溶液质量浓度,mg/mL;Vp为解析后溶液体积,mL;V0为初始溶液体积,mL;Vt为吸附后溶液体积,mL;W为湿树脂质量,g。
1.7 苦荞籽粒黄酮抗氧化性的测定
1.7.1 测定清除O2-·自由基能力[11]
采用邻苯三酚自氧化测定:取pH 8.2,0.05 mol/L的Tris-HCl缓冲液4.5 mL,去离子水4.2 mL,25℃保温20 min,立即加入0.3 mL以10 mmol/L HCl配制的邻苯三酚溶液,快速混匀,倒入比色皿,每隔30 s测其320 nm处的吸光度,HCl溶液代替邻苯三酚作为参比,计算线性范围内每分钟吸光度的增加值ΔA0。
苦荞籽粒黄酮活性测定:先分别加入1.0 mL各梯度质量浓度的黄酮溶液和3.2 mL蒸馏水,再加邻苯三酚并进行后续操作,计算线性范围内每分钟吸光度的增加值ΔA1。抗坏血酸作阳性对照。
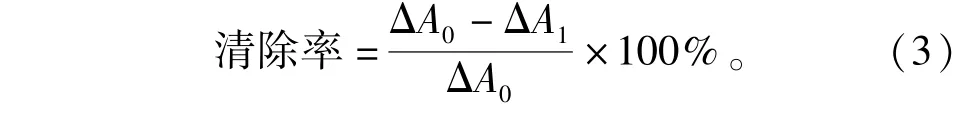
1.7.2 测定抗脂质过氧化能力[12]
将1 mL 10 mg/mL大豆卵磷脂溶液、1 mL 0.4 mmol/L的硫酸亚铁溶液及1 mL样品依次加入到10 mL离心管。避光37℃水浴60 min,加入TCATBA-HCl混合液2 mL,95℃水浴15 min,冷水冷却,4 000 r/min的转速离心10 min,测上清液在535 nm处吸光度Ap,1 mL去离子水代替卵磷脂作参比。空白管以1 mL去离子水代替样品,测其吸光度Aq。抗坏血酸作阳性对照。
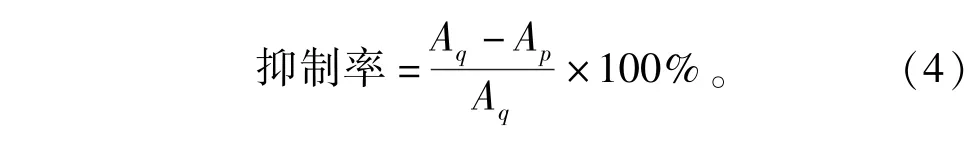
1.7.3 测定还原力[11]
向比色管中依次加入pH 6.6的PBS 2.5 mL、质量分数为l%的K3Fe(CN)6溶液2.5 mL和不同质量浓度的样品溶液2.5 mL,混匀,50℃水浴20 min,快速冷却,加入质量分数为10%TCA溶液2.5 mL,4 000 r/min离心10 min。取5.0 mL上清液,加入蒸馏水4.0 mL和质量分数为0.1%的FeCl3溶液1.0 mL,充分混匀,静置10 min后,700 nm波长处测吸光度。抗坏血酸做阳性对照,吸光度越大则还原力越强。
1.7.4 测定清除DPPH自由基的能力[13]
取2 mL 2×10-4mol/L DPPH的乙醇溶液2 mL及不同质量浓度样品溶液2 mL,依次加入比色管中,混匀,室温放置30 min,以无水乙醇作参比,测其在517 nm波长下的吸光度。相同方法测定2 mL无水乙醇与2 mL DPPH溶液混合后的吸光度A1,以及2 mL样品液与2 mL无水乙醇混合后的吸光度A2,抗坏血酸做阳性对照,计算样品对DPPH的抑制率:

2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对苦荞籽粒总黄酮提取率的影响
液料比和黄酮提取率的关系如图1。由图1可知,随着液料比的增加,苦荞总黄酮提取率也逐渐增大。当液料比为15∶1(mL/g)时,苦荞黄酮提取率达到峰值,超过该比例后,黄酮提取率略有所下降后趋于稳定,故选择液料比为15∶1。
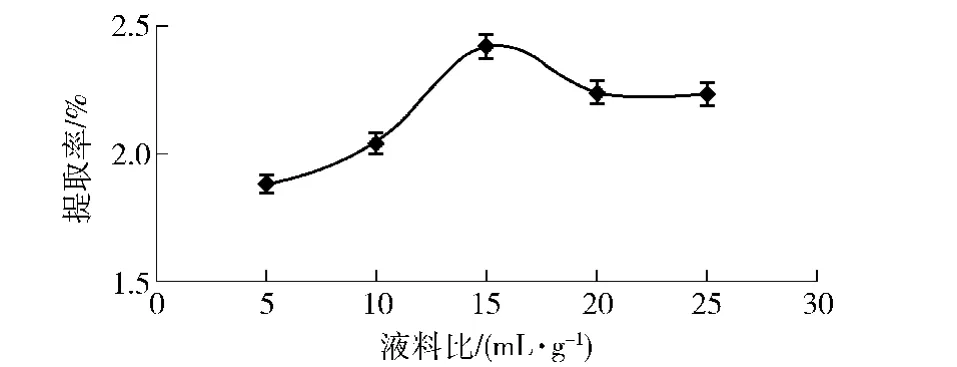
图1 不同液料比对黄酮提取率的影响Fig.1 Effect of liquid-to-solid ratio on flavonoid yield
2.1.2 乙醇体积分数对苦荞总黄酮提取率的影响
乙醇体积分数和黄酮提取率的关系如图2。随着乙醇体积分数的增加,苦荞总黄酮提取率显著增大,当乙醇体积分数为70%时黄酮提取率达到峰值,超过该体积分数后黄酮提取率反而减小。这可能是因为高浓度的乙醇使一些醇溶性的杂质溶解度增加,影响了黄酮的溶解度,使提取率有所降低[14]。
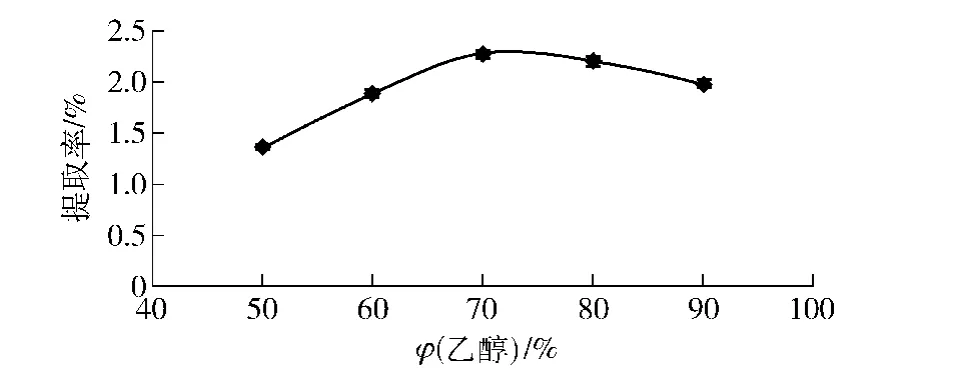
图2 不同体积分数乙醇对黄酮提取率的影响Fig.2 Effect of ethanol concentration on flavonoids yield
2.1.3 提取温度对苦荞总黄酮提取率的影响
提取温度和黄酮提取率的关系如图3。在50~70℃,苦荞黄酮提取率随着温度的升高而有明显升高,70℃时达到峰值。继续升高温度,黄酮提取率有所下降,这可能是过高的提取温度加快了乙醇溶液的蒸发,从而降低了提取率。而且高温也会导致黄酮的结构被氧化破坏。因此提取温度选在70℃为宜。
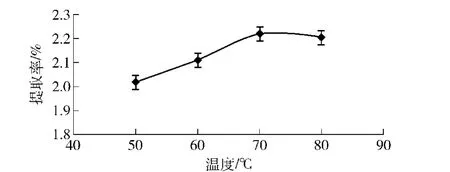
图3 不同提取温度对黄酮提取率的影响Fig.3 Effect of extraction temperature on flavonoids yield
2.1.4 提取时间对苦荞总黄酮提取率的影响
提取时间和黄酮提取率的关系如图4。提取时间为4 h时,苦荞黄酮提取率最大,继续加长提取时间,黄酮提取率反而减小,这可能是由于时间过长溶剂挥发、黄酮被氧化损失等原因所致。考虑到时间及能源节约等问题,提取时间最终选择4 h。

图4 不同提取时间对黄酮提取率的影响Fig.4 Effect of extraction time on flavonoids yield
2.2 苦荞黄酮提取响应面优化分析
2.2.1 响应面分析因素及水平
综合单因素实验结果,设计响应面分析因素水平见表1。

表1 苦荞中总黄酮提取响应面试验因素与水平Tab.1 Factors and levels in response surface design of flavonoids extraction
2.2.2 响应面试验设计及结果
响应面试验设计及结果见表2。试验共有29个试验点,24个析因点,5个中心点,零点试验重复5次,用来估计试验中的误差。本试验采用Design-Expert 8.0.6软件对所得数据进行ANOVA分析,分析结果见表3。
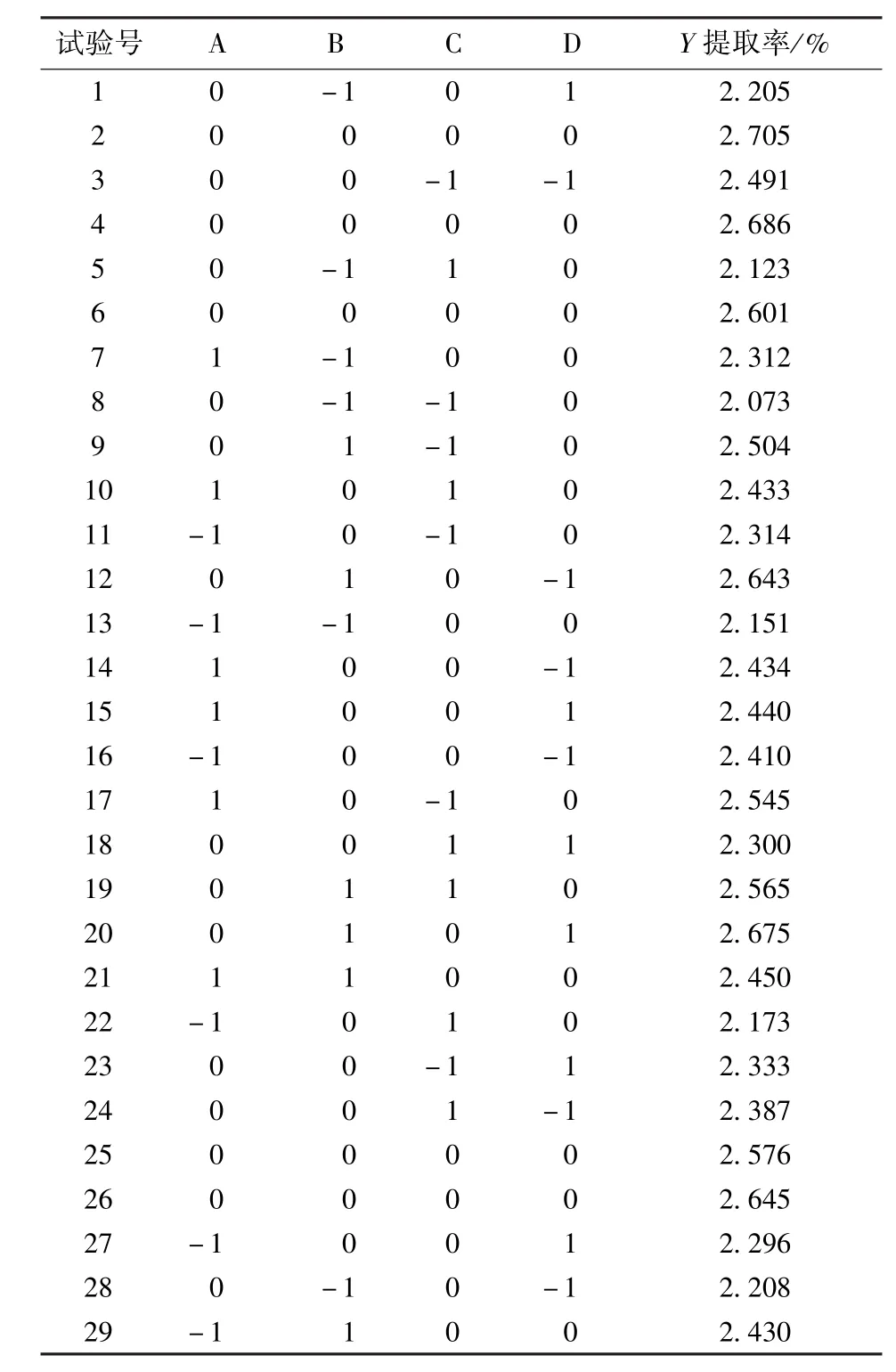
表2 苦荞中黄酮提取响应面试验设计及结果Tab.2 Response surface design arrangement and experimental results of flavonoids extraction
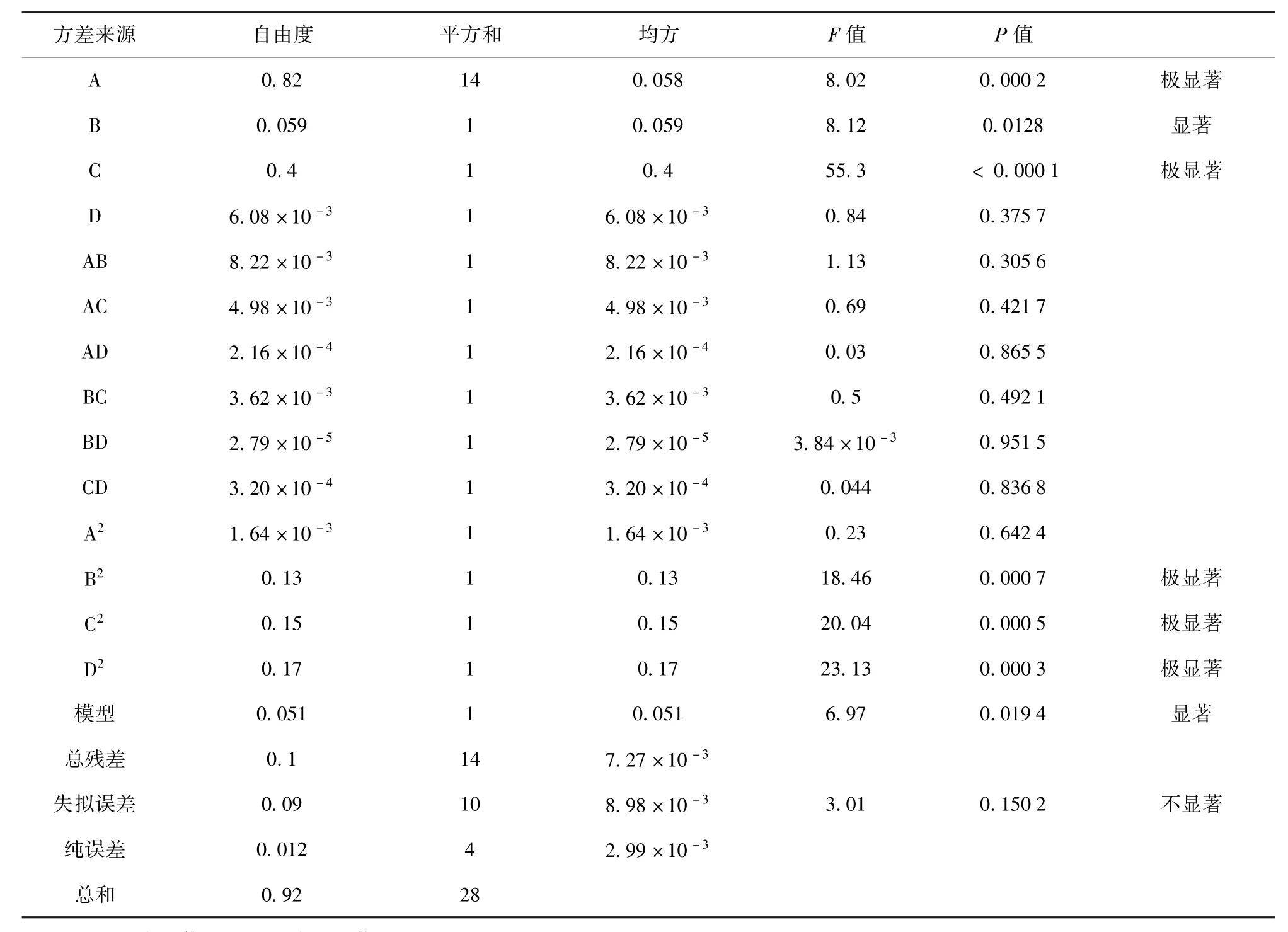
表3 响应面法对黄酮提取率的ANOVA分析结果Tab.3 ANOVA of constructed regression model of flavonoids extraction
4个因子经拟合得到与黄酮提取率Y相关的回归方程见式(6):
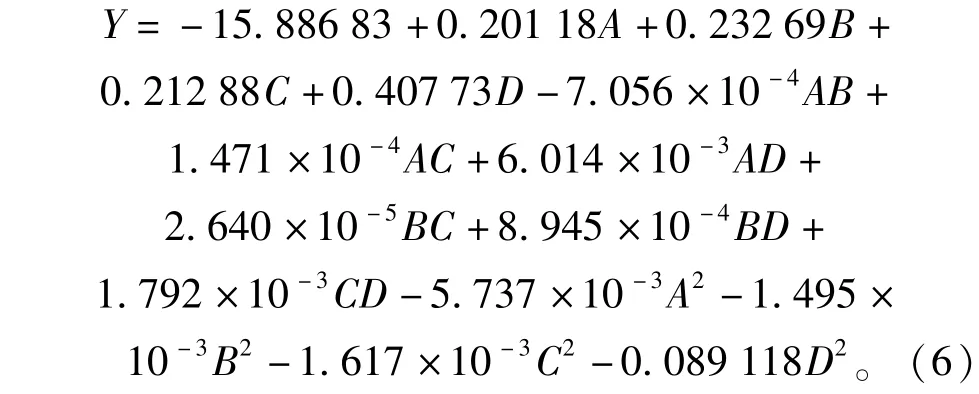
试验的方差分析中,当P值小于0.05即表示该项指标显著。从表3的分析结果可知,整体模型的P值为0.019 4,相关系数为0.851 6,失拟误差为0.150 2,表明该二次方程模型可以很好地拟合实验,说明这种方法是可靠的[15],使用该方程模拟真实的四因素三水平的分析是可行的。乙醇浓度对提取率影响显著,液料比、提取温度对提取率的影响达到了极显著,三者的二次项对苦荞黄酮提取率的影响也均达到了极显著的水平,表明试验因子对响应值不是简单的线性关系,二次项与响应值也有很大关系。在选取的4个因素水平范围内,对苦荞籽粒黄酮提取率的影响大小顺序为:提取温度(C)>液料比(A)>乙醇体积分数(B)>提取时间(D)。
本次试验各因素间响应面分析图及等高线见图5,曲面越陡峭表明该因素对响应值的影响越显著[16]。从图5可以看出液料比、乙醇体积分数和提取温度对总黄酮的得率影响比较大,而提取时间对应的曲线变化则比较平缓,这和表3的方差分析结果吻合,液料比、乙醇体积分数和提取温度对应的P值均达到了显著水平,而提取时间对响应值的影响则不显著。Design-Expert 8.0.6软件分析得4个因素特征值依次为1,0.493,-0.043,0.037,即苦荞黄酮的最佳提取条件为液料比20∶1 mL/g,乙醇体积分数74.96%,提取温度69.56℃,提取时间4.04 h,理论较佳提取率为2.606%。
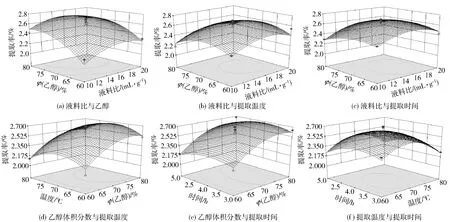
图5 两因素交互作用对总黄酮得率的响应面图和等高线图Fig.5 Response surface and contour plots for effects of operating parameters on the extraction rate of total flavonoids
2.3 验证实验
为了检验响应面法的可行性,采用实验得出的最佳提取条件进行苦荞黄酮浸提的验证实验。为方便实际操作和以后生产将提取条件调整为:液料比20 mL/g,乙醇体积分数75%,提取温度70℃,提取时间4 h,此时计算出的理论提取率为2.606%。表4为重复实验的结果,5次平行实验得到的苦荞黄酮实际平均提取率为2.632%,RSD值为1.79%,说明该数学模型能很好地预测各因素与提取率之间的关系。

表4 响应面分析结果重复试验Tab.4 Repeated trials of response surface analysis results
2.4 苦荞籽粒粗黄酮的纯化

图6 AB-8大孔树脂静态吸附和解析曲线Fig.6 Static adsorption and desorption curves of AB-8
图6(a)是5 g AB-8型湿树脂对40 mL质量浓度为20 mg/mL的黄酮溶液进行吸附的吸附曲线。由图6(a)可知,在0到0.5 h,树脂对黄酮的吸附量迅速上升。0.5 h到4 h上升趋势较平缓,吸附4 h后树脂的吸附量已经趋于平衡,达到平均每克树脂吸附24 mg黄酮。图6(b)为40 mL体积分数70%的乙醇溶液对4 g吸附后树脂进行解析的解析曲线。由图6(b)可知,AB-8型大孔树脂能快速达到解吸平衡,0.5 h时解析率高达80%以上,解析1 h后解析率趋于稳定。因此,在对苦荞粗黄酮进行初步纯化时选定AB-8型大孔树脂吸附时间为4 h,解析时间为1 h。测得纯化后苦荞黄酮的纯度为76.47%。
2.5 苦荞籽粒黄酮抗氧化分析
2.5.1 苦荞籽粒黄酮清除O2-·的能力
图7为邻苯三酚自氧化法测得的不同质量浓度苦荞籽粒黄酮对O-2·的清除率。由图7可知,苦荞籽粒黄酮清除O-2·的能力随着样品浓度的增大而增大,在黄酮质量浓度为150 μg/mL后清除率呈线性关系上升。说明苦荞籽粒黄酮对O-2·有一定的清除效果,通过拟合方程计算其IC50值为0.498 mg/mL,高于抗坏血酸的IC50值(0.139 mg/mL),表明苦荞黄酮对O-2·的清除能力低于抗坏血酸。

图7 苦荞籽粒黄酮超氧离子自由基清除能力Fig.7 Superoxide anion radicals scavenging capabilities of total flavonoids in seed of tartary
2.5.2 苦荞籽粒黄酮抗脂质过氧化的能力
图8是不同质量浓度苦荞籽粒黄酮和抗坏血酸抗大豆卵磷脂过氧化能力的测定。由图8可知,随着苦荞籽粒黄酮质量浓度的增大,其对Fe2+引发的卵磷脂脂质体过氧化的抑制作用有明显的上升趋势。黄酮类物质通过与铁离子进行螯合并清除氧化过程产生的自由基和过氧化物来抑制大豆卵磷脂的进一步氧化[17],因此苦荞籽粒黄酮能表现出较强的抗脂质过氧化能力。样品抗脂质过氧化能力IC50值为1.115 mg/mL,略高于抗坏血酸(IC50值0.693 mg/mL),表明苦荞黄酮抗脂质过氧化能力略低于抗坏血酸。
2.5.3 苦荞籽粒黄酮的还原力
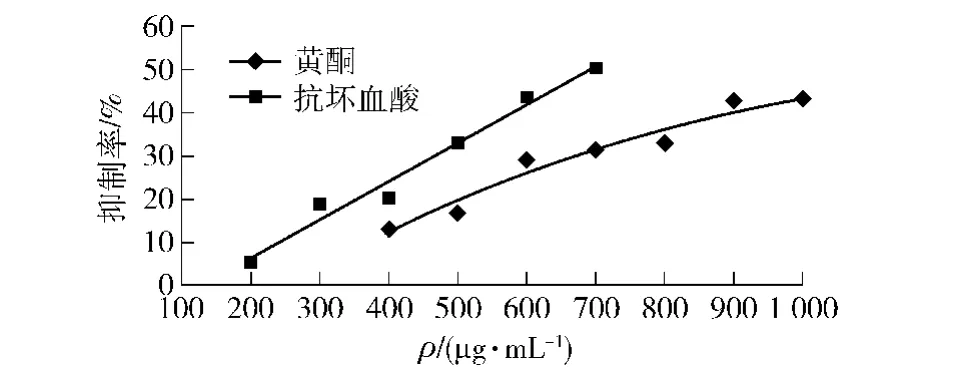
图8 苦荞籽粒黄酮抗脂质过氧化能力Fig.8 Lipid peroxidation inhibiting capability of total flavonoids in seed tartary
样品的还原力和抗氧化活性有明显相关性[18],苦荞籽粒总黄酮还原力测定依据样品能够提供电子的数目和难易程度,图9为苦荞籽粒黄酮和抗坏血酸还原力的测定结果。由图9可知,在一定范围内,苦荞籽粒黄酮的还原力随着浓度的升高而增大,表明苦荞籽粒黄酮具有还原力,但其还原力低于抗坏血酸,且随着二者浓度的升高,还原力差距变大。

图9 苦荞籽粒黄酮还原力Fig.9 Reducing abilities of total flavonoids in seed of tartary buckwheat
2.5.4 苦荞籽粒黄酮清除DPPH自由基的能力
图10和图11分别为不同质量浓度苦荞籽粒黄酮和抗坏血酸溶液清除DPPH自由基的能力。由图10可知,苦荞籽粒黄酮在30 μg/mL到100 μg/mL随着黄酮浓度的增大,清除DPPH自由基的能力也增大,之后保持平衡,清除率稳定在90%左右。由图11可知,抗坏血酸为10 μg/mL时对DPPH自由基的清除率即达到了90%。因此较高浓度的黄酮溶液(大于100 μg/mL)对DPPH自由基的清除率接近抗坏血酸。通过拟合方程计算的苦荞籽粒总黄酮清除DPPH自由基的IC50值为2.235 μg/mL,说明所提样品有比较强的清除DPPH自由基能力。
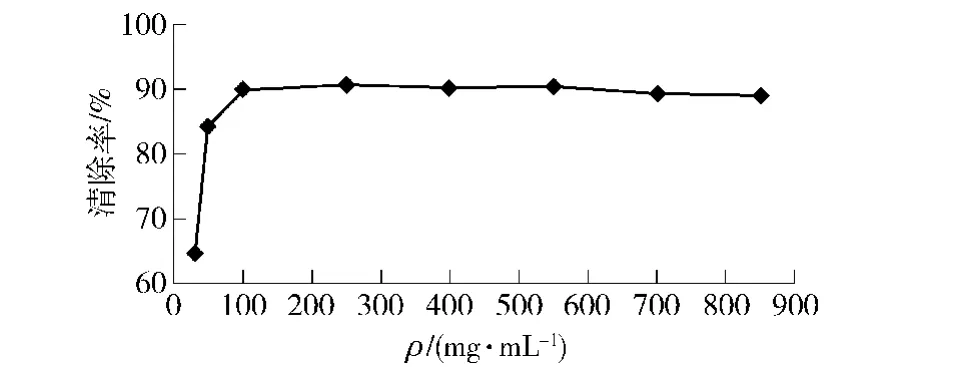
图10 苦荞籽粒黄酮清除DPPH自由基能力Fig.10 DPPH scavenging capability of total flavonoids in the seed of tartary buckwheat
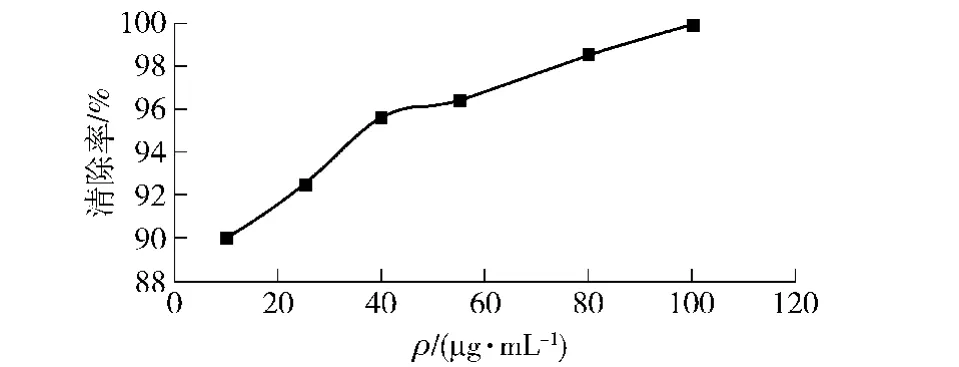
图11 抗坏血酸清除DPPH自由基能力Fig.11 DPPH scavenging capability of ascorbic acids
3 结 论
用水浴摇床对苦荞籽粒总黄酮进行了提取,在较好控制温度的同时增大了苦荞粉和溶剂的接触面积。响应面试验得出黄酮的较佳提取条件为:液料比(mL/g)20∶1,乙醇体积分数75%,提取温度70℃,提取时间4 h,测得的实际提取率为2.632%。其中,温度对提取率影响最大,验证实验说明所得结果可用。所得苦荞籽粒粗黄酮经AB-8型大孔树脂吸附纯化后的纯度达到76.47%(纯化前为36.17%)。
本实验通过研究苦荞籽粒黄酮清除超氧离子自由基、抗脂质过氧化能力、对Fe3+的还原力及清除DPPH自由基的能力进行研究,并用抗坏血酸作阳性对照。结果表明苦荞籽粒总黄酮具有一定的抗氧化活性,其中对DPPH自由基的清除能力比较强,其IC50值为2.235 μg/mL。样品抗脂质过氧化能力与抗坏血酸非常接近,清除O-2·能力和还原力均低于抗坏血酸,二者的差距均随着浓度的增加而增大。本实验结果可为苦荞保健品及其他方面的开发利用提供一定的参考。
[1] Qin Peiyou,Wu Li,Yao Yang,et al.Changes in phytochemical compositions,antioxidant and glucosidase inhibitory activities during the processing of tartary buckwheat tea[J].Food Research International,2010,50:562-567.
[2] 李海萍.苦荞粉与叶粉的抗氧化功能性及其利用研究[D].杨凌:西北农林科技大学,2010.
[3] 李楠,刘元,侯滨滨.黄酮类化合物的功能特性[J].食品研究与开发,2005,26(6):139-141.
[4] 刘瑞敏.苦荞降糖成分的提取与药效初步研究[D].成都:四川师范大学,2012.
[5] Zhang Min,Chen Haixia,Li Jinlei,et al.Antioxidant properties of tartary buckwheat extracts as affected by different thermal processing methods[J].LWT-Food Science and Technology,2010,43:181-185.
[6] Kalil S J,Maugeri F,Rodrigues M I.Response surface analysis and simulation as a tool for bioprocess design and optimization[J].Process Biochemistry,2000,35:539-550.
[7] 王明艳,鲁加峰,宋瑛,等.响应面法优化毛冬青根黄酮提取条件[J].食品科学,2011,18:81-85.
[8] 金蕾.NaNO2-Al(NO3)3-NaOH法测定总黄酮含量的实验条件研究[J].海峡药学,2008(3):66-67.
[9] 宋薇薇.石榴皮总黄酮的提取及抗氧化活性和抑菌作用研究[D].成都:西华大学,2008.
[10] 田丽娟,张晓静,杨俊,等.大孔吸附树脂对金菊双花总黄酮的吸附研究[J].时珍国医国药,2005,12:163-164.
[11] 李颖畅,马春颖,励建荣.蓝莓叶水溶性和醇溶性提取物的抗氧化作用[J].食品与发酵科技,2014(2):31-35.
[12] 霍彤.蓝莓叶黄酮的提取、分离、纯化及抗炎功效研究[D].北京:北京工商大学,2014.
[13] 王蓓蓓,牛付阁,段玉峰.高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学,2011(7):117-120.
[14] 闫克玉,贾玉红.乙醇提取款冬花中总黄酮的工艺研究[J].现代食品科技,2008(9):901-903,910.
[15] 朱珠,冷进松.响应面分析法优化仙人掌黄酮提取工艺[J].食品科学,2010,31(22):185-189.
[16] 侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
[17] Leo M D,Abreu M,Pawlowska A M,et al.Profiling the chemical content of opuntia ficus-indica flowers by HPLC-PDA-ESI-MS and GC/EIMS analyses[J].Phytoche Lett,2010(1):48-52.
[18] Dorman H J D,Kosar M,Kahlos K,et al.Antioxidant properties and composition of aqueous extracts from merrtha species,hybrids,varieties,and cultivars[J].Journal of Agriculture and Food Chemistry,2003,51:4563-4569.
Extraction and Antioxidant Activity of Total Flavonoids from Tartary Buckwheat Seed
LI Fei, REN Qing*, JI Chao, HOU Chang
(School of Food and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China)
Response surface methodology was used to optimize the extraction processing of the total flavonoids in the seed of tartary buckwheat according to central composite design principle based on the single factor experimental results.Through the analysis of cross-interaction among factors by the Design-Expert software,the optimal extraction conditions were found to be liquid-material ratio 20∶1,alcohol concentration 75%,extraction temperature 70℃,and extraction time 4h.The extraction rate of flavonoids was 2.632%under the optimal extraction conditions.Meanwhile,the antioxidant activity of total flavonoids was assessed by scavenging hydroxyl radicals and DPPH radical,anti-lipid peroxidation,and reducing power.The results showed that the total flavonoids in the seed of tartary buckwheat presented a strong antioxidant activity to scavenge DPPH radicals and IC50values of anti-lipid peroxidation,scavenge hydroxyl radicals,and DPPH radical were 1.115,0.498,and 2.235 μg/mL.
seed of tartary buckwheat;flavonoids;response surface methodology;antioxidant activity
TS201.4
A
(责任编辑:檀彩莲)
10.3969/j.issn.2095-6002.2015.06.010
2095-6002(2015)06-0057-08
李飞,任清,季超,等.苦荞籽粒黄酮的提取纯化及抗氧化活性研究[J].食品科学技术学报,2015,33(6):57-64.
LI Fei,REN Qing,JI Chao,et al.Extraction and antioxidant activity of total flavonoids from tartary buckwheat seed[J].Journal of Food Science and Technology,2015,33(6):57-64.
2015-06-11
国家燕麦荞麦现代农业产业技术体系(CARS-08-D-3)。
李 飞,女,硕士研究生,研究方向为食品生物技术;
*任 清,男,副教授,博士,主要从事食品生物技术方面的研究。通信作者。

