纳米SiO2对人神经母细胞瘤SH-SY5Y细胞的凋亡诱导作用及其机制
杨艳艳,金明华,李艳博,李 阳,王佳慧,郑 彤,王思惠, 迟翔宇,张宇佳,孙志伟,
(1.吉林大学公共卫生学院卫生检验学教研室,吉林 长春 130021;2.首都医科大学公共卫生学院卫生毒理与卫生化学学系,北京 100069)
纳米SiO2对人神经母细胞瘤SH-SY5Y细胞的凋亡诱导作用及其机制
杨艳艳1,金明华1,李艳博2,李阳2,王佳慧1,郑彤1,王思惠1, 迟翔宇1,张宇佳1,孙志伟1,2
(1.吉林大学公共卫生学院卫生检验学教研室,吉林 长春 130021;2.首都医科大学公共卫生学院卫生毒理与卫生化学学系,北京 100069)
目的:探讨纳米二氧化硅(SiO2)对人神经母细胞瘤SH-SY5Y细胞凋亡和周期的影响,阐明其作用机制。方法:选取不同浓度粒径为90 nm的SiO2颗粒作用于SH-SY5Y细胞,分别为0、 3.125、6.250、12.500、25.000、50.000 mg·L-1SiO2组,其中0 mg·L-1组为对照组。MTT法检测各组SH-SY5Y细胞存活率;采用AO/EB染色和 Annexin Ⅴ-FITC/PI法检测各组细胞凋亡率;流式细胞术(FCM)检测细胞周期百分比和细胞中活性氧(ROS)水平。结果: MTT检测,6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞存活率低于对照组 (P<0.05),12.500、25.000和50.000 mg·L-1SiO2组细胞存活率低于3.125 mg·L-1SiO2组 (P<0.05)。AO/EB染色和 Annexin V-FITC/PI法检测,6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率高于对照组(P<0.05),12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率高于3.125 mg·L-1SiO2组(P<0.05)。FCM检测,3.125、6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞中ROS水平高于对照组 (P<0.05)。25.000和50.000 mg·L-1SiO2组G0/G1期细胞百分比低于3.125 mg·L-1SiO2组和对照组(P<0.05),50.000 mg·L-1SiO2组G2/M期细胞百分比高于对照组 (P<0.05)。结论:纳米SiO2可降低SH-SY5Y细胞的活力,诱导细胞凋亡,增加细胞中ROS水平,可干扰细胞周期进程,对SH-SY5Y细胞的增殖具有抑制作用。
纳米二氧化硅;SH-SY5Y细胞;细胞周期;细胞凋亡
纳米二氧化硅(SiO2)在生物医药领域得到广泛应用[12],使人类暴露纳米SiO2的机会增加,其生物安全性也引起人们的关注。有研究[3]显示:量子点可以经过鼻黏膜进入脑组织,分布于嗅球和大脑等部位。纳米颗粒可通过呼吸道吸入并转移到嗅神经,且随暴露时间的延长,大脑皮层和小脑中纳米颗粒水平缓慢增加,证明其可以通过血脑屏障[45]。体外实验[6-8]结果表明:纳米SiO2可诱导小鼠上皮JB6 细胞、人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)和人的支气管上皮细胞(BEAS-2B)的活性氧(reactive oxygen species,ROS)产生和细胞凋亡增加,从而对细胞产生毒性作用。血液中纳米颗粒可以通过血脑屏障,在脑组织中可以检验到纳米颗粒,并对细胞具有一定的毒性作用,但是其具体机制尚不清楚。本研究以人神经母细胞瘤SH-SY5Y细胞为靶细胞,观察暴露于不同浓度纳米SiO2条件下细胞的存活率、ROS水平、细胞凋亡率和细胞周期进程的改变,探讨纳米SiO2对神经细胞的作用及其机制,为纳米SiO2安全应用和神经毒性研究提供依据。
1 材料与方法
1.1细胞、主要试剂和仪器人神经母细胞瘤 SH-SY5Y细胞购自中国南京凯基生物发展有限公司。纳米SiO2颗粒平均粒径为90 nm,由吉林大学化学院惠赠,所用粒子在双蒸水和DMEM培养液中有较好的稳定性和分散性,Zeta电位稳定,每次用前超声均质化10 min。高糖DMEM培养基、胰蛋白酶(Hyclone公司,美国),MTT、DMSO(Amresco公司,美国),Annexin Ⅴ-FITC/PI凋亡试剂盒、ROS检测试剂盒、细胞周期检测试剂盒(中国南京凯基生物发展有限公司),其他试剂(国药集团化学试剂有限公司)。超净工作台(Taisite公司,中国),MCO-18AIC二氧化碳培养箱(Sanyo公司,日本),酶标仪(Thermo公司,美国),激光共聚焦显微镜(Olympus公司,日本),FACS流式细胞仪(Millipore公司,德国),台式低温高速离心机(Eppendorf公司,德国)。
1.2细胞培养与分组SH-SY5Y细胞培养于含10%胎牛血清的高糖DMEM培养液中, 37℃、5%CO2培养箱常规培养,48 h传代1次。取对数生长期细胞用含0.25%胰蛋白酶消化,制成单细胞悬液,将细胞接种于培养板培养24 h,吸弃原培养液,根据加入无血清的纳米SiO2培养液的浓度进行分组,分别为0、3.125、6.250、12.500、25.000和50.000 mg·L-1SiO2组,其中0 mg·L-1SiO2组为对照组。培养时间为24 h。每组至少3个平行。
1.3MTT法检测SH-SY5Y细胞存活率取对数生长期细胞,用含0.25%胰蛋白酶消化,制成单细胞悬液,将细胞接种于96孔培养板,密度为5×104mL-1,每孔200 μL,培养24 h,观察细胞生长状态,加入不同浓度的纳米SiO2,染毒培养24 h后,每孔加入5 g·L-1MTT 20 μL,继续培养4 h,弃上清,每孔加入0.15 mL DMSO终止反应,振摇10 min溶解结晶,酶标仪测490 nm吸光度(A)值,细胞存活率=(处理组A值-空白A值)/(对照组A值-空白A值)×100%。
1.4流式细胞术检测细胞凋亡率取对数生长期细胞,6孔培养板内接种细胞密度为1×105mL-1,每孔2 mL,培养24 h,加入不同浓度分散于无血清的DMEM培养液的SiO2颗粒,每组3个平行,继续培养24 h,吸弃培养液,PBS洗1次后,用不含EDTA胰蛋白酶消化细胞后,1 000 r·min-1离心5 min,PBS重悬细胞,计数细胞2×105个,1 000 r·min-1离心5 min弃上清,用0.5 mL Binding buffer重悬细胞,轻吹均匀,每组加5 μL Annexin Ⅴ-FITC混匀,后加入5 μL PI 混匀,室温避光孵育15 min后,流式细胞术检测细胞凋亡率,结果以百分率表示。
1.5丫啶橙-溴化乙锭(AO/EB)染色检测细胞凋亡率取对数生长期细胞,24孔板内接种细胞密度为1×105mL-1,每孔0.5 mL,培养24 h后,染毒剂量同上,每组4个平行,继续培养24 h,吸弃培养液,PBS洗1次,将现配好的100 mg·L-1溶于PBS的吖啶橙和100 mg·L-1溶于PBS的溴化乙锭各5 μL混匀后加入每孔,用荧光显微镜观察,计取5个视野、共100个细胞中凋亡细胞数,凋亡细胞率=凋亡细胞数/总细胞数×100%。
1.6流式细胞术检测细胞中ROS水平取对数生长期细胞接种于6孔培养板,细胞密度为1×105mL-1,每孔2 mL,培养24 h,给予不同浓度的纳米SiO2,每组3个平行,继续培养24 h,吸弃培养液,用无血清培养液将DCFH-DA稀释。终浓度为10 μmol·L-1,每孔加入1 mL,将细胞完全覆盖,37℃培养箱内孵育20 min,无血清培养液洗涤3次,去除未结合的DCFH-DA残留干扰,用不含EDTA胰酶消化细胞,1 000 r·min-1离心5 min,PBS洗涤细胞1次,1 000 r·min-1离心5 min,用PBS重悬细胞,采用流式细胞术检测细胞的平均荧光强度即细胞中ROS水平。
1.7流式细胞术检测细胞周期百分比6孔培养板接种细胞密度为1×105mL-1,每孔2 mL,培养24 h,给予不同浓度的无血清的纳米SiO2,每组3个平行,继续培养24 h,吸弃培养液,PBS洗1次,胰酶消化细胞后,1 000 r·min-1离心5 min弃上清,PBS洗涤1次,离心弃上清,少量PBS重悬细胞,计取106个细胞用-20℃预冷的70%乙醇0.5 mL于4℃固定细胞48 h。染色前,1 000 r·min-1离心5 min,弃去固定液,PBS洗涤2次,除去固定剂,加入0.1 mL RNase 混匀,37℃水浴30 min,加入0.4 mL PI混匀4℃避光染色 30 min,流式细胞术检测各细胞周期百分比(G0/G1、S和G2/M期)。

2 结 果
2.1各组SH-SY5Y细胞存活率MTT检测,纳米SiO2作用于SH-SY5Y细胞后,随着暴露剂量的升高,细胞存活率下降,与对照组比较,6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞存活率明显下降,差异有统计学意义(P<0.05)。与3.125 mg·L-1SiO2组比较,12.500、25.000和50.000 mg·L-1SiO2组细胞存活率下降(P<0.05)。见表1。
表1各组SH-SY5Y细胞存活率


GroupA490valueSurvivalrate(η/%)Control0.449±0.023100.0±0.0 SiO2(mg·L-1) 3.1250.444±0.04797.7±1.1 6.2500.410±0.020*91.7±1.1* 12.5000.375±0.041*△87.3±4.1*△ 25.0000.368±0.035*△84.3±4.0*△ 50.0000.342±0.012*△79.7±6.3*△
*P<0.05vscontrol group;△P<0.05vs3.125 mg·L-1SiO2group.
2.2各组SH-SY5Y细胞凋亡率Annexin Ⅴ-PITC/PI检测,随着染毒剂量的增加,细胞凋亡率增加,与对照组比较,6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率明显增加(P<0.05);与3.125 mg·L-1SiO2组比较,12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率增加(P<0.05);AO/EB染色检测,随着染毒剂量的增加,橙染的凋亡细胞逐渐增多,其中6.250、12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率均高于对照组(P<0.05);与3.125 mg·L-1SiO2组比较,12.500、25.000和50.000 mg·L-1SiO2组细胞凋亡率增加(P<0.05)。见表2和图1(插页二)。
2.3各组SH-SY5Y细胞中ROS水平流式细胞术检测,各浓度纳米SiO2作用于SH-SY5Y细胞24 h,细胞中的ROS水平分别为65.26±0.60(对照组)、77.22±3.87、77.48±3.07、81.26±4.63、87.51±6.41和88.80±6.45,随着暴露剂量的增加,ROS水平升高,6.250,12.500,25.000,50.000 mg·L-1SiO2组ROS水平高于对照组(P<0.05)。见图2。
2.4各组SH-SY5Y细胞周期百分比细胞周期检测,随着暴露剂量的增加,细胞G0/G1期百分比减少,25.000和50.000 mg·L-1SiO2组G0/G1期百分比低于对照组和3.125 mg·L-1SiO2组(P<0.05)。50.000 mg·L-1SiO2组G2/M期百分比高于对照组和3.125 mg·L-1SiO2组(P<0.05)。见表3。
表2各组SH-SY5Y细胞凋亡率

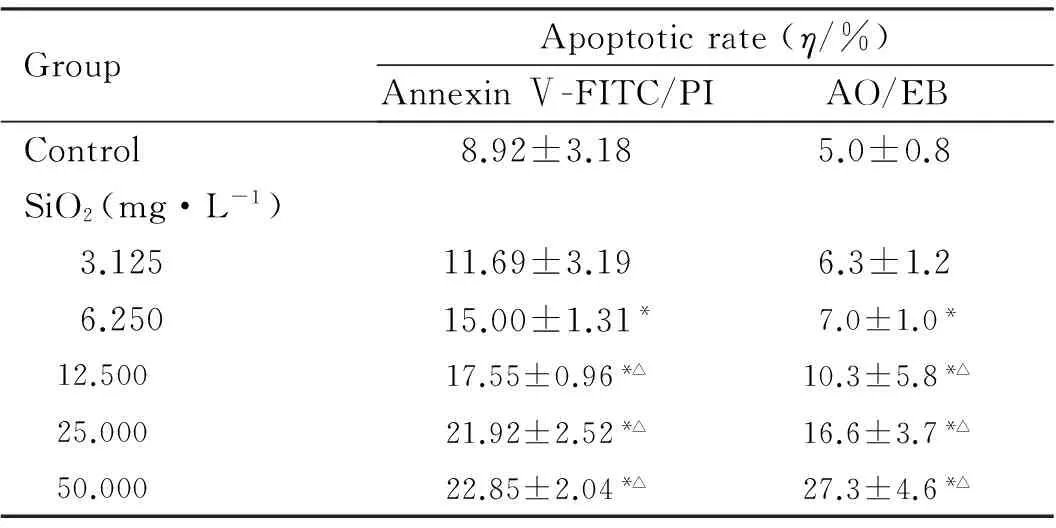
GroupApoptoticrate(η/%)AnnexinⅤ-FITC/PIAO/EBControl8.92±3.185.0±0.8SiO2(mg·L-1) 3.12511.69±3.196.3±1.2 6.25015.00±1.31*7.0±1.0* 12.50017.55±0.96*△10.3±5.8*△ 25.00021.92±2.52*△16.6±3.7*△ 50.00022.85±2.04*△27.3±4.6*△
*P<0.05vscontrol group;△P<0.05vs3.125 mg·L-1SiO2group.

A:Control group;B-F:3.125,6.250,12.500,25.000, and 50.000 mg·L-1 SiO2 groups.

表3 各组SH-SY5Y细胞各周期百分比
*P<0.05vscontrol group;△P<0.05vs3.125 mg·L-1SiO2group.
3 讨 论
纳米材料在医学领域的广泛应用,增加了环境颗粒物质进入血液循环的机会,鉴于其可以通过血脑屏障,纳米粒子的神经毒性不容忽视。空气中的纳米颗粒物质主要以气溶胶的形态存在,吸入的纳米颗粒可以通过神经元转移进入中枢神经系统[5],也可通过呼吸系统的感觉神经末梢,进入神经节和神经中枢[3]。有研究[9]显示:纳米SiO2可以使斑马鱼幼鱼产生神经和发育毒性。因此,本研究以SH-SY5Y细胞为靶细胞,探讨90 nm SiO2颗粒对其神经细胞的毒性作用及周期进程的影响。
纳米粒子的表面电荷、化学组成、团聚形态和表面修饰对其生物效应有很大影响[10],本研究采用的90 nm SiO2颗粒,用动态光散射法检测粒子在双蒸水和DMEM培养液中水合粒径及Zeta电位表明:纳米SiO2粒子在双蒸水和DMEM培养液中分散性和稳定性良好,未发生团聚,48 h粒子水合粒径及Zeta电位值均较稳定。本研究结果表明:纳米SiO2作用于SH-SY5Y细胞24 h,随着染毒剂量的增加,细胞存活率逐渐降低,呈剂量依赖关系。细胞存活率的降低可能与细胞的氧化应激、细胞膜损伤、细胞周期改变和细胞凋亡有关联。正常情况下,由机体生理过程产生的活性物质构成的细胞助氧化系统与体内存在的抗氧化系统保持动态平衡。当外源性化学物质进入机体后,可使这一平衡受到破坏引起脂质过氧化,膜结构和通透性受到损伤,产生自由基从而使细胞中的ROS水平增加。本研究采用流式细胞术检测细胞中ROS水平,随着纳米SiO2暴露剂量的增加,细胞中ROS水平明显增加,进一步证实了SH-SY5Y细胞存活率的降低可能是由于细胞中ROS产生增加,损伤线粒体,使线粒体膜电位发生改变,从而使细胞内的钙离子增加,释放细胞色素C,进而使细胞发生凋亡。
细胞凋亡是生物体内一种主动性的细胞死亡,当机体或细胞受到外来刺激时,会利用细胞凋亡清除多余、衰老和受损伤的细胞,以保持机体和细胞内环境平衡,维持其正常的生理活动。一旦发生凋亡失衡就可能起癌症和自身免疫性疾病,神经细胞过度凋亡就可以引起如阿尔默海兹病等神经退行性疾病。本研究结果显示:纳米SiO2颗粒可以降低SH-SY5Y细胞存活率,使细胞凋亡率明显增加,细胞中ROS生成增加并呈剂量依赖关系。ROS是在细胞有氧代谢过程中产生的,包含氧离子、过氧化氢和含氧自由基,因含有未配对电子,具有很强的化学活性,其为细胞正常代谢的副产物,对细胞信号传导保持稳定的胞内环境有重要作用,通常ROS的产生与清除保持动态平衡,但在外界环境改变时,一旦超出清除能力,可导致细胞中ROS水平增加,引起氧化应激、脂质过氧化损伤,导致细胞凋亡。研究[11-12]显示:纳米粒子可通过氧化应激来诱导细胞凋亡,从而对细胞产生毒性作用。纳米材料的比表面积大,表面活性高,与生物活性分子作用后,可引起组织和细胞中ROS大量蓄积,引起细胞膜、糖类和脂质过氧化损伤。由于纳米SiO2的表面存在大量的羟基,可以与DNA、RNA和蛋白质等生物大分子相互作用,产生自由基,引起细胞产生大量的ROS,引起细胞DNA损伤,导致细胞凋亡。这可能是纳米SiO2使SH-SY5Y细胞存活率降低、诱导细胞凋亡的原因。
多细胞有机体的发生发育有赖于细胞增殖、分化和死亡过程的精密配合,即细胞周期的正常运行、细胞增殖和凋亡的平衡。如果细胞周期发生改变,可引起细胞基因不适当的活化,使细胞过度增殖或者细胞凋亡。在细胞周期的各个时相(G1、S和G2期)存在细胞周期调控点[13],外来化合物可以通过影响调控点来干扰细胞增殖。本研究结果表明:纳米SiO2能够改变细胞周期,25.000、50.000 mg·L-1SiO2组G0/G1细胞百分比减少,S期细胞没有明显的改变,50.000 mg·L-1SiO2组G2/M细胞百分比增加,表明神经细胞阻滞于G2期,使有丝分裂延迟。当细胞发生阻滞时,细胞可通过一系列调控机制抑制细胞周期的进行,抑制DNA的合成,阻止细胞的分裂,提供充足的时间进行DNA的修复,以减少损伤的致死性避免突变、重组或损伤的DNA进入子代细胞[14]。由于不同理化刺激在不同周期对细胞的损害的程度不同,而细胞对损害的修复能力也随周期的不同而不同。多数细胞损伤后都会发生周期阻带,包括G1、S和G2期阻滞,使细胞不能通过检定点,从而激活细胞周期相关蛋白使细胞发生凋亡。
综上所述,纳米SiO2可以明显降低SH-SY5Y细胞生存率,增加细胞中ROS水平,对细胞的增殖与分化产生干扰,随着纳米SiO2染毒剂量的增加,细胞中ROS水平增加,大量蓄积的ROS可能会对线粒体造成损伤,使线粒体膜电位的发生改变,继而通过线粒体途径引发细胞凋亡的级联反应[15-17],纳米SiO2诱导SH-SY5Y细胞凋亡的作用机制还有待进一步研究。
[1]刘扬,高愈希,吴刚,等. 典型纳米材料生物效应及其毒理学研究的进展[J].中华预防医学杂志,2007,41(2):130-133.
[2]蔡林涛,时喜喜,李莎.多孔硅微腔光学晶体的结构调控和生化传感器[J]. 生物物理学报,2009,25(1):57-58.
[3]尹芳蕊,陈春英,董元兴,等. 量子点经嗅觉通道进入中枢神经系统的可视化过程[J]. 科学通报,2010,55(7): 547-552.
[4]Oberdorster G,Oberdorster E. Nanotoxicity: an emerging discipline evolving from studies of ultrafine particles[J].Environ Health Perspect,2005,113(7):823-839.
[5]Oberdorster G,Sharp Z,Atudorei V,et al.Translocation of inhaled ultrafine particles to the brain[J]. Inhal Toxicol,2004,16(67):437-455.
[6]史宏博,王尊,于宏升,等. 纳米二氧化硅体内与体外氧化应激及细胞毒性实验研究[J].宁波大学学报:理工版,2013,26(1):127-132.
[7]李艳博,周维,于永波,等. 纳米二氧化硅颗粒对血管内皮细胞的毒性及其氧化损伤作用[J]. 吉林大学学报:医学版,2014,40(3): 476-481.
[8]赵光强,黄云超,李光剑,等. 纳米二氧化硅在人支气管上皮细胞内的亚细胞分布和遗传毒性[J]. 中国肿瘤杂志,2013,16(3):117-124.
[9]Xue JY,Li X,Sun MZ,et al. An assessment of the impact of SiO2nanoparticles of different sizes on the rest/wake behavior and the developmental profile of zebrafish larvae[J]. Small,2013,9(18):3161-3168.
[10]Lin W,Huang YW,Zhou XD,et al.Invitrotoxicity of silica nanoparticles in human lung cancer cells [J]. Toxicol Appl Pharmacol,2006,217(3):252-259.
[11]Wang F,Gao F,Lan M,et al. Oxidative stress contributes to silica nanoparticle-induced cytotoxicity in human embryonic kidney cells[J]. ToxicolinVitro,2009,23(5):808-815.
[12]Park EJ,Park K. Oxidative stress and pro-inflammatory responses induced by silica nanoparticlesinvivoandinvitro[J]. Toxicol Lett,2009,184(1):18-25.
[13]杨绍杰,孟金萍,屈祎,等. 细胞凋亡信号传导通路的研究进展[J].中国比较医学杂志,2007,17( 5) : 297-301.
[14]Branzei D,Foiani M. Regulation of DNA repair throughout the cell cycle[J].Nat Rev Mol Cell Biol,2008,9 (4):297-308.
[15]Yang Z,Liu ZW,Allaker RP,et al.A review of nanoparticle functionality and toxicity on the central nervous system[J]. J R Soc Interface,2010,7(4): 411-422.
[16]金小小,张淑玲,徐黎娟,等.CIC-3在SIN-1诱导的大鼠海马神经元凋亡中的作用[J].郑州大学学报:医学版,2014,49(3):315-318.
[17]王悦,计阿丹,肖永红.17β-雌二醇对小鼠肺成纤维细胞细胞周期的影响[J].郑州大学学报:医学版,2014,49(4):530-532.
Induction effect of nano- SiO2on apoptosis of neuroblastoma SH-SY5Y cells and its mechanism
YANG Yanyan1,JIN Minghua1,LI Yanbo2,LI Yang2,WANG Jiahui1,ZHENG Tong1,WANG Sihui1, CHI Xiangyu1,ZHANG Yujia1, SUN Zhiwei1,2
(1.Department of Health Inspection,School of Public Health,Jilin University,Changchun 130021,China;2. Department of Sanitary Chemistry and Toxicology,School of Public Health,Capital Medical University,Beijing 100069,China)
ObjectiveTo observe the effects of nano-SiO2on apoptosis and cell cycle of human neuroblastoma SH-SY5Y cells,and to explore the mechanism.MethodsThe SH-SY5Y cells were treated with different concentrations of 90 nm SiO2and divided into 0,3.125,6.250,12.500,25.000, and 50.000 mg·L-1SiO2groups. The survival rates of the cells in various groups were assessed by MTT method;the apoptotic rates of SH-SY5Y cells were determined by AO/EB staining and Annexin Ⅴ-FITC/P method; the percentage of cell cycle and the level of intracellular reactive oxygen species(ROS) were tested by flow cytometry(FCM) method. ResultsThe MTT results showed the survival rates of the cells in 6.250,12.500,25.000 and 50.000 mg·L-1SiO2groups were significantly lower than that in control group (P<0.05);the survival rates of the cells in 12.500,25.000, and 50.000 mg·L-1SiO2groups were significantly lower than that in 3.125 mg·L-1SiO2group (P<0.05); the AO/EB staining and Annexin Ⅴ-FITC/PI results showed the apoptotic rates of the cells in 6.250,12.500,25.000,and 50.000 mg·L-1SiO2groups were higher than that in control group(P<0.05);the apoptotic rates of the cells in 12.500,25.000,and 50.000 mg·L-1SiO2groups were higher than that in 3.125 mg·L-1group(P<0.05).The FCM results showed the levels of ROS of the cells in 3.125,6.250,12.500,25.000, and 50.000 mg·L-1SiO2groups were significantly higher than that in control group (P<0.05); compared with control group,the percentages of the cells at G0/G1phase in 25.000 and 50.000 mg·L-1SiO2groups were increased (P<0.05);the percentage of the cells at G2/M phase in 50.000 mg·L-1SiO2group was increasd (P<0.05). ConclusionNano-SiO2can decrease the activity of SH-SY5Y cells and increase the apoptosis and the level of ROS,and nano-SiO2can interfere the cell cycle and inhibit the proliferation of SH-SY5Y cells.
nano-SiO2; SH-SY5Y cells; cell cycle;apoptosis
1671-587Ⅹ(2015)02-0249-06
10.13481/j.1671-587x.20150209
2014-11-18
国家自然科学基金资助课题(81172704);吉林大学大学生创新创业项目资助课题(20130943)
杨艳艳(1986-),女,黑龙江省黑河市人,在读医学硕士,主要从事卫生毒理学方面的研究。
孙志伟,教授,博士研究生导师(Tel:010-83911507,E-mail: zwsun@hotmail.com);
金明华,副教授,硕士研究生导师(Tel:0431-85619441,E-mail:jinmh@jlu.edu.cn)
R730.264
A
网络出版时间: 2015-03-10 11:34
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.r.20150310.1134.001.html

