重组质粒pEGFP-N1-apoJ的构建及在大鼠骨髓间充质干细胞中的表达*
周冲,刘学良,郑晓梅,刘亮(四川医科大学附属第一医院 .神经外科,.神经内科,四川 泸州 646000)
重组质粒pEGFP-N1-apoJ的构建及在大鼠骨髓间充质干细胞中的表达*
周冲1,刘学良1,郑晓梅2,刘亮1
(四川医科大学附属第一医院 1.神经外科,2.神经内科,四川 泸州 646000)
目的体外构建重组质粒pEGFP-N1-apoJ,转染大鼠骨髓间充质干细胞,并检测其在大鼠骨髓间充质干细胞中的表达。方法通过脂质体介导重组质粒pEGFP-N1-apoJ转染大鼠骨髓间充质干细胞,确定转染效率,并通过Real-time PCR、免疫细胞化学法、Western blot法检测载脂蛋白-J(apoJ)的表达。结果增强型绿色荧光蛋白在大鼠骨髓间充质干细胞中瞬时转染效率达35%。转染后Real-time PCR、免疫细胞化学法和Western blot法检测证实重组质粒pEGFP-N1-apoJ在大鼠骨髓间充质干细胞中的表达。结论重组质粒pEGFPN1-apoJ成功转染大鼠骨髓间充质干细胞,并在大鼠骨髓间充质干细胞中得到表达,有助于应用apoJ行基因治疗,为进一步研究apoJ作为新的脑出血治疗措施奠定实验基础。
载脂蛋白-J(apoJ);重组质粒;基因转染;骨髓间充质干细胞
载脂蛋白-J(apolipoprotein J,apoJ,又称clusterin)是一种几乎所有类型的细胞都能分泌的多功能糖蛋白。在血浆中apoJ与高密度脂蛋白(high density lipoprotein,HDL)相关,尤其与含有ApoAI和胆固醇转移蛋白活性的HDL亚型联系最密切。在损伤组织中,apoJ基因表达升高,是一种退化或损伤组织中基因转录上行调节的蛋白,参与组织损伤的修复。相关研究表明,补体系统介入脑出血后的神经元死亡,而apoJ作为一个明确的补体调节因子,通过抑制脑出血后的补体激活阻止补体介导的神经元死亡,使apoJ作为新的脑出血的治疗措施成为可能。本研究旨在建立apoJ基因的体外真核细胞表达系统,为进一步研究高表达apoJ基因的骨髓间充质干细胞移植治疗脑出血疾病奠定实验基础。
1 材料与方法
1.1主要材料及试剂
实验动物:清洁级(SD)大鼠,体重80~100 g,由四川医科大学动物中心提供。
试剂:α-MEM培养基;胎牛血清(Gibco公司),脂质体LipofectaminTM2000(Invitrogen公司),兔抗鼠apoJ抗体(Bioworld Technology公司),正反向引物(上海生物工程有限公司),总RNA提取试剂盒,SDS-PAGE凝胶制备试剂盒(Solaria公司),兔抗鼠apoJ抗体(Proteintech公司),Anti-GAPDH,二抗-羊抗兔IgG(Bios公司),10~170 kD电泳蛋白彩色预Marker(Thermo公司),ECL发光液(Millipore公司),重组质粒pEGFP-N1-apoJ和空质粒pEGFP-N1由上海生工完成并提供。
1.2大鼠骨髓间充质干细胞的培养
大鼠骨髓间充质干细胞由四川医科大学附属第一医院中心实验室赠送,采用贴壁培养法。
1.3脂质体介导重组质粒pEGFP-N1-apoJ和空质粒pEGFP-N1瞬时转染大鼠骨髓间充质干细胞
胰蛋白酶消化第3代大鼠骨髓间充质干细胞,以5~6×106接种于6孔板中,细胞接种到6孔板融合达90%以上时即可进行转染,转染前1天换液。转染前将6孔板中的细胞用无血清培养基冲洗2遍,加入2 ml无血清培养基。转染实验分为A组、B组和C组,A组为实验组,用质脂体LipofectamineTM2000进行pEGFP-N1-apoJ转染;B组为实验对照组,转染空质粒pEGFP-N1;C组为空白对照组,加入等量质脂体,其他步骤均相同。各组所用脂质体量相等,A组所用重组质粒pEGFP-N1-apoJ的量与B组所用空质粒pEGFP-N1的量相等。转染后在37℃、5%二氧化碳的培养箱中培养6 h,6 h后更换含有血清无双抗的全培养基继续培养。转染24 h后,于荧光显微镜下观察荧光表达情况,并利用流式细胞仪分别测定转染后1 d、2 d、3 d和5 d时的表达效率。
1.4重组质粒pEGFP-N1-apoJ携带的目的基因apoJ在大鼠骨髓间充质干细胞中表达的检测
采用Real-time PCR法检测重组质粒pEGFPN1-apoJ携带的目的基因apoJ在大鼠骨髓间充质干细胞中的表达,转染72 h后,分别收集A组、B组和C组细胞,一步法提取各组细胞总RNA,行逆转录,用先前设计的正反向引物(见附表),通过Real-time PCR法检测apoJ基因的表达,并行各组PCR产物2%琼脂糖凝胶电泳分析。Real-time PCR条件为:Stage 1:预变性95℃、30 s,1个循环,Stage 2:PCR反应95℃、5 s,58℃、34 s,共40个循环。
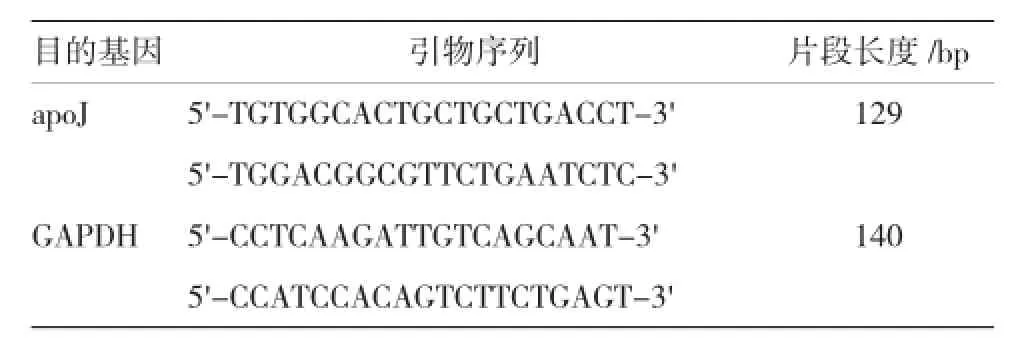
附表 apoJ及GAPDH mRNA的引物序列
1.5免疫细胞化学法检测apoJ蛋白的表达
转染72 h后,取出3组细胞爬片。经4%多聚甲醛固定,用3%过氧化氢处理,滴加5%BSA,37℃孵育20 min,去血清,滴加兔抗鼠apoJ抗体(1∶100),4℃过夜。加二抗,37℃孵育30 min;上述各操作步骤之间均用PBS振荡洗涤。最后用DAB显色,常规脱水、封片,显微镜下观察。
1.6利用Western blot法检测apoJ蛋白的表达
转染72 h后,分别收集3组细胞,行贴壁细胞蛋白提取。利用Western blot法进行检测apoJ蛋白的表达,制胶,上样行SDS-PAGE蛋白电泳,转膜,封闭,孵兔抗鼠apoJ一抗(1∶1 000)4℃过夜,孵山羊抗兔二抗1 h,暗室内曝光,显影、定影。
2 结果
2.1大鼠骨髓间充质干细胞的形态学观察
光学显微镜下观察,大鼠骨髓间充质干细胞未贴壁时为圆形单核细胞,折光性强。12~24 h后开始贴壁,贴壁后形态发生改变,变为多角形和扁平形。培养10~14 d培养板孔内即可达90%融合,形态变为长梭形为主(见图1)。第5~6代后细胞形态趋于稳定相同,挤压成束状,漩涡状,细胞胞浆丰富,核大,核仁也较明显。
2.2脂质体介导质粒对大鼠骨髓间充质干细胞瞬时转染
经脂质体LipofectamineTM2000介导转染24 h后,由于脂质体本身的细胞毒性,造成3组细胞均出现少量呈悬浮状的絮状物,经换液去除这些死细胞后未再发生上述现象。转染24 h后在荧光显微镜下观察,A组和B组均有较多的细胞出现绿色荧光,C组细胞未见荧光。绿色荧光多见于折光性强、处于分裂期的细胞;绿色荧光强弱不均,提示基因转入的拷贝数略有差异。至转染后72 h绿色荧光最明显(见图2),以后无明显改变,5 d以后绿色荧光呈逐渐下降趋势。利用流式细胞仪测定EGFP在第1、2、3、5天对骨髓间充质干细胞的转染效率分别为28.60%、31.67%、34.62%和15.32%。
2.3重组质粒pEGFP-N1-apoJ携带的目的基因apoJ在大鼠骨髓间充质干细胞中的表达
转染72 h后,经Real-time PCR扩增后,3组细胞均有不同程度的apoJ mRNA表达,但A组细胞apoJ mRNA表达量明显高于其他两组,提示A组细胞除细胞本身内源性apoJ基因表达外,同时存在pEGFP-N1-apoJ携带的外源性目的基因apoJ表达(见图3)。Real-time PCR扩增产物进行2%琼脂糖凝胶电泳分析,A组、B组和C组细胞均在129 bp处有一特异性扩增条带,提示均有apoJ基因转录,应用Ea-gle EyeⅡ型图像分析处理系统对电泳带进行扫描,根据各条带光密度值,计算各组apoJ mRNA表达的相对水平,结果提示A组细胞apoJ mRNA表达水平明显高于其他两组(见图4)。
2.4转染后3组细胞经免疫细胞化学法检测apoJ蛋白的表达
转染72 h后,3组细胞爬片经免疫细胞化学法检测,A组阳性细胞率明显高于其他两组。提示A组细胞转染外源性目的基因apoJ后,外源性目的基因apoJ得到高效的转录和翻译(见图5)。
2.5转染后 3组细胞经 Western blot法检测apoJ蛋白的表达
转染72 h后,3组细胞利用Western blot进行检测apoJ蛋白的表达,A组细胞可见apoJ蛋白大量表达,B、C组细胞见apoJ蛋白微量表达,利用quantity one软件进行条带灰度值分析,结果表明A组细胞apoJ蛋白表达量明显高于B、C组细胞。提示A组细胞转染外源性目的基因apoJ后,外源性目的基因apoJ得到高效的转录和翻译(见图6)。

图1 MSCs原代培养10~14 d(×100)
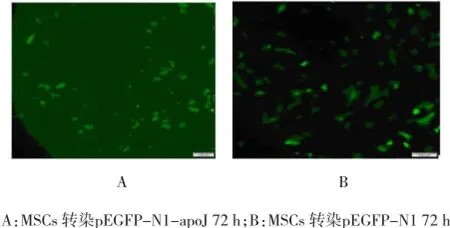
图2 转染72 h时荧光显微镜观察 (×100)
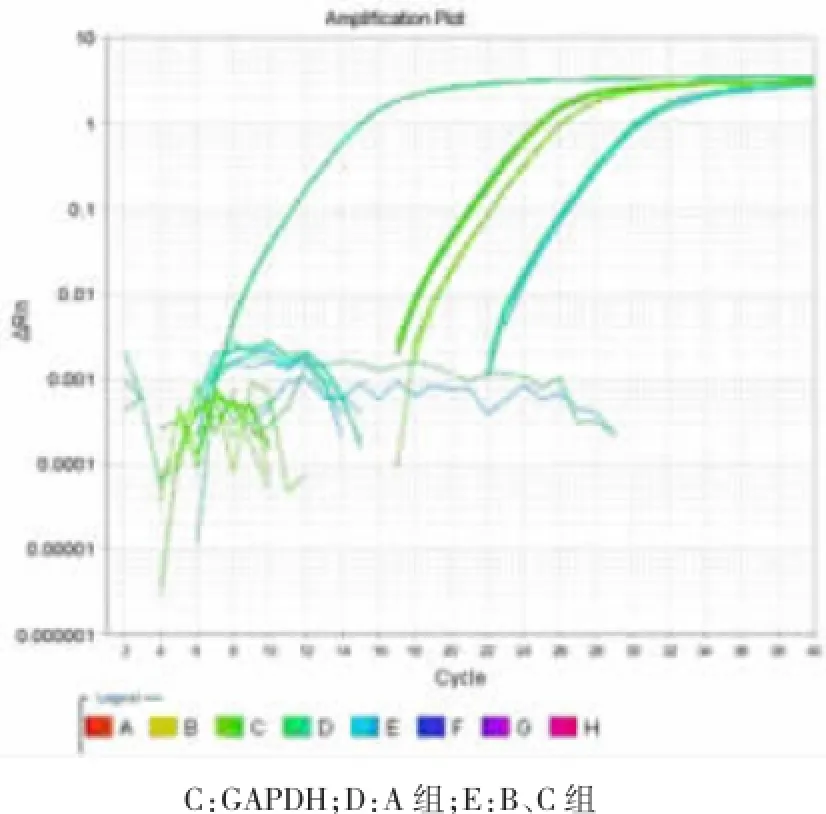
图3 转染72 h时 Real-time PCR
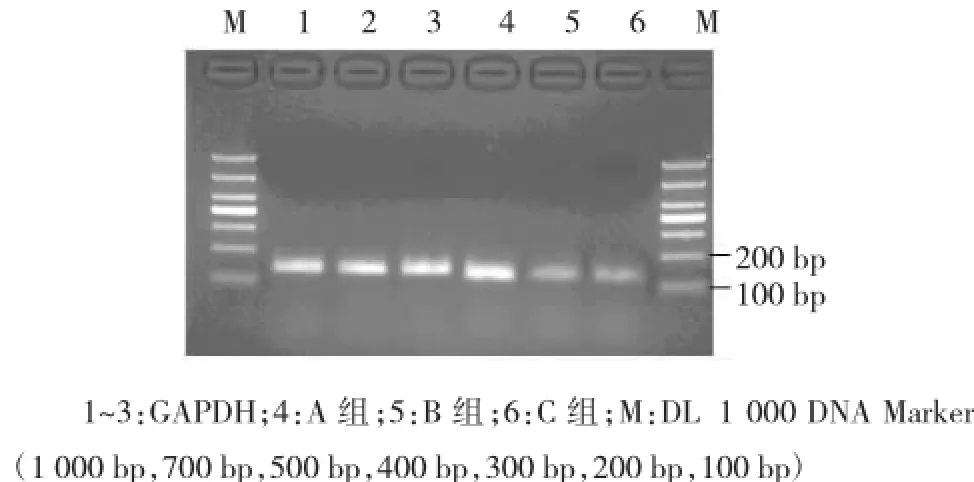
图4 转染72 h时Real-time PCR扩增产物电泳
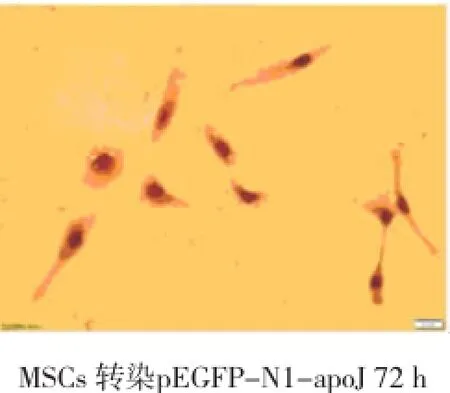
图5MSCs转染p-EGFP-N1-apoJ 72 h细胞免疫组织化学 (×400)
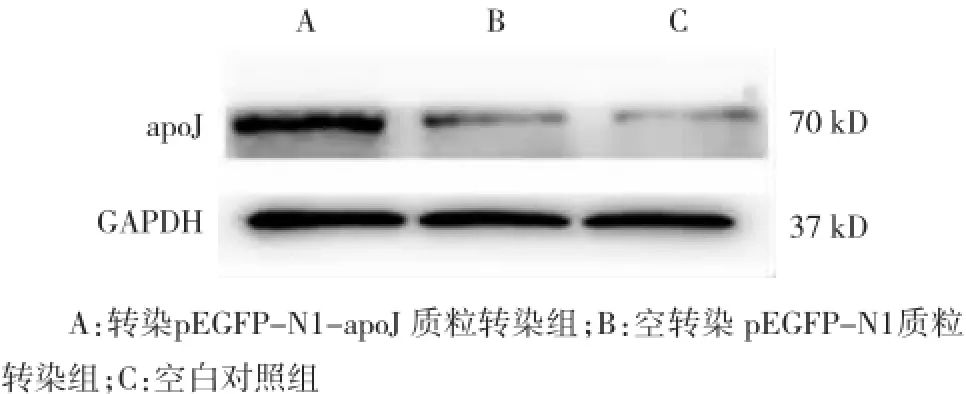
图6 Western blot检测转染72 h时apoJ的表达
3 讨论
apoJ是一种杂二聚体糖蛋白,由两个亚单位α 和β链组成,相对分子质量为70 000。广泛分布于各种组织和体液中[1-3],人apoJ mRNA在脑组织中浓度最高,依次分别为睾丸、卵巢、肝、心和肺,在脾、乳腺和膀胱中含量最少。apoJ在多种神经系统疾病中均有高表达[4],在神经系统疾病中的作用日益受到重视。相关研究表明[5-6],apoJ具有抑制细胞凋亡、参与补体调节抑制炎症反应、参与脂质代谢等多种生理功能。补体激活引起的炎症反应和细胞凋亡在脑出血后继发性损伤中的作用日益受到重视[7],炎症反应和细胞凋亡是脑出血疾病重要的病理生理机制,抑制炎症反应和细胞凋亡成为治疗脑出血的新方法[8]。有关apoJ保护神经细胞的具体机制目前尚未明确,CALERO等[9]的研究表明:脑损伤后apoJ浓度上调是对神经元的一种保护反应,主要有4种机制:①apoJ可作为反凋亡信号;②抑制补体形成膜攻击复合物,从而抑制炎症;③apoJ具有抗氧化作用;④和部分炎症相关蛋白结合,抑制这些蛋白导致的炎症反应。apoJ与阿尔茨海默病、前列腺癌和乳腺癌的相关研究报道较多,而与脑血管疾病的研究报道不多。相关研究表明,apoJ还具有促进神经元分化和营养神经元的作用[10],亦有利于神经元的可塑性[11]。
MSCs最早是由FRIEDENSTEIN等[12]从骨髓中分离培养出来,是一种具有多向分化潜能的原始细胞,在特定环境下可分化为所在组织的表型细胞。骨髓间充质干细胞可分化为多种细胞,如骨细胞、肌腱细胞、脂肪细胞、神经细胞和神经胶质细胞[13-14]。KOPEN等[15]首次报道将骨髓间充质干细胞注入新生鼠侧脑室可以分化为神经元和神经胶质细胞。有关研究表明骨髓间充质干细胞可以诱导分化为特定类型和有功能的神经元[16-18],并且通过独立的调节机制完成向神经元分化[19]。骨髓间充质干细胞有类似神经干细胞的多向分化潜能,但又有其他干细胞没有的特性,使其成为干细胞移植治疗中枢神经系统损伤的理想细胞供体和转基因的细胞载体[20-22]。干细胞移植治疗中枢神经系统损伤,使损伤轴突再生、突触重建和恢复部分功能成为可能,骨髓间充质干细胞除了具有干细胞的一般特性外,还具有取材方便、不涉及伦理问题、易于外源基因转染及稳定表达、免疫原性弱、可进行自体移植等优点,被认为是一种细胞替代治疗及基因治疗的理想靶细胞[23]。另外,有研究表明骨髓间充质干细胞可分泌多种细胞因子,发挥抗凋亡、抗炎,促进脑损伤组织内源性修复等作用[24-25]。
THAMBISETTY等[26]研究提示apoJ具有保护神经元的作用,本研究通过构建重组质粒pEGFP-N1-apoJ转染大鼠骨髓间充质干细胞,尝试建立apoJ基因修饰的骨髓间充质干细胞体系,为后续进一步研究apoJ的作用机制及进一步为临床基因工程干细胞移植治疗脑出血提供一定的理论基础。本研究通过脂质体介导pEGFP-N1-apoJ对大鼠骨髓间充质干细胞进行转染,经实时定量PCR、免疫细胞化学及Western blot检测,apoJ在骨髓间充质干细胞中得以转录和翻译,说明携带外源性apoJ基因的骨髓间充质干细胞构建成功。基于上述原因,采用表达外源性apoJ的骨髓间充质干细胞移植治疗脑出血,可以产生双重作用:一方面,外源性携带apoJ基因骨髓间充质干细胞能分化为神经元和神经胶质细胞,以补充脑出血后脑损伤丢失的细胞,在结构上修复和重建神经环路;另一方面,携apoJ基因骨髓间充质干细胞分泌高水平的apoJ可以改善脑出血部位及周围组织的微环境,并通过多种途径抑制炎症反应及神经细胞凋亡,促进受损神经元和神经胶质细胞的功能恢复。本研究提示携外源性apoJ基因骨髓间充质干细胞体外培养构建成功,并且外源性目的基因apoJ得到高水平表达,为进一步开展携apoJ基因骨髓间充质干细胞移植治疗脑出血的实验提供一定的实验基础和理论依据,希望能够成为新的脑出血疾病治疗措施。
[1]TROUGAKOS IP,SO A,JANSEN B,et al.Silencing expression of the clusterin/apolipoprotein J gene in human cancer cells using small interfering RNA induces spontaneous apoptosis,reduced growth ability,and cell sensitization to genotoxic and oxidative stress[J].Cancer Res,2004,64(5):1834-1842.
[2]PUCCI S,BONANNO E,PICHIORRI F,et al.Modulation of differentclusterinisoformsinhumancolontumorigenesis[J]. Oncogene,2004,23(13):2298-2304.
[3]GLEAVE M,MIYAKE H.Use of antisense oligonucleotides targeting the cyto-protective gene,clusterin,to enhance androgen and chemo-sensitivity in prostate cancer[J].World J Urol,2005,23(1):38-46.
[4]ELLIOTT DA,WEICKERT CS,GARNER B.Apolipoproteins in the brain:implications for neurological and psychiatric disorders[J]. Clin Lipidol,2010,51(4):555-573.
[5]SUBRAMANIAN C,JARZEMBOWSKI JA,HALSEY SM,et al. CLU blocks HDAC-mediated killing of neuroblastoma[J].Tumour Bio1,2011,32(2):285-291.
[6]YU JT,TAN L.The role of clusterin in Alzheimer's disease: pathways,pathogenesis,and therapy[J].Mol Neurobio1,2012,45(2): 314-326.
[7]ARONOWSKI J,HALL CE.New horizons for primary intraeerebral hemorrhage treatment:experience from preclinical studies[J]. Neurol Res,2005,27(3):268-269.
[8]周志强,赵立波,王凤英,等.rh EPO抑制大鼠脑出血后炎症反应与增强LIVIN的表达[J].重庆医学,2009,38(9):1067-1070.
[9]CALEROM,ROSTAGNOA,MATSUBARAE,etal. Apolipoprotein J(clusterin)and Alzheimer's disease[J].Microsc Res Tech,2000,50(4):305-315.
[10]CORDERO LO,SCOTT SA,MASLEN SL,et al.Clusterin secreted by astrocytes enhances neuronal differentiation from human neural precursor cells[J].Cell Death Differ,2011,18(5): 907-913.
[11]WICHER G,FEX SA,VELSECCHI I,et al.Extracellular clusterin promotes neuronal network complexity in vitro[J].Neuroreport,2008,19(15):1487-1491.
[12]FRIEDENSTEIN AJ,PETRAKOVA KV,KUROLESOVA AB,et al.Heterotopic of bone marrow.Analysis of precursor cells for osteogenic and hematopoietic tissues[J].Transplantation,1968,6(2): 230-247.
[13]VAWDA R,FEHLINGS MG.Mesenchymal cells in the treatment of spi nal cord injury:current&future perspectives[J]. Curr Stem Cell Res Ther,2013,8(1):25-38.
[14]李盛华,郭平德,王文晶.中药诱导骨髓间充质干细胞向神经样细胞分化的研究进展[J].中国骨伤,2010,23(3):233-234.
[15]KOPEN GC,PROCKOP DJ,PHINNEY DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiateintoastrocytesafterinjectionintoneonatalmouse brains[J].J Proc Natl Acad Sci USA,1999,96(19):10711-10716.
[16]LI TY,SHU C,WANG CH,et al.Plasticity of rat bone marrow-derived 5-hydroxytryp-tamine-sensitive neurons:dedifferentiation and redifferentiation[J].Cell Biol Int,2004,28(11):801-807.
[17]GUO L,YIN F,MENG HQ,et al.Differentiation of mesenchymal stem cells into dopaminergic neuron-like cells in vitro[J]. Biomed Environ Sci,2005,18(1):36-42.
[18]CHO KJ,TRZASKA KA,GRECO SJ,et al.Neurous derived from human mensenchymal stem cells show synaptic transmission and can be induced to produce the neurotransmitter substance P by interlenkin-lalpha[J].Stem Cells,2005,23(3):383-391.
[19]SUON S,JIN H,DONALDSON AE,et al.Transient differentiation of adult human bone marrow cells into neuron-like cells in culture:development of morphological and biochemical traits is mediated by different molecular mechanisms[J].Stem Cells Dev,2004,13(6):625-635.
[20]VAQUERO J,ZURITA M,OYA S.Cell therapy using bone marrow stromal cells in chronic paraplegic rats:systemic or local administration[J].Neurosci Lett,2006,398:129-134.
[21]KIM BG,HWANG DH,LEE SI,et al.Stem cell-based cell therapy for spinal cord injury[J].Cell Transplant,2007,16(4): 355-364.
[22]PARR AM,KULBATSKI I,TATOR CH.Transplantation of adult rat spinal cord stem/progenitor cells for spinal cord injury[J].J Neurotrauma,2007,24(5):835-845.
[23]RITFELD GJ,NANNOE TR,VAJN K,et al.Bone marrow stromal cellmediated tissue sparing enhances functional repair after spinal cord contusion in adult rats[J].Cell transplant,2012,21(7):1561-1575.
[24]庄淑波,刘毅,陈克明,等.大鼠骨髓间充质干细胞体外分离、纯化与培养适宜条件的筛选[J].中国组织工程研究与临床康复,2007,11(20):3886-3891.
[25]鹿寒冰,董瑞国,李晓宾,等.大鼠实验性脑梗死后AQP4表达与MRI变化的相关性研究[J].卒中与神经疾病,2011,18(6):348-352.
[26]THAMBISETTY M,AN Y,KINSEY A,et al.Plasma clusterin concentration is associated with longitudinal brain atrophy in mild cognitive impairment[J].Neuroimage,2012,59(1):212-217.
(张蕾 编辑)
Construction of recombinant plasmid pEGFP-N1-apoJ and its expression in rat bone marrow
mesenchymal stem cells in vitro*
Chong ZHOU1,Xue-liang LIU1,Xiao-mei ZHENG2,Liang LIU1
(1.Department of Neurosurgery,2.Department of Neurology,the Affiliated Hospital,Sichuan Medical University,Luzhou,Sichuan 646000,P.R.China)
【Objective】To construct recombinant plasmid pEGFP-N1-apolipoprotein J(apoJ),transfect it into rat bone marrow mesenchymal stem cells(MSCs),and detect its expression in rat bone marrow mesenchymal stem cells in vitro.【Methods】Rat bone marrow MSCs were transiently transfected with the recombinant plasmid pEGFP-N1-apoJ and the transfection efficiency of green fluorescent protein(GFP)was determined. Real-time PCR,Western blot and immunocytochemistry analysis were also performed for detection of apoJ expression in rat bone marrow MSCs.【Results】Transient transfection efficiency reached 35%.After transfection,the transcription of apoJ was detected in MSCs and the expression of apoJ protein was also verified. 【Conclusions】Recombinant plasmid pEGFP-N1-apoJ has been successfully constructed,transfected into rat bone marrow MSCs and expressed in rat bone marrow MSCs.This procedure may be helpful for the application of apoJ to gene therapy and provide the experimental basis for the further study of apoJ as a new treatment of cerebral hemorrhage.
apolipoprotein J(apoJ);recombinant plasmid;gene transfection;bone marrow mesenchymal stem cell
R-332
A
1005-8982(2015)33-0015-05
2015-06-26
四川省卫生厅课题基金(No:110597)
刘亮,E-mail:liulst@163.com;Tel:15348216516

