肝癌中过氧化物酶-1的表达及临床意义
涂青松,何剪太2(中南大学湘雅医院 .肿瘤科,2.普外科,湖南 长沙 40008)
肝癌中过氧化物酶-1的表达及临床意义
涂青松1,何剪太2
(中南大学湘雅医院 1.肿瘤科,2.普外科,湖南 长沙 410008)
目的探讨过氧化物酶-1(Prx-1)在肝癌中的表达,并评估其在肝癌诊疗中的临床价值。方法采用免疫组织化学方法检测患者肝癌组织和癌旁组织中Prx-1的表达。酶联免疫吸附法(ELISA)检测血清Prx-1水平。结果免疫组织化学结果表明,Prx-1在肝癌组织中的阳性表达率为75.4%,高于癌旁组织(36.8%)(P<0.05)。Prx-1表达与肿瘤组织中的血管内皮生长因子(VEGF)、微血管密度(MVD)呈正相关。ELISA结果表明,与健康对照志愿者比较,肝癌患者血清Prx-1水平更高[(31.2±13.5)ng/ml vs(13.2±11.9)ng/ml,P=0.000)]。Prx-1表达与恶性临床病理参数有相关性。血清Prx-1与AFP结合时,曲线下面积(AUC)明显高于单独Prx-1。阳性Prx-1表达与不良总生存期(OS)及无病存活率(DFS)有相关性(P=0.002和0.000)。多变量分析表明,Prx-1染色是不良OS及DFS的独立生物标记物(P=0.035和0.000)。结论肝癌患者Prx-1表达水平显著升高,Prx-1表达上调与肿瘤血管生成密切相关,有望成为肝癌诊断和预后的标记物。
肝癌;过氧化物酶-1;免疫组织化学;血管内皮生长因子
原发性肝癌是最常见的恶性肿瘤之一,每年死于肝癌的人数达37万[1-2]。由于肝癌早期症状隐匿,难以早期诊断且易发生转移,使肝癌患者预后差,致死率高居不下。若不对肝癌患者采取治疗措施,5年存活率<5%[3-4]。虽然肝癌治疗已取得一定程度的进展,但是肝癌患者5年期存活率仍<5%[5]。患者预后不良的主要原因是80%肝癌患者确诊时已处于晚期,且由于局部浸润和远端转移,失去根治性手术机会[6]。因此,寻找肝癌早期诊断和临床愈后的标记物已成为当务之急。
过氧化物酶-1(Peroxiredoxin-1,Prx-1)属于巯基特异性抗氧化蛋白家族成员,可调节过氧化氢水平,介导信号转导通路[7]。Prx-1参与细胞增殖、分化和凋亡等多种生物功能的调节[8]。近年来研究表明,Prx-1在乳腺、肺、泌尿系统和胃癌等人类肿瘤中过表达[9-16]。
SHEN等[17]通过二维凝胶电泳和质谱分析发现,肝癌中Prx-1表达上调。但是Prx-1表达上调对肝癌的临床意义尚不清晰。因此,本实验采用免疫组织化学法分析114例患者肝癌组织及其相应癌旁组织中Prx-1的表达,另外还检测肝癌组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)和CD31的表达;并分析Prx-1表达与VEGF、微血管密度(microvessel density,MVD)、临床病理特征及患者存活率的相关性。使用酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)检测患者血清中Prx-1含量,探讨患者术前血清Prx-1水平与临床病理特征的相关性,评估Prx-1在肝癌筛查中的作用价值。
1 资料与方法
1.1研究对象
选取2010年1月-2010年12月湖南省肿瘤医院的肝癌病例,114例肝癌组织标本。所有患者行手术治疗,手术前未行放射及化学药物治疗,经病理确诊为肝癌,患者年龄29~63岁,中位年龄(48± 2.1)岁。114例肝癌患者中,年龄≥60岁49例,<60 岁65例;肿块直径<2 cm患者65例,≥2 cm患者49例;肝癌组织学分级标准参照肝和肝内胆管肿瘤组织学分类(世界卫生组织2000年标准),组织学分级:G1级21例,G2级39例,G3级54例;肝癌分期标准参照2002年版美国癌症联合委员会(Amercian Joint Committee on cancer,AJCC)标准,TNM分期:Ⅰ、Ⅱ期72例,Ⅲ、Ⅳ期42例;所有患者中伴有淋巴结转移68例,无淋巴结转移46例。所有患者接受定期随访,直至死亡或随访结束(2014年12月)。评价随访期为33.6个月(6~42个月)。患者定期接受身体检查、超声检查,如有必要进行CT扫描。总生存期(overall survival,OS)是指手术至死亡的间隔时间。
1.2免疫组织化学法
免疫组织化学法染色检测肝癌及其相应癌旁组织中Prx-1、VEGF及CD34的表达。切取癌组织、癌旁组织及正常组织,福尔马林固定24 h,酒精逐级脱水,石蜡包埋,然后制成组织切片,脱腊至水,磷酸盐缓冲溶液(phosphate buffer saline,PBS)振洗3 min×3;3%过氧化氢封闭30 min,以消除内源性过氧化物酶活性,防止非特异性染色,PBS振洗3 min× 3;3 mol/L尿素消化30 min,充分暴露抗体,柠檬酸修复,PBS振洗3 min×3;用滤纸擦干后置于湿盒内,37℃正常血清封闭30 min;滴加3μg/ml一抗,置于4℃冰箱过夜;第2天将切片取出后37℃复温30 min,PBS振洗3 min×3;滴加二抗,37℃湿盒内孵育30min,PBS振洗3 min×3;滴加亲和素-生物素-过氧化物酶复合物(avidin-biotin-peroxidase complex technique,ABC),37℃湿盒内孵育30 min,PBS振洗3min×3;二氨基联苯胺(Diaminobenzidine,DAB)显色20 min,自来水充分冲洗,苏木素淡染,酒精逐级脱水、透明、封片。
1.3结果判定
采用双盲法观察阳性结果。所有免疫组织化学染色结果经过湖南省肿瘤医院两位病理科副教授独立判定。Prx-1阳性定位于肝癌组织中的细胞核,阳性染色成棕黄色,光镜下每张切片中选取癌细胞较多的5个高倍视野(×200),每个视野计数100个细胞。细胞核呈棕黄色至棕黑色细胞数>10%为阳性(+),≤10%或无着色为阴性(-)。CD34和VEGF以细胞质和/或胞核内出现棕黄色颗粒为阳性。高倍镜观察5个视野,判断标准:棕黄色细胞>5%为阳性(+),≤5%或无着色为阴性(-)。
1.4ELISA法
采用ELISA法检测肝癌患者血清中Prx-1含量,试剂盒购自美国R&D公司,按试剂盒说明书进行操作。
1.5统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,用t检验或单因素方差分析,计数资料以率表示,用χ2检验和Spear man相关检验分析免疫组织化学结果。使用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析、评估血清Prx-1、CA19-9及联合诊断肝癌的潜力。使用卡普兰Meier法绘制生存曲线,存活率的比较用对数秩检验。使用Cox回归模型确定术后肝癌患者独立预后因素。所有检验为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1Prx-1和VEGF在肝癌组织中的表达
免疫组织化学结果显示,不同染色强度的Prx-1局部存在于肝癌细胞细胞质中(见图1)。与相邻的非肝癌组织比较(42/114,36.8%),肝癌组织Prx-1 (86/114,75.4%)阳性率显著升高(P=0.027)。
114例样本中,75例肝癌组织细胞质中存在VEGF阳性表达(65.8%)(见图1)。Spearman秩相关检验表明,肿瘤组织中Prx-1与VEGF的表达呈正相关(r=0.315,P=0.003),见表1。
2.2肝癌组织中Prx-1表达与MVD的相关性
CD34染色结果提示,平均MVD为13.9(2~37)(见图1)。Prx-1阳性表达的肝癌组织MVD明显高于 Prx-1阴性表达的肝癌组织 [(14.9±7.7)vs (10.9±7.0),P=0.016)]。MVD≥均值认为是高MVD,而MVD<均值认为是低MVD。Spearman秩相关检验也显示,Prx-1表达与肿瘤组织MVD呈正相关(r=0.241,P=0.026)(见表1)。
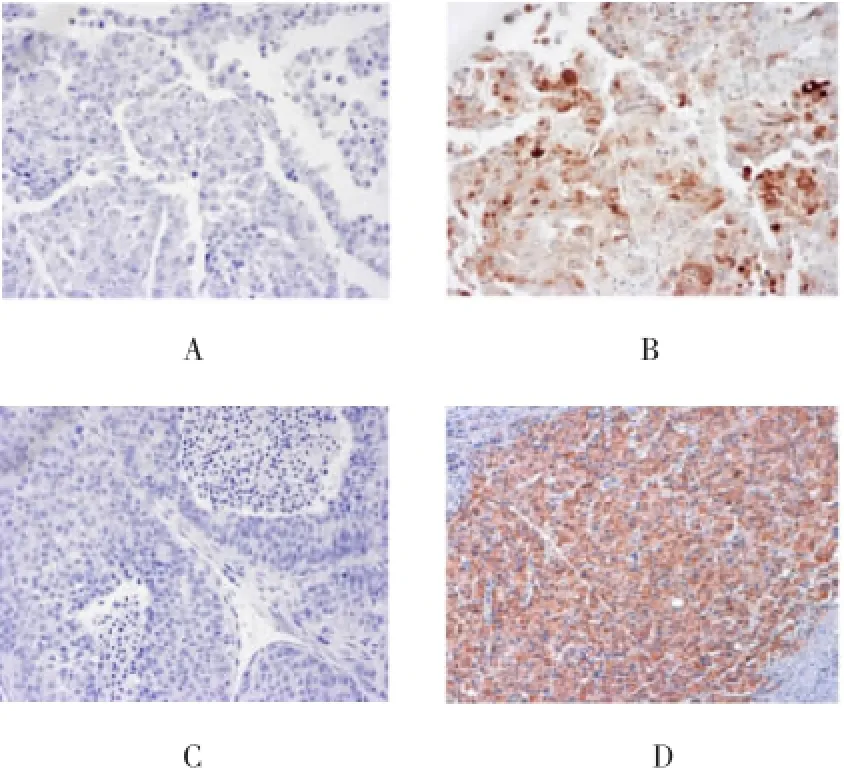
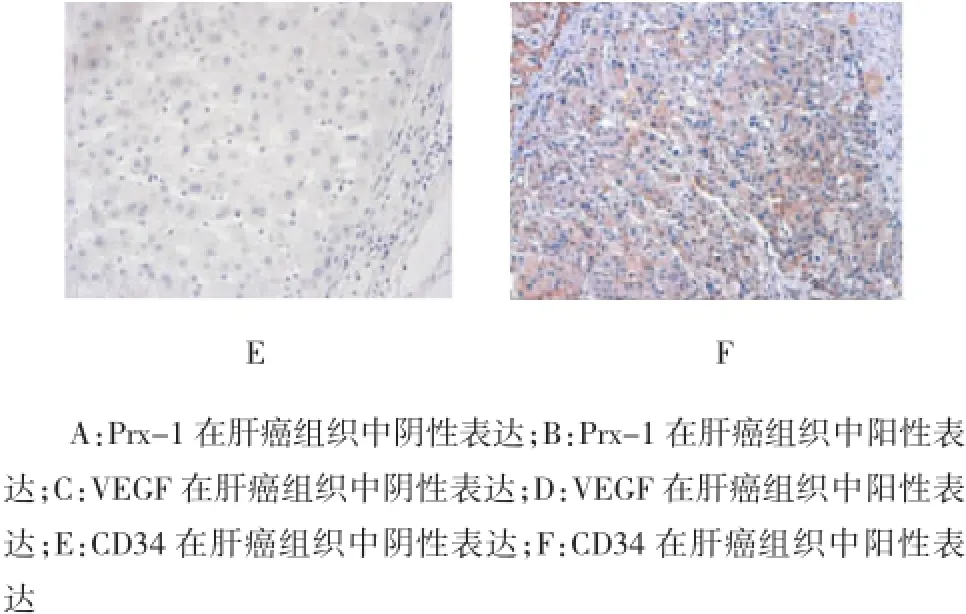
图1 Prx-1、VEGF及CD34在肝癌组织中的表达(×200)
2.3Prx-1表达与临床病理参数的相关性Prx-1表达与组织学分级、神经浸润、淋巴结转移、血清CA19-9及TNM分期有相关性(P=0.016、 0.004、0.007、0.025和0.003)。而Prx-1表达与年龄、性别、肿瘤部位、肿瘤直径无相关。见表2。

表1 Prx-1表达与VEGF、MVD的相关性 例
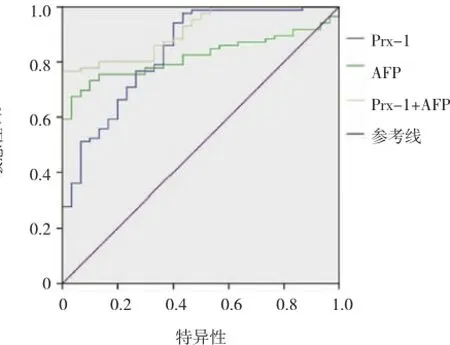
图2 血清Prx-1、AFP及Prx-1联合AFP诊断肝癌的ROC曲线
2.4肝癌患者血清Prx-1含量
ELISA结果提示,肝癌患者血清Prx-1水平高于正常志愿者(31.2±13.5)ng/ml vs(13.2±11.9)ng/ml,P=0.000)。并且晚期肝癌患者血清Prx-1水平更高(见表2)。本研究还通过绘制ROC曲线评估血清Prx-1在肝癌诊断中的准确性和可靠性。血清Prx-1水平可区分出健康志愿者和肝癌患者 [曲线下面积(area under curve,AUC)=0.839,(95%CI:0.754和0.923)](见图2)。与血清甲胎蛋白(alpha-fetal pro-tein,AFP)联合检测能提高血清Prx-1诊断肝癌的能力,[AUC=0.913,(95%CI:0.863和0.963)]。
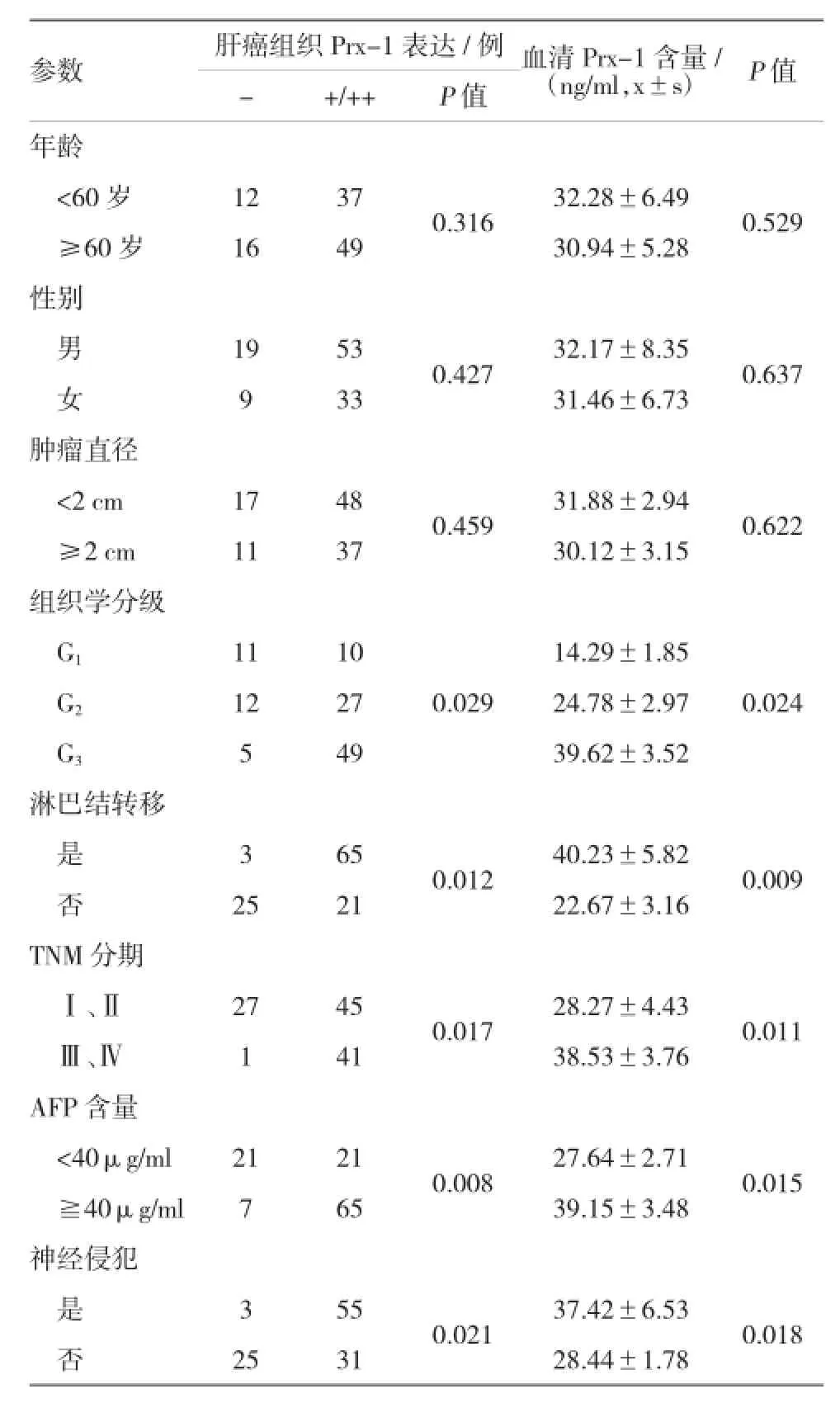
表2 临床病理参数与Prx-1表达的相关性
2.5生存分析
采用卡普兰Meier曲线法分析Prx-1表达对患者OS和无病生存期(Disease-freesurvival,DFS)的影响,结果表明,Prx-1阳性表达肝癌患者OS明显较Prx-1阴性表达短(11个月vs 28个月,P=0.002)。Prx-1阳性表达肝癌患者DFS明显较Prx-1阴性表达短(6个月vs 21个月,P=0.001)。见图3。
单因素分析提示,Prx-1表达、组织学分级、神经侵犯、淋巴结转移、血清AFP及TNM分期对OS和DFS的预后影响较大,见表3。多变量生存分析进一步表明,肿瘤Prx-1阳性是肝癌患者OS及DFS不良预后的标记物[HR1=3.126,(95%CI1:1.425和7.018),P1=0.035;HR2=4.805,(95%CI2:2.136和10.812),=0.000]。另外,组织学分级、血清AFP及TNM分期也是OS和DFS的独立预测物。见表4。
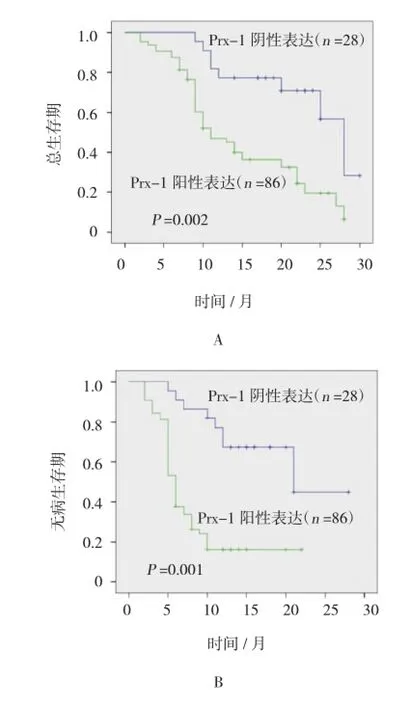
图3 卡普兰Meier曲线分析Prx-1表达对肝癌患者OS和DFS表达的影响
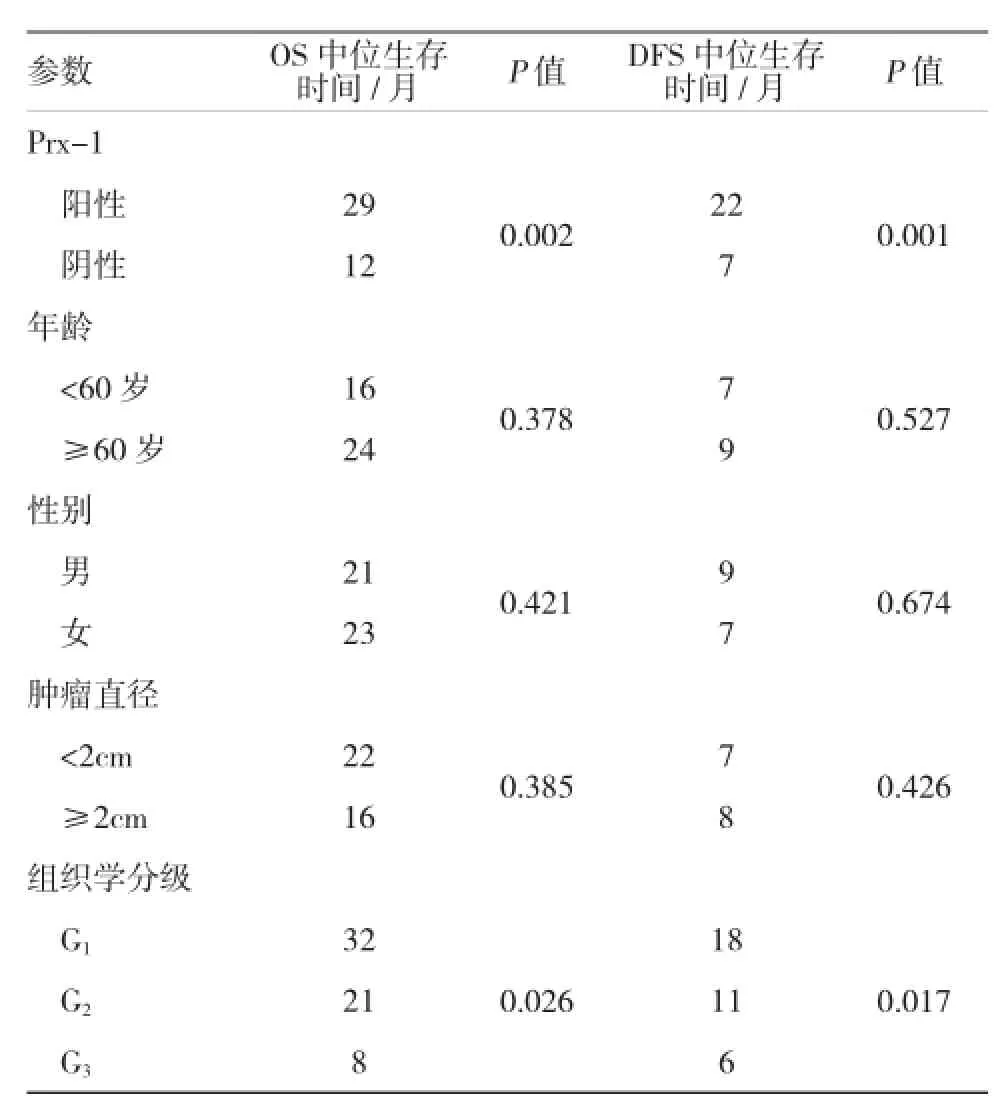
表3 单因素影响肝癌患者OS和DFS的预后因素
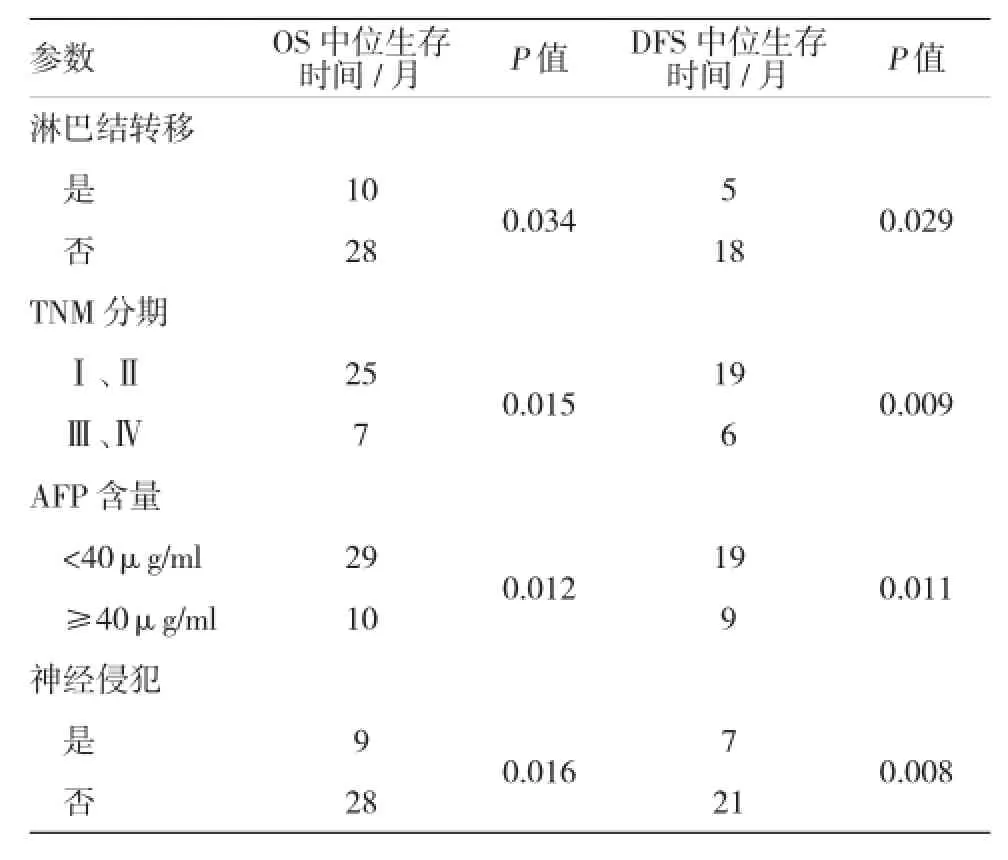
续表3
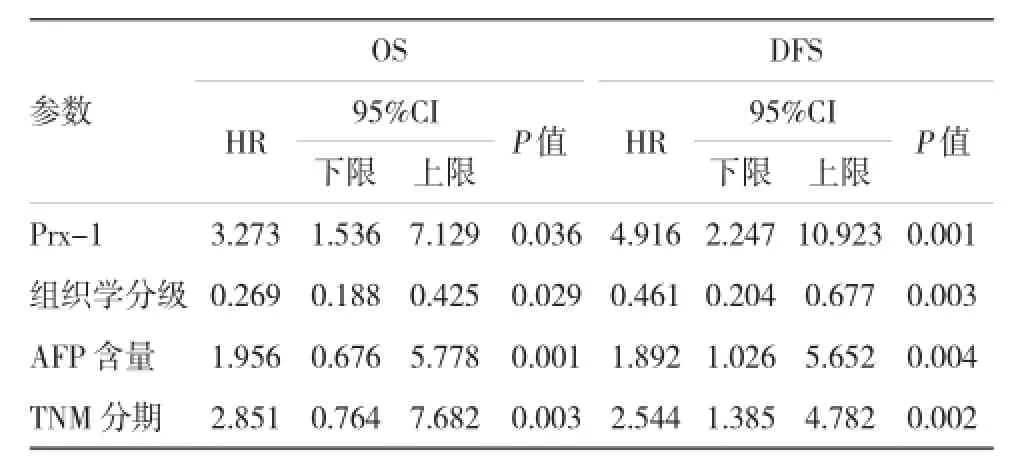
表4 多因素分析影响肝癌患者OS 和DFS的预后因素
3 讨论
有研究发现,Prx-1在肺癌、胃癌、结肠癌及宫颈癌等多种人类肿瘤中异常高表达[9-14]。本研究发现肝癌组织中Prx-1表达明显高于相应癌旁组织,与以往研究结果一致[17]。另外本研究发现,与健康受试者比较,肝癌患者血清Prx-1含量显著升高,提示血清Prx-1可成为早期诊断肝癌的有效血清标记物。尽管AFP、γ-谷氨酰转肽酶、凝血酶原、血清岩藻糖苷酶和酸性铁蛋白等多种血清标记物可用于肝癌诊断,但单独使用时,这些标志物的敏感性和特异性较低[18-20]。联合使用肝癌标记物可显著提高肝癌诊断的敏感性和特异性[21]。
肺癌的研究证实血清Prx-1含量在肿瘤诊断中价值[22]。宫颈癌中Prx-1也有诊断意义,其与血清CA125联合使用时可提高宫颈癌的诊断效能[14]。因此,本研究试图探讨Prx-1在肝癌诊断中的价值。结果表明,根据ROC曲线的AUC值,血清Prx-1与AFP诊断肝癌的特异性和敏感性比较差异无统计学意义。血清Prx-1和CA19-9联合使用时,AUC值显著高于两者单独使用,提示血清Prx-1与其他肿瘤标记物联合使用能够进行有效的肝癌早期筛查。
越来越多的证据表明,Prx-1在肿瘤发生、发展中具有重要作用[23-24]。REN等[23]报道,作为肿瘤相关抗原,Prx-1可促进食管鳞状细胞癌恶性转化。HA等[24]研究揭示,癌变细胞中,过量表达Prx-1通过诱导转变生长因子β1,促进上皮间质转化(epithelialmesenchymal transition,EMT)。EMT被认为是恶性肿瘤侵袭和转移过程中的重要环节。EMT过程中,由于恶性肿瘤细胞失去其上皮细胞特征,获得间充质细胞特征,恶性肿瘤可迅速发展[25]。肝癌的迅速进展取决于增强细胞外基质降解的独特肿瘤微环境因素[26],而且EMT也是肿瘤微环境的重要事件。肿瘤微环境的不同成分为EMT提供稳定条件[27-28]。本研究结果表明,Prx-1上调与肝癌恶性生物特性相关。该结果充分证实,Prx-1在肝癌进展中具有重要作用,其可能是肿瘤微环境的重要成分之一,可能介导肝癌中EMT表型转化过程。Prx-1参与EMT的调节机制,其在肿瘤微环境中的特异作用仍需进一步深入研究。
目前普遍认为,肿瘤血管形成在恶性肿瘤侵袭和转移中起至关重要的作用[29-30]。如MVD过程中,血管生成与肝癌及其他恶性肿瘤的进展和不良预后有相关性[31-33]。VEGF是促血管生成的特异性生长因子,被认为是肿瘤血管生成中的重要调节物[34-35]。以往研究表明,在乙型肝炎病毒相关肝细胞癌和胃癌中,VEGF与MVD有相关性[36-37]。本研究发现,肝癌组织中Prx-1表达与VEGF和MVD呈负相关,揭示其促进肿瘤血管生成的作用可能涉及VEGF介导的肿瘤血管生成。目前证实在前列腺癌和肺癌中,Prx-1可诱导VEGF独立性肿瘤血管生成[11-12,14]。但是Prx-1在肝癌肿瘤血管生成中的具体作用机制尚不明确,仍需进一步深入研究。
少数研究证实不同类型肿瘤中Prx-1表达的诊断意义。如KIM[38-39]和YONGLITTHIPAGON等[40]的研究表明,在术后肺癌患者中,Prx-1是提示肿瘤复发、降低存活率的独立预测指标。LI等[41]研究提示,阳性Prx-1表达与OS降低相关,且在胆囊癌患者中可作为独立不良预后因素。HAAPASALO等[42]报道,Prx-1表达与较短的存活率相关,可能在室管膜瘤中起预后生物标记物作用。本研究结果提示,阳性Prx -1表现出不良OS和DFS,可作为不良预后的独立标记物。高Prx-1对患者预后有副作用,间接表明其基因在促进肝癌的进展中起积极作用。但是也有不同的研究结果,有研究发现,Prx-1是阳性雌激素受体乳腺癌中良好预后的独立标记物[43]。因此,本研究结果需更大样本量的研究证实。
总之,本研究发现Prx-1在肝癌组织及肝癌患者血清中表达升高。Prx-1上调与肿瘤血管生成、肝癌进展密切相关。血清Prx-1联合血清AFP可提高肝癌诊断能力。术后患者Prx-1阳性表达可作为不良OS和DFS的独立生物标记物。该发现为进一步探讨肝癌中Prx-1异常高表达的生物相关性提供基础。
[1]JEMAL A,FORMAN D,BRAY F,et al.Global cancer statistics,2012[J].CA:A Cancer Journal for Clinicians,2011,61(2):69-90.
[2]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA: A Cancer Journal for Clinicians,2014,64(1):9-29.
[3]HIDALGO M.Pancreatic cancer[J].N Engl J Med 2010,362 (17):1605-1617.
[4]NJEI B,ROTMAN Y,DITAH I,et al.Emerging trends in hepatocellular carcinoma incidence and mortality[J].Hepatology,2015,61(1):191-199.
[5]HSIEH CH,WEI CK,YIN WV,et al.Vascular invasion affects survival in early hepatocellular carcinoma[J].Molecular Clinical Oncology,2015,3(1):252-256.
[6]HSU YC,WU CY,LIN JT.Hepatitis C virus infection,antiviral therapy,and risk of hepatocellular carcinoma[J].Seminars in Oncology,2015,42(8):329-338.
[7]WOOD ZA,SCHRODER E,ROBIN HJ,et al.Structure,mechanism and regulation of peroxiredoxins[J].Trends Biochem Sci,2003,28(1):32-40.
[8]KIM JH,LEE JM,LEE HN,et al.RNA-binding properties and RNA chaperone activity of human peroxiredoxin 1[J].Biochem Biophys Res Commun,2012,425(4):730-734.
[9]NOH DY,AHN SJ,LEE RA,et al.Overexpression of peroxiredoxin in human breast cancer[J].Anticancer Res,2001,21(3): 2085-2090.
[10]FAN CY,CHOU HC,LO YW,et al.Proteomic and redox-proteomic study on the role of glutathione reductase in human lung cancer cells[J].Electrophoresis,2013,34(24):3305-3314.
[11]RIDDELL JR,BSHARA W,MOSER MT,et al.Peroxiredoxin 1 controls prostate cancer growth through toll-like receptor 4-dependent regulation of tumor vasculature[J].Cancer Res,2011,71(5):1637-1646.
[12]RIDDELL JR,MAIER P,SASS SN,et al.Peroxiredoxin 1 stimulates endothelial cell expression of VEGF via TLR4 dependent activation of HIF-1α[J].PLoS One,2012,7(11):DOI: 10.1371/journal.pone.0050394.
[13]SOINI Y,HAAPASAARI KM,VAARALA MH,et al.8-hydroxydeguanosine and nitrotyrosine are prognostic factors in urinary bladder carcinoma[J].Int J Clin Exp Pathol,2011,4(3): 267-275.
[14]HU JX,GAO Q,LI L.Peroxiredoxin 3 is a novel marker for cell proliferation in cervical cancer[J].Biomedical Reports,2013,1(2):228-230.
[15]HOSHINO I,MATSUBARA H,HANARI N,et al.Histone deacetylase inhibitor FK228 activates tumor suppressor Prdx1 withapoptosis inductioninesophagealcancercells[J].Clin Cancer Res,2005,11(21):7945-7952.
[16]CAO J,SCHULTE J,KNIGHT A,et al.Prdx1 inhibits tumorigenesis via regulating PTEN/AKT activity[J].EMBO J,2009,28(10): 1505-1517.
[17]SHEN J,PERSON MD,ZHU J,et al.Protein expression profiles in pancreatic adenocarcinoma compared with normal pancreatic tissue and tissue affected by pancreatitis as detected by twodimensionalgelelectrophoresisandmassspectrometry[J]. Cancer Res,2004,64(24):9018-9026.
[18]SOBIN LH,COMPTON CC.TNM seventh edition:what's new,what's changed:communication from the international union against cancer and the american joint committee on cancer[J]. Cancer,2010,116(22):5336-5339.
[19]CHEN J,CHEN LJ,YANG RB,et al.Expression and clinical significance of apolipoprotein E in pancreatic ductal adenocarcinoma[J].Med Oncol,2013,30(2):583.
[20]BARÅU A,RUIZ-SAURI A,VALENCIA G,et al.High microvessel density in pancreatic ductal adenocarcinoma is associated with high grade[J].Virchows Arch,2013,462(5):541-546.
[21]JIANG XT,TAO HQ,ZOU SC.Detection of serum tumor markers in the diagnosis and treatment of patients with pancreatic cancer[J].Hepatobiliary Pancreat Dis Int,2004,3(3):464-468.
[22]ROSTILA A,PUUSTINEN A,TOLJAMO T,et al.Peroxiredoxins and tropomyosins as plasmabiomarkers for lung cancer and asbestos exposure[J].Lung Cancer,2012,77(2):450-459.
[23]REN P,YE H,DAI L,et al.Peroxiredoxin 1 is a tumor-associated antigen in esophageal squamous cell carcinoma[J].Oncol Rep,2013,30(5):2297-2303.
[24]HA B,KIM EK,KIM JH,et al.Human peroxiredoxin 1 modulates TGF-β1induced epithelial-mesenchymal transition through its peroxidase activity[J].Biochem Biophys Res Commun,2012,421(1):33-37.
[25]MAIER HJ,WIRTH T,BEUG H.Epithelial-mesenchymal transition in pancreatic carcinoma[J].Cancers,2010,2(4):2058-2083. [26]BINKER MG,BINKER-COSEN MJ,BINKER-COSEN AA,et al.Microenvironmental factors and extracellular matrix degradation in pancreatic cancer[J].JOP,2014,15(4):280-285.
[27]O'CONNOR JW,GOMEZ EW.Biomechanics of TGF-β-in-duced epithelial-mesenchymal transition:implications for fibrosis and cancer[J].Clin Transl Med,2014,3(2):23.
[28]BEZDENEZHNYKH N,SEMESIUK N,LYKHOVA O,et al Impact of stromal cell components of tumor microenvironment on epithelial-mesenchymal transition in breast cancer cells[J].Exp Oncol 2014,36(2):72-78.
[29]FOLKMAN J.Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol,2002,29(16):15-18.
[30]CARMELIET P,JAIN RK.Molecular mechanisms and clinical applications of angiogenesis[J].Nature,2011,473(7347):298-307. [31]BENCKERT C,THELEN A,CRAMER T,et al.Impact of microvessel density on lymph node metastasis and survival after curative resection of pancreatic cancer[J].Surg Today,2012,42(2): 169-176.
[32]TAKAGI K,TAKADA T,AMANO H.A high peripheral microvessel density count correlates with a poor prognosis in pancreatic cancer[J].J Gastroenterol,2005,40(4):402-408.
[33]HOEM D,STRAUME O,IMMERVOLL H,et al.Vascular proliferation is associated with survival in pancreatic ductal adenocarcinoma[J].APMIS,2013,121(11):1037-1046.
[34]VEIKKOLA T,KARKKAINEN M,CLAESSON-WELSH L,et al.Regulation of angiogenesis via vascular endothelial growth factor receptors[J].Cancer Res,2000,60(2):203-212.
[35]HOEBEN A,LANDUYT B,HIGHLEY MS.Vascular endothelial growth factor and angiogenesis[J].Pharmacol Rev,2004,56(4): 549-580.
[36]CHEN ZB,SHEN SQ,DING YM,et al.The angiogenic and prognostic implications of VEGF,Ang-1,Ang-2,and MMP-9 forhepatocellularcarcinoma withbackgroundofhepatitisB virus[J].Med Oncol,2009,26(3):365-371.
[37]YU YF,ZHANG Y,SHEN N,et al.Effect of VEGF,P53 and telomerase on angiogenesis of gastric carcinoma tissue[J].Asian Pac J Trop Med,2014,7(4):293-296.
[38]KIM JH,BOGNER PN,RAMNATH N,et al.Elevated peroxiredoxin 1,but not NF-E2-related factor 2,is an independent prognostic factor for disease recurrence and reduced survival in stage I non-small cell lung cancer[J].Clin Cancer Res,2007,13(13):3875-3882.
[39]KIM JH,BOGNER PN,BAEK SH,et al.Up-regulation of peroxiredoxin 1 in lung cancer and its implication as a prognostic and therapeutic target[J].Clin Cancer Res,2008,14(8): 2326-2333.
[40]YONGLITTHIPAGON P,PAIROJKUL C,CHAMGRAMOL Y,et al.Prognostic significance of peroxiredoxin 1 and ezrin-radixin-moesin-binding phosphoprotein 50 in cholangiocarcinoma[J]. Hum Pathol,2012,43(10):1719-1730.
[41]LI J,YANG ZL,REN X,et al.ILK and PRDX1 are prognostic markers in squamous cell/adenosquamous carcinomas and adenocarcinoma of gallbladder[J].Tumour Biol,2013,34(1):359-368.
[42]HAAPASALO T,NORDFORS K,JARVELA S,et al.Eroxiredoxins and their expression in ependymomas[J].J Clin Pathol,2013,66(1):12-17.
[43]O'LEARY PC,TERRILE M,BAJOR M,et al.Peroxiredoxin-1 protects estrogen receptor alpha from oxidative stress-induced suppression and is a protein biomarker of favorable prognosis in breast cancer[J].Breast Cancer Res,2014,16(4):79-85.
(张蕾 编辑)
Expression of peroxiredoxin-1 in patients with hepatocellular carcinoma and its clinical value
Qing-song TU1,Jian-tai HE2
(1.Department of Oncology,2.Department of General Surgery,Xiangya Hospital,Central South University,Changsha,Hunan 410008,P.R.China)
【Objective】To investigate the expression of peroxiredoxin-1(Prx-1)in hepatocellular carcinoma and evaluate its clinical value.【Methods】Immunohistochemistry was used to detect Prx-1 expression in hepatocellular carcinoma tissues and paracancerous tissues.Enzyme linked immunosorbent assay(ELISA)was applied to detect the serum Prx-1 level.【Results】The immunohistochemical results indicated that the positive rate of Prx-1 was higher in hepatocellular carcinoma tissues(75.4%)than in paracancerous tissues(36.8%,P <0.05).Prx-1 expression was positively correlated with vascular endothelial growth factor(VEGF)and microvessel density(MVD)in the cancer tissues.The ELISA results showed that the patients with hepatocellular carcinoma had a higher serum Prx-1 level than the healthy subjects[(31.2±13.5)ng/ml vs(13.2±11.9)ng/ ml,P=0.000).Prx-1 expression was correlated with aggressive clinicopathological parameter.The area under the curve(AUC)of the combination of serum Prx-1 and AFP was significantly larger than that of Prx-1 alone.Positive Prx-1 expression was correlated with disappointing overall survival(OS)(P=0.002)and disease-free survival(DFS)(P=0.000).Multivariate analysis showed that Prx-1 staining was an independent biomarker of poor OS(P=0.035)and DFS(P=0.000).【Conclusions】The level of Prx-1 expression is significantly increased in hepatocellular carcinoma.The up-regulated Prx-1 is closely related to tumor angiogenesis and acts as a promising tumor marker for diagnosis and prognosis of hepatocellular carcinoma.
peroxiredoxin-1;hepatocellular carcinoma;immunohistochemistry;vascular endothelial growth factor
R735.7
A
1005-8982(2015)33-0008-07
2015-08-13
何剪太,E-mail:hejiantai_cs@163.com

