小鼠卵母细胞中14-3-3蛋白亚型的表达
孟峻,侯艳军,张永梅,呼格吉乐,刘洋,宿瑞俊
(内蒙古医科大学附属医院检验科,呼和浩特 010050)
14-3-3蛋白是一类广泛存在于真核生物体内、分子量约为28~33kDa的酸性蛋白质[1]。14-3-3蛋白家族成员是在1967 年由Moore和Perez[2]首次在哺乳动物的脑组织中发现并鉴定,按照蛋白质的系统分类命名法命名为14-3-3蛋白。随着对14-3-3蛋白的深入研究,发现它不仅仅是一种存在于脑组织中的蛋白,而且也广泛存在于其他各种组织中。14-3-3蛋白高度保守,在哺乳动物中发现7个家族成员,分别为β,γ,ε,σ,ζ,τ和η,并且由7个不同的基因编码[3-4]。近年来,有大量关于人和小鼠的14-3-3蛋白通过细胞分裂周期磷酸酶25B(Cdc25B)调控细胞周期进程的报道,且成为研究的热点[5-6]。已有 文 献 报 道[7-8]Cdc25B 能 使Cdc2(cell division cycle 2)上酪氨酸-15(Tyr-15)和苏氨酸-14(Thr-14)脱磷酸从而激活Cdc2,促进小鼠卵母细胞恢复减数分裂。但是小鼠卵母细胞中是否表达14-3-3蛋白以及各亚型的表达情况目前国内外未见文献报道,而且在小鼠卵母细胞中14-3-3 蛋白是否通过Cdc25B磷酸酶调控小鼠卵母细胞恢复减数分裂也知者甚少。本研究对小鼠卵母细胞14-3-3蛋白的表达亚型进行鉴定,确定主要的表达亚型,以期为今后研究14-3-3蛋白调控小鼠卵母细胞G2/M 转换中作用的研究做前期的准备工作。
材料与方法
一、材料
1.实验动物:SPF 级昆明系小白鼠,雌性3~4周龄,由内蒙古大学实验动物部提供。动物饲养温度20~22℃,湿度50%~70%,光照周期12h/12h,自由进食和饮水。
2.实验材料及主要试剂:M2培养液、矿物油、丙酮酸钠(Sigma,美国),Waymouth MB 752/1(Invitrogen,美国),孕马血清促性腺激素(PMSG,宁波激素三厂),快速微量mRNA 提取纯化试剂盒(GE Healthcare,美国),RNA PCR Kit(AMV)Ver3.0(TakaRa,日本),ECL 发光试剂盒(Pierce,美国),兔抗小鼠14-3-3ε抗体(Abcam,英国),山羊抗小鼠14-3-3β抗体(Cell signaling,美国),HRP 偶联的兔抗山羊IgG 或羊抗兔IgG 二抗(上海碧云天生物技术有限公司),兔抗小鼠β-Actin抗体(Santa Cruz,美国),PCR 扩增引物的合成与DNA 测序均由上海生工公司完成。
二、研究方法
1.小鼠卵母细胞的采集和培养:根据Zhang等[7]的方法进行小鼠超排卵、收集和培养。3~4周龄的昆明系雌性白鼠,腹腔注射孕马血清(PMSG)10U/只,48h后脱颈法处死,快速取出卵巢,放于M2培养液(含125μmol/L 二丁烯环一磷酸腺苷,防止生发泡破裂)中,在体视显微镜下用1ml注射器针头将卵巢撕碎,让卵母细胞自然流出,用口吸管反复吹打去除附着的颗粒细胞,获得裸卵母细胞,即GV 期卵母细胞,在PBS中洗3次,取一半GV 期卵母细胞用于mRNA 的提取,另一半GV 期卵母细胞在MB培养液[7](在Waymouth MB752/1培养液的基础上添加100μg/ml丙酮酸钠,50U/ml青霉素,50μg/ml链霉素,3 mg/ml BSA,此培养液简称为MB培养液)中培养,上覆矿物油以防蒸发,在37℃、5%CO2、饱和湿度的培养箱内培养以获得生发泡破裂期(GVBD)卵母细胞,提取mRNA。
2.提取总mRNA:将100 个GV/GVBD 期卵母细胞收集到2ml离心管中,按EllustraTMQuick-Prep MicromRNA Purification试剂盒(GE Healthcare,美国)说明书进行:主要包括:样品的提取,mRNA 的分离,分别用高盐缓冲液和低盐缓冲液对已结合mRNA 的oligo(dT)纤维颗粒的洗涤,mRNA的洗脱。
3.引物设计:根据NCBI网站Blast对7个14-3-3亚型进行引物设计
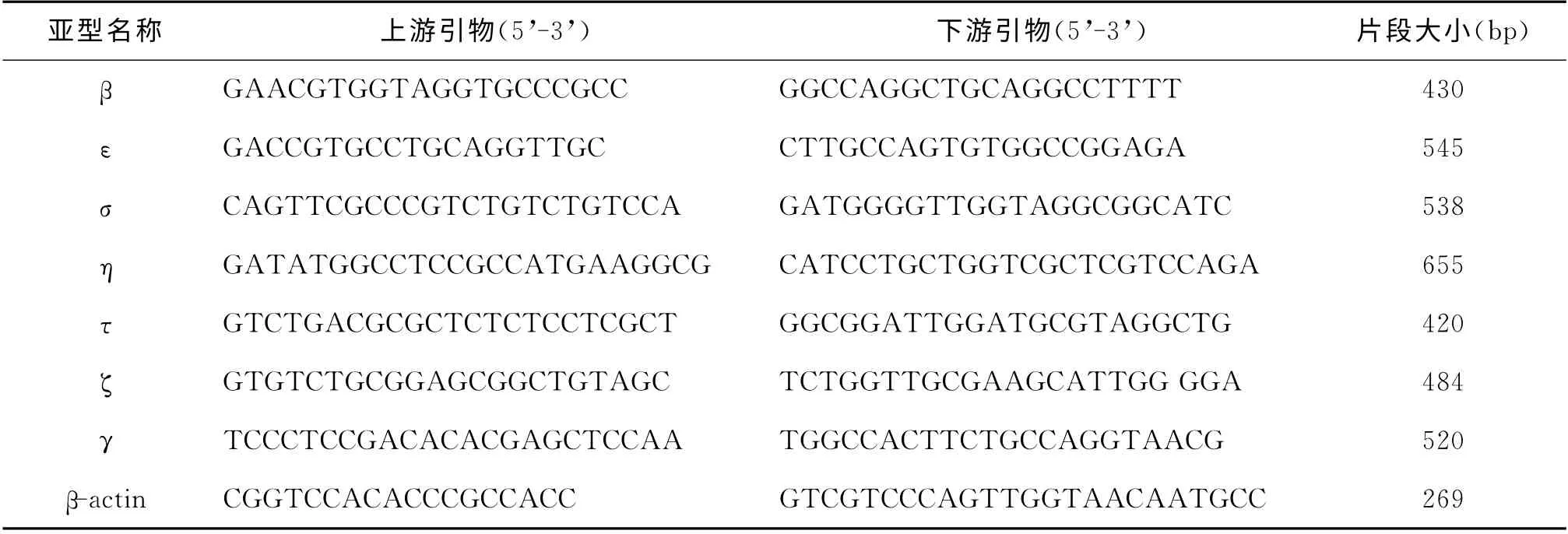
表1 检测14-3-3各个亚型的引物序列
4.RT-PCR 法 检 测mRNA 水 平:用TaKaRa RNAPCR(AMV)ver 3.0试剂盒,按操作步骤进行反转录和PCR,RT-PCR 反应体系为MgCl22μl,10×RTbuffer 1μl去酶dH2O 3.75μl,逆转录酶0.5μl,dNTP 1μl,酶抑制剂0.25μl,dT-adaptor primer 0.5μl,mRNA 1μl,补ddH2O 至10μl,反应条件为:42℃,30 min;99℃,5 min;5℃,5 min。PCR反应体系为5×PCR buffer 5μl,Taq 酶0.15μl,上游引物(20pmol/L)0.25μl,下游引物(20pmol/L)0.25μl,cDNA模板5μl,补ddH2O 至25μl,反应条件是:94℃,3min;循环为94℃30s,50℃30s,72℃1min,30~31 个循环;72℃,10 min。反应产物经琼脂糖凝胶电泳鉴定。
5.Western蛋白印迹法检测蛋白表达水平:收集GV 期和GVBD 期的小鼠卵母细胞各200枚,转移到1.5ml Eppendorf管中,4℃离心去除培养液,加入20μl蛋白提取缓冲液,反复冻融裂解,加入SDS 样 品 缓 冲 液,100℃煮 沸5 min,12% SDSPAGE 电泳分离,转膜,用含5%脱脂奶粉的Tris-HCl缓冲液+Tween20(TBST)(pH7.4)室温封闭1~2h。封闭后的滤膜与山羊抗小鼠14-3-3β抗体(1∶1 000稀释)或兔抗小鼠14-3-3ε抗体(1∶800稀释)及内参β-Actin抗体(1∶200稀释)4℃孵育过夜。HRP偶联的兔抗山羊IgG 或羊抗兔IgG 作为二抗,室温孵育2h。洗膜后,用增强化学发光检测试剂盒(ECL detection kit,Millipore,美国)显影成像。
三、统计学分析
采用SPSS 20.0统计软件进行数据分析。每组实验重复3~4次,数据以均数±标准差(±s)表示。组间差异采用t 检验和χ2检验(Chi-square test)进行统计,P<0.05为差异有统计学意义。
结 果
一、小鼠卵母细胞中7 个14-3-3 蛋白亚型的mRNA 表达水平的检测
结果显示,小鼠GV 期卵母细胞中在mRNA 水平上只有14-3-3β和14-3-3ε亚型存在,而且14-3-3ε mRNA 水平显著高于14-3-3β(P<0.01)(图1)。14-3-3ε的mRNA 表 达 在GV 期 和GVBD 期 差 异无统计学意义(P>0.05)(图2)。

图1 小鼠GV 期卵母细胞中7个14-3-3亚型mRNA 表达比较

图2 小鼠GV、GVBD 期卵母细胞中14-3-3ε的mRNA 表达
二、小鼠卵母细胞中的14-3-3ε和14-3-3β蛋白表达水平
在小鼠GV 期和GVBD 期卵母细胞中又进一步检测了14-3-3ε和14-3-3β的蛋白表达。结果显示,GV 期和GVBD 期卵母细胞中14-3-3ε的蛋白表达水平差异无统计学意义(P>0.05)(图3),这与mRNA 表达结果一致。14-3-3β 蛋白的表达非常低,Western blotting没有检测到14-3-3β蛋白的存在(图4)。
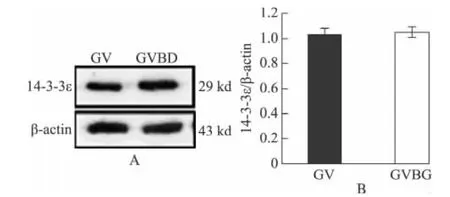
图3 小鼠GV 期和GVBD 期卵母细胞中14-3-3ε蛋白的表达水平

图4 小鼠GV 期和GVBD 期卵母细胞中14-3-3β蛋白的表达水平
讨 论
小鼠卵母细胞发育成熟过程中停滞于生发泡期,也称GV 期,相当于有丝分裂的G2 期末[9],在激素的刺激下,部分卵母细胞发生生发泡破裂(GVBD),即恢复第一次减数分裂。对爪蟾卵母细胞的研究表明[10-12],在GV 期阻滞的卵母细胞中,减数分裂的启动子M 期促进因子(MPF)的催化亚基Cdc2-Thr14/Tyr15被磷酸化,MPF 的活性受到抑制,PKA(蛋白激酶A)可直接磷酸化Cdc25的287位丝氨酸,此位点磷酸化后导致14-3-3 蛋白的结合,Cdc25 活性受抑,不能入核使Cdc2 的Thr14/Tyr15脱磷酸,因而不能激活MPF,卵母细胞发生GV 期阻滞。小鼠卵母细胞的研究证实,PKA 通过Cdc25B的321位丝氨酸磷酸化修饰引起GV 期阻滞,PKA/Cdc25B通路在小鼠卵母细胞减数分裂中发挥重要作用,Cdc25B 能促进减数分裂的重新启动,其突变体(S321A)能完全解除PKA 引起的GV期阻滞[13-15]。然而,小鼠卵母细胞中是否存在14-3-3蛋白以及14-3-3蛋白是否与Cdc25B 结合而使小鼠卵母细胞阻滞于GV 期(相当于有丝分裂的G2期),国内外未见报道。本研究以小鼠卵母细胞为研究对象,利用分子生物学技术和方法鉴定了小鼠GV 期卵母细胞中14-3-3蛋白各亚型的表达情况,证实了小鼠卵母细胞中确实表达14-3-3蛋白,而且14-3-3ε是主要的表达亚型。最近我们课题组通过质谱分析证实PKA 在体外能磷酸化小鼠Cdc25B的321位丝氨酸[16],即Cdc25B是PKA 的直接作用底物。Uchida等[17]人的实验结果显示,在HEK293细胞中14-3-3ε能与Cdc25B 的309 位丝氨酸结合并且控制Cdc25B 的细胞质定位。结合以前的研究[13-15,18],我们可以推测:在小鼠GV 期卵母细胞中PKA 磷酸化Cdc25B 的321位丝氨酸后与14-3-3ε结合,二者共定位于细胞质,Cdc25B 不能入核使Cdc2的Thr14/Tyr15脱磷酸,因而不能激活MPF,卵母细胞阻滞于GV 期。文献[7]报道,在小鼠GV期卵母细胞中Cdc25B 定位于细胞质,GVBD 前Cdc25B定位于细胞核,GVBD 后定位于整个细胞;Cdc25B的突变体Cdc25B-S321A 在GV 期不能定位于细胞质而是定位于细胞核。上述实验进一步暗示14-3-3ε可能和磷酸化S321-Cdc25B 结合于小鼠卵母细胞的细胞质,Cdc25B 不能入核,使卵母细胞阻滞于GV 期。这只是我们提出的假设,需要进一步的后续实验证明。
总之,本研究证实了小鼠GV 期卵母细胞中14-3-3ε的表达,这为我们今后研究PKA/Cdc25B/14-3-3ε通路在小鼠卵母细胞GV 期阻滞中作用的研究提供了实验依据,这一通路的研究对小鼠一细胞期受精卵发育机制的研究具有重要的参考价值,为人类辅助生殖技术尤其是不孕不育的治疗提供了理论基础。
[1] Aitken A.14-3-3proteins:a historic overview[J].Semin Cancer Biol,2006,16:162-172.
[2] Moore BW,Perez VJ.Specific Acid Proteins in the Nervous System[M].Prentice Hall,1967,343-359.
[3] Morrison DK.The 14-3-3proteins:intergrators of diverse signaling cues that impact cell fate and cancer development[J].Trends Cell Biol,2009,19:16-23.
[4] Freeman AK,Morrison DK.14-3-3 Proteins:diverse functions in cell proliferation and cancer progression[J].Semin Cell Dev Biol,2011,22:681-687.
[5] Astuti P,Gabrielli B.Phosphorylation of Cdc25B3 Ser169 regulates 14-3-3binding to Ser151and Cdc25Bactivity[J].Cell Cycle,2011,10:1960-1967.
[6] Cui C,Ren X,Liu D,et al.14-3-3epsilon prevents G2/M transition of fertilized mouse eggs by binding with CDC25B[J].BMC Dev Biol,2014,14:33.
[7] Zhang Y,Zhang Z,Xu XY,et al.Protein kinase A modulates Cdc25Bactivity during meiotic resumption of mouse oocytes[J].Dev Dyn,2008,237:3777-3786.
[8] 赵鸿梅,张阳,徐晓燕,等.149位丝氨酸在CDC25B 诱导小鼠卵母细胞减数 分裂中的功能[J].细胞与分子免疫学杂志,2008,24:298-299.
[9] Sen A,Caiazza F.Oocyte maturaion:a story of arrest and release[J].Front Biosci(Schol Ed),2013,5:451-477.
[10] Yang J,Winkler K,Yoshida M,et al.Maintenance of G2 arrest in the Xenopus oocyte:a role for 14-3-3-mediated inhibition of Cdc25nuclear import[J].EMBO J,1999,18:2174-2183.
[11] Duckworth BC,Weaver JS,Ruderman JV.G2 arrest in Xenopus oocytes depends on phosphorylation of cdc25 by protein kinase A[J].Proc Natl Acad Sci USA,2002,99:16794-16799.
[12] Schmitt A,Nebreda AR.Inhibition of Xenopus oocyte meiotic maturation by catalytically inactive protein kinase A[J].Proc Natl Acad Sci USA,2002,99:4361-4366.
[13] 张阳,张杰,于爱鸣,等.蛋白激酶A/Cdc25B 通路在小鼠卵母细胞G2期阻滞中作用的研究[J].生殖与避孕,2005,25:195-200.
[14] Pirino G,Wescott MP,Donovan PJ.Protein kinase A regulates resumption of meiosis by phosphorylation of CDC25Bin mammalian oocytes[J].Cell Cycle,2009,8:665-670.
[15] Oh JS,Han SJ,Conti M.Wee1B,Myt1,and Cdc25function in distinct compartments of the mouse oocyte to control meiotic resumption[J].J Cell Biol,2010,188:199-207.
[16] Xiao J,Liu C,Hou J,et al.Ser149is another potential PKA phosphorylation target of Cdc25B in G2/M transition of fertilized mouse eggs [J].J Biol Chem,2011,286:10356-10366.
[17] Uchida S,Kuma A,Ohtsubo M,et al.Binding of 14-3-3beta but not 14-3-3sigma controls the cytoplasmic localization of CDC25B:binding site preferences of 14-3-3subtypes and the subcellular localization of CDC25B[J].J Cell Sci,2004,117:3011-3020.
[18] 邵丽,张亦辉,徐祎欣,等.小鼠卵母细胞体外成熟过程中卵丘细胞上细胞周期蛋白D2的表达[J].生殖医学杂志,2015,24:51-57.

