河南番茄褪绿病毒的分子鉴定
胡京昂 万秀娟 李自娟 黄 文 李武高 应芳卿
(郑州市蔬菜研究所,河南郑州 450015)
近几年来,由烟粉虱(Bemisia tabaci)传播的多种病毒病对国内番茄生产造成了巨大的损失,尤以番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)、番茄褪绿病毒(Tomato chlorosis virus,ToCV)和番茄侵染性褪绿病毒(Tomato infectious chlorosis virus,TICV)最为突出(张穗 等,2006;胡京昂 等,2010;胡京昂 等,2013)。
1998年,美国佛罗里达州首次发现了番茄褪绿病毒(Wisler et al.,1998),之后意大利、巴西、以色列等国也相继进行了报道(Accotto et al.,2001;Segev et al.,2004;Freitaset al.,2012)。该病毒属长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus),在自然条件下通过粉虱传播,可以侵染茄科、番杏科、苋科、夹竹桃科、藜科、菊科和蓝雪科等植物,不能通过摩擦接种传播(Wintermantel & Wisler,2006)。
我国最早于2013年发现番茄褪绿病毒,该病毒会引起番茄叶片褪绿和黄化,尤以植株下部叶片叶脉浓绿,叶脉间褪绿、黄化最为明显,貌似缺素症(Zhao et al.,2013)。2014 年 8 月,笔者在河南省郑州、济源、新郑、中牟、扶沟等地的番茄田间发现了大量疑似感染ToCV的番茄植株。本文以田间疑似感染ToCV的番茄叶片为样品,提取植物总RNA,经RT-PCR、PCR检测和序列对比分析,以期明确其病原,为进一步防治该病害奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 病毒样本 2014年8月在河南省郑州、中牟、新郑、济源和扶沟等5个地区的番茄大棚中,采集叶脉褪绿、黄化的番茄叶片,分别编号为T-ZZ、T-ZM、T-XZ、T-JY和T-FG,并同时采集相应大棚中健康番茄叶片作为阴性对照。
1.1.2 生化试剂 TRIzol 购自 Invitrogen公司;RTase M-MLV(RNase H-)、RNase Inhibitor 购自Promega公司;凝胶回收纯化试剂盒、Taq酶和DL2000 Marker均购自杭州博日科技有限公司;dNTPs和 T4 DNA Ligase 购 自 TaKaRa公 司;GeneFinderTM购自厦门百维信生物科技有限公司。
1.1.3 菌株和载体 大肠杆菌(Escherichia coli)
DH5α菌株由郑州市蔬菜生物技术重点实验室保存。克隆载体pMD18-T 购自TaKaRa公司。
1.2 试验设计
1.2.1 植物总RNA提取 采用TRIzol提取法,取番茄叶片样本约0.1 g,在液氮中研磨后迅速转移到 1.5 mL DEPC 处理的离心管中,加入 1 mL TRIzol试剂,振荡均匀放置室温 5 min 后 12 000 r·min-1离心5 min,将上清液转移到新的DEPC处理的1.5 mL离心管中,加入0.2 mL氯仿混匀,室温放置10 min后再次12000 r·min-1离心15 min,仍将上清液转移到DEPC处理的离心管中,加入0.5 mL异丙醇混匀,-20 ℃静置30 min后12000 r·min-1离心10 min,用75%乙醇洗涤沉淀,最后用无核酶的去离子水溶解。置于-20 ℃保存备用。
1.2.2 RT-PCR扩增、序列克隆和测序 根据Dovas等(2002) 的 方 法 检 测ToCVHSP70h部分基因序列,设计特异性引物ToC-5(5′-GGTT TGGATTTTGGTACTACATTCAGT-3′) 和 ToC-6(5′-AAACTGCCTGCATGAAAAGTCTC-3′),对获得的植物总RNA进行RT-PCR扩增。
在DEPC处理的离心管中加入总RNA 5.0 μL,10 μmol·L-1ToC-6引 物 1.0 μL,10 mmol·L-1dNTP Mix 1.0 μL,用无核酶的超纯水补充总体积至10 μL,70 ℃变性10 min,立即冰上放置2 min;再加入5×M-MLV Buffer 5.0 μL,200 U·μL-1RTase M-MLV(RNase H-)1.0 μL,40 U·μL-1RNase Inhibitor 0.5 μL,用无核酶的超纯水补充总体积至25 μL,37 ℃水浴60 min。
以获得的cDNA第一链为模板,扩增ToCV编码的HSP70h基因部分序列。PCR反应体系(25 μL) 如 下:cDNA 5.0 μL,5 U·μL-1TaqDNA Polymerase 1.0 μL,ToC-5和 ToC-6引 物 各 1.0 μL,10×buffer 2.5 μL,ddH2O 补 充 至 25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃复性45 s,72 ℃延伸30 s,35个循环;72℃延伸10 min。取5 μL PCR产物,加入loading buffer和GeneFinder后,用1.0%琼脂糖凝胶电泳检测扩增产物,在可见光透视仪上显示电泳结果。经凝胶回收试剂盒纯化后,将PCR产物克隆到pMD18-T载体(TaKaRa),阳性克隆经验证后送北京三博远志生物技术有限公司测序,将测序的HSP70h基因部分序列提交GenBank数据库收录,登录号为KR150985。
1.2.3 序列比对分析 利用NCBI序列比对工具BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)分 析克隆获得的序列,根据相似性确定病毒种类,并与国际上报道的ToCVHSP70h的序列进行序列相似性分析,这些报道的ToCV分离物及其GenBank数据库登录号分别为美国分离物(登录号:HQ879846),日本分离物(登录号:AB513442),韩国分离物(登录号:KP114528),中国山东分离物(登录号:KC709510)、南京分离物(登录号:KJ815045)及北京分离物(登录号:KC887999)。
2 结果与分析
2.1 疑似感染ToCV番茄病株叶片症状
田间疑似感染ToCV病株的主要症状为植株下部叶片黄化,叶脉浓绿而叶脉间出现褪绿症状(图1),严重时全株叶片褪绿并黄化。

图1 疑似感染ToCV番茄病株下部叶片症状
2.2 ToCV分子检测
以反转录得到的cDNA为模板,利用ToCVHsp70h基因特异性引物对河南省郑州、中牟、新郑、济源和扶沟地区疑似典型症状的番茄样品进行PCR检测,在5个地区样品中均扩增到与ToCVHsp70h大小一致的约460 bp的条带(图2)。表明样品可能被ToCV侵染。
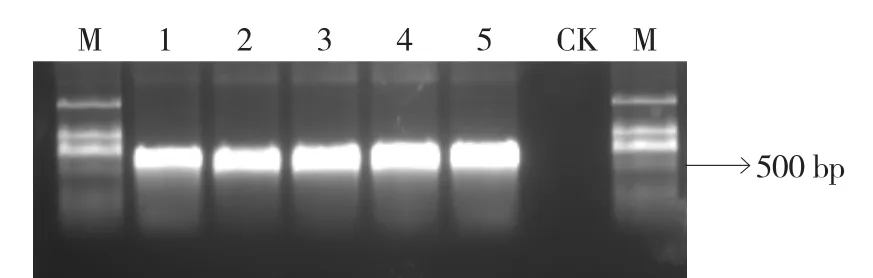
图2 RT-PCR检测结果
2.3 序列分析
将PCR扩增得到的约460 bp片段的河南省5个地区分离物样品纯化、克隆到pMD18-T载体并进行测序。经同源性比较,5个地区的测序产物同源性达99.1%以上,选郑州测序样品,在核苷酸序列水平上与GenBank上登录的ToCV的相似性进行比对,相似性均在99%以上,其中河南省的ToCV的HSP70h的序列与来自日本和韩国的HSP70h序列相似性达100%,与来自美国、中国山东、北京及南京等的HSP70h序列相似性为99.8%(表1)。表明河南省这5个地区的样品均感染ToCV,ToCV是引起河南省番茄叶片褪绿黄化的重要病原之一。
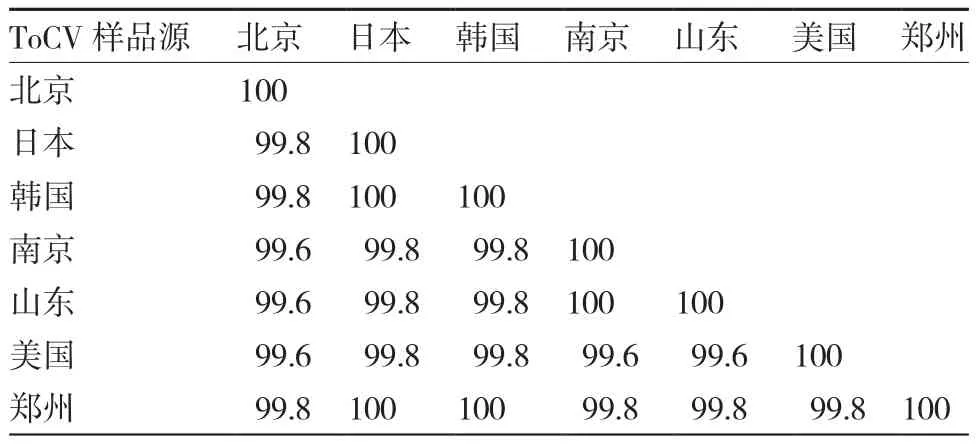
表1 ToCV HSP70h郑州分离物同源性比较 %
3 结论与讨论
ToCV是番茄生产上的重要病害之一,感染该病毒病的番茄叶片变脆、果实品质和产量下降,果实小、口感差,商品性下降。该病在国外已经有报道,在我国最近几年被发现,并在北京、山东地区均有发生(赵黎明 等,2014;赵汝娜 等,2014)。ToCV引起的植物叶片褪绿黄化症状与缺素症状相似,在病害调查中很容易误判,且有潜伏侵染的特性,幼苗感染病毒初期有时不显症,3周后才能显现症状,增加了该病毒通过种苗调运传播扩散的风险。国内针对该病毒的诊断主要通过症状观察结合分子生物学方法,血清学检测技术尚未应用。本试验通过分子生物学的方法,对河南省5个地区的番茄叶片疑似症状进行检测,结果表明ToCV为导致河南省番茄叶片褪绿黄化的病原之一,这是该病毒的分子鉴定在河南省番茄上的首次报道。
ToCV主要伴随烟粉虱等媒介昆虫发生为害,且该病毒能够与番茄黄化曲叶病毒混合侵染,因此防控措施主要围绕媒介昆虫来开展。近几年,由粉虱传播的病毒病给我国的番茄生产造成严重的损失,其中由TYLCV等一些双生病毒引起的番茄黄化曲叶病毒病是我国番茄生产上最严重的病毒病害,生产上已经通过推广具有抗病毒基因TY1、TY2和TY3a等的抗病品种防治TYLCV,得到一定的防治效果。利用分子生物学技术,笔者对参试的样品进行了抗病基因的分子标记,所采集样品均存在TY1和TY3a连锁标记基因位点,在生产中对TYLCV有一定的抗性,但对ToCV不表现抗性。
ToCV作为新病毒病害在我国的研究还处于初始阶段,由于ToCV病毒传播迅速,加之缺乏高抗ToCV的品种,亟须在番茄的种质资源中筛选抗ToCV的种质资源培育抗病毒品种。本试验仅仅对河南省5个市(县)的ToCV进行了分子检测和鉴定,需要进一步对各地ToCV的病毒株系的变异进行鉴定和分析,加强对该病毒在不同地区的变异及分布、流行区域监控及病毒防治技术等方面的研究。
胡京昂,周建华,蔡雨惠.2010.河南省番茄黄化曲叶病毒病的发生与综合防治.中国瓜菜,23(4):49-50.
胡京昂,郭竞,崔杏春,李自娟,万秀娟,黄文,应芳卿.2013.番茄黄化曲叶病毒郑州分离物外壳蛋白基因的克隆与序列分析.河南农业科学,42(9):87-90.
张穗,王冬生,瞿培荣,温广月,匡开源.2006.上海市番茄黄化曲叶病毒病的初步鉴定.上海农业学报,22(3):126.
赵黎明,李刚,刘永光,国家进,魏家鹏,竺晓平.2014.番茄褪绿病毒与番茄黄化曲叶病毒复合侵染的分子鉴定.中国蔬菜,(12):15-20.
赵汝娜,王蓉,师迎春,张桂娟,原楷,范在丰,周涛.2014.侵染甜椒的番茄褪绿病毒的分子鉴定.植物保护,40(1):128-130.
Accotto G P,Vaira A M,Vecchiati M,Sialer M M F,Gallitelli D,Dsvino M.2001.First report ofTomato chlorosis virusin Italy.Plant Disease,85(11):1208.
Dovas C I,Katis N I,Avgelis A D.2002.Multiplex detection of criniviruses associated with epidemics of a yellowing disease of tomato in Greece.Plant Disease,86(12):1345-1349.
Freitas D M S,Nardin I,Shimoyama N,Souza-Dias J A C.Rezenda J A M.2012. First report ofTomato chlorosis virusin potato in Brazil.European Journal of Plant Pathology,134(1):81-86.
Segev L,Wintermantel W M,Polson J E,Lapidot M.2004.First report ofTomato chlorosis virusin Isrse.Plant Disease,88(10):1160.
Wintermantel W M,Wisler G C.2006.Vector specificity,host range,and genetic diversity ofTomato chlorosis virus.Plant Disease,90(6):814-819.
Wisler G C,Li R H,Liu H Y,Lowry D S,Duffus J E.1998.Tomato chlorosis virus:a new whitefly-transmitted,phloem-limited,bipartite closterovirus of tomato.Phytopathology,88(5):402-409.
Zhao R N,Wang R,Wang N,Fan Z F,Zhou T,Shi Y C,Chai M. 2013.First report ofTomato chlorosis virusin China.Plant Disease,97(8):1123.

