马铃薯卷叶病毒CP基因水溶性原核表达的研究
牛倩雅 辛 佳 王晶珊 杨 煜 李广存 郭宝太*
(1青岛农业大学生命科学学院,山东青岛 266109;2山东省农业科学院蔬菜花卉研究所,山东济南 250100)
马铃薯卷叶病毒(Potato leafroll virus,PLRV)是黄症病毒科(Luteoviridae)成员,可引起马铃薯叶片纵向卷曲等症状,导致减产,引起品种退化,危害非常严重。马铃薯病毒粒体提取、纯化困难,PLRV的分布局限于寄主植株的维管束内,含量低,提取纯化尤其困难。我国自主研制的PLRV抗血清缺乏,远远不能满足其研究与脱毒种苗生产中对PLRV进行ELISA检测的需求。
PLRV-CP基因长度为627 bp,在我国6种马铃薯主要病毒中,其CP基因是最小的,但该基因密码子组成特别,原核表达非常困难,是利用原核表达重组CP制备PLRV特异性抗血清的障碍。PLRV-CP基因原核表达的困难可通过不同的技术 途 径 克 服(Lopez et al.,1994;Pichova et al.,2011)。青岛农业大学遗传研究室通过删除抑制翻译的126 bp片段,实现了其突变基因的高效原核表达,并利用重组CP制备出了PLRV抗血清(隋炯明 等,2012),且获得的抗体与酶标抗体可用于PLRV的DAS-ELISA检测(李楠楠 等,2011),为大量组装PLRV的ELISA试剂盒奠定了技术基础。
与病毒粒体作抗原相比,重组CP途径具有抗原制备效率高、纯度高,没有病毒扩散的潜在危害等优点。目前大多采用变性的重组蛋白作抗原制备马铃薯病毒抗血清,变性蛋白不具有天然的构象,与病毒粒体的抗原决定簇会存在差异。本试验目的是建立PLRV-CP基因水溶性原核表达体系,为利用水溶性重组CP制备出检测能力更强的PLRV抗血清奠定基础。
1 材料与方法
1.1 载体与菌株
分子伴侣原核表达质粒、冷激诱导原核表达载体pColdⅠ与pMD18-T克隆载体购自宝生物工程(大连)有限公司。PLRV-CP突变基因的原核表达载体pBAD-LRCP-126由本实验室构建(隋炯明 等,2012),简写为pBAD-LRCP,该基因受PBAD启动子驱动表达。大肠杆菌菌株DH5α、BL21(DE3)、TOP10由本实验室保存。
1.2 试剂与试剂盒
DNA marker、限制性内切酶、TaqDNA 聚合酶、T4 DNA 连接酶等购自宝生物工程(大连)有限公司,质粒DNA小量提取试剂盒、DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司。溶菌酶、蛋白酶抑制剂PMSF购自Sigma公司。
1.3 PCR引物
PLRV-CP基因的扩增引物P1的序列为:5´-CATATGAGTACGGTCGTGG -3´(含NdeⅠ酶切位点);P2:5´-AAGCTTTTTGGGGTTTTGCAA-3´(含Hind Ⅲ酶切位点),由生工生物工程(上海)股份有限公司合成。
1.4 利用分子伴侣增强PLRV-CP基因的水溶性表达
分别用5种可表达出分子伴侣的质粒(表1)转化重组菌TOP10(pBAD-LRCP),获得既含pBAD-LRCP又含分子伴侣原核表达载体的转化子。
将5种转化子分别在37 ℃,Amp终浓度100 μg·mL-1,Cm终浓度50 μg·mL-1的液体LB培养基中振荡培养,在OD600值达到0.6~0.9时,加入合适的诱导物使PLRV-CP基因与分子伴侣基因同时表达。
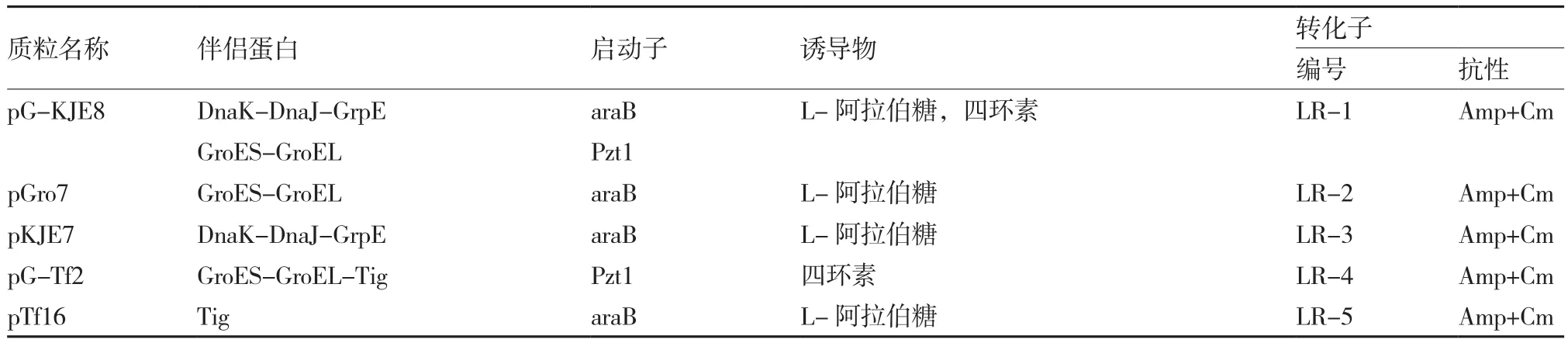
表1 用于转化的质粒及其表达的分子伴侣
1.5 利用冷激蛋白启动子增强PLRV-CP基因的水溶性表达
以pBAD-LRCP为模版,用引物P1、P2进行PCR扩增,电泳后回收含PLRV-CP基因的条带并与pMD18-T载体连接,连接产物转化DH5α,经酶切鉴定与测序筛选出目的克隆,其重组质粒命名为pMD18-LRCP。
pColdⅠDNA经NdeⅠ和Hind Ⅲ双酶切后回收大小约为4 000 bp的大片段,pMD18-LRCP质粒经同样的双酶切后回收500 bp的小片段,两个片段的连接产物转化BL21感受态细胞,通过酶切鉴定与测序确认表达载体的正确性,并命名为pCold-LRCP。
将重组菌BL21(pCold-LRCP)接种于液体LB培养基(Amp 浓度 100 μg·mL-1)中,37 ℃振荡培养过夜,按1∶100将过夜培养物接种于新鲜的LB培养基中,37 ℃振荡培养约3 h,OD600的值达到0.4~0.5,吸出1 mL菌液作为未诱导的对照,剩余菌液中加入IPTG至终浓度为0.1 mmol·L-1,15 ℃振荡培养24 h,诱导目的蛋白的表达。
1.6 测序
PLRV-CP基因亚克隆及原核表达载体构建中,测序分别采用针对pMD18-T与pColdⅠ的载体引物进行,由生工生物工程(上海)股份有限公司完成。
1.7 菌体蛋白的提取与SDS-PAGE分析
菌体蛋白的提取采用溶菌酶法,取40 μL提取的上清蛋白加入10 μL 5×上样缓冲液混匀;未经诱导的菌体及提取的包涵体用1×蛋白上样缓冲液悬浮;上述样品煮沸离心后,各取20 μL上清点样,用12%的SDS-PAGE分析水溶性表达效果。
2 结果与分析
2.1 分子伴侣与PLRV-CP基因的水溶性表达
限制性酶切结果显示,质粒pG-KJE8中无NdeⅠ的切点(图1,泳道1~3),pBAD-LRCP中有预期NdeⅠ的单切点(图1,泳道6~7),pGKJE8转化TOP10(pBAD-LRCP)获得的单菌落中既有质粒pBAD-LRCP,也有pG-KJE8(图1,泳道4~5),是符合要求的转化子,命名为LR-1。用另外4种质粒转化,均获得了抗Amp与Cm的转化子(LR-2~LR-5)。
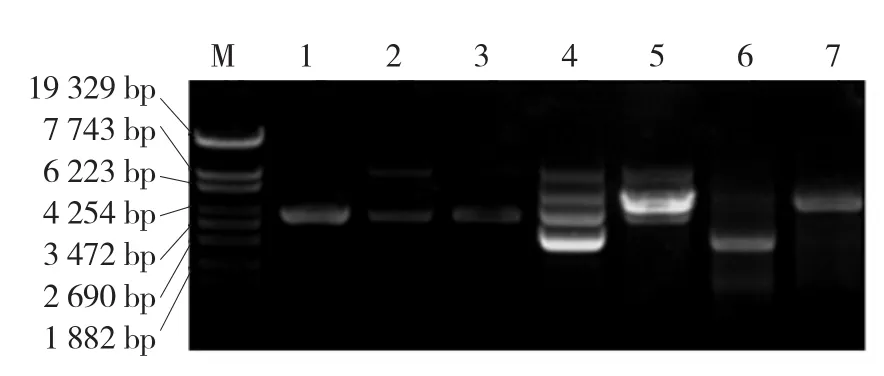
图1 转化子LR-1的酶切鉴定
前期的研究表明,表达载体pBAD-LRCP中,PLRV-CP基因5′端有铁氧还蛋白基因的片段,采用了融合表达的策略,但表达出的水溶性重组蛋白极少。本试验用转化子LR-1提取总蛋白,SDSPAGE分析显示,上清中有一条34 kD的特异性水溶性蛋白质条带(图2,泳道2),但重组蛋白主要以包涵体形式存在(图2,泳道3)。转化子LR-2诱导出的水溶性目的蛋白条带很明显(图3,泳道3),其水溶性的表达水平与LR-1相当,另外3种转化子中水溶性重组蛋白的表达量低于LR-1与LR-2。表明分子伴侣的存在使水相中的PLRV重组CP蛋白的量有明显提高,但没有期望的多。

图2 转化子LR-1中PLRV-CP基因的表达

图3 转化子LR-2中PLRV-CP基因的表达
2.2 冷激蛋白启动子与 PLRV-CP基因的水溶性表达
对PLRV-CP基因进行了T-A亚克隆,测序结果表明5′与3′分别含NdeⅠ切点、Hind Ⅲ切点的PLRV-CP基因序列已插入T载体中,该重组质粒命名为pMD18-LRCP。
pMD18-LRCP与pColdⅠ经NdeⅠ和Hind Ⅲ双酶切后,回收相应的片段连接,酶切结果表明,PLRV-CP基因序列已插入表达载体中(图4),测序结果显示PLRV-CP基因的冷激诱导原核表达载体构建正确,命名为pCold-LRCP。图5是该表达载体pCold-LRCP的图谱,PLRV-CP基因长度为498 bp,处于cspA基因启动子下游,其表达产物的分子量约为20 kD。
重组菌BL21(pCold-LRCP)经低温诱导,SDS-PAGE检测表明在20 kD处有一条明显的特异性蛋白条带(图6,泳道2~4),其分子量符合预期,水溶性蛋白中该条带清晰(图6,泳道2~3)。表明冷激蛋白启动子可以增强PLRV-CP基因的水溶原核表达量,且效果好于分子伴侣。
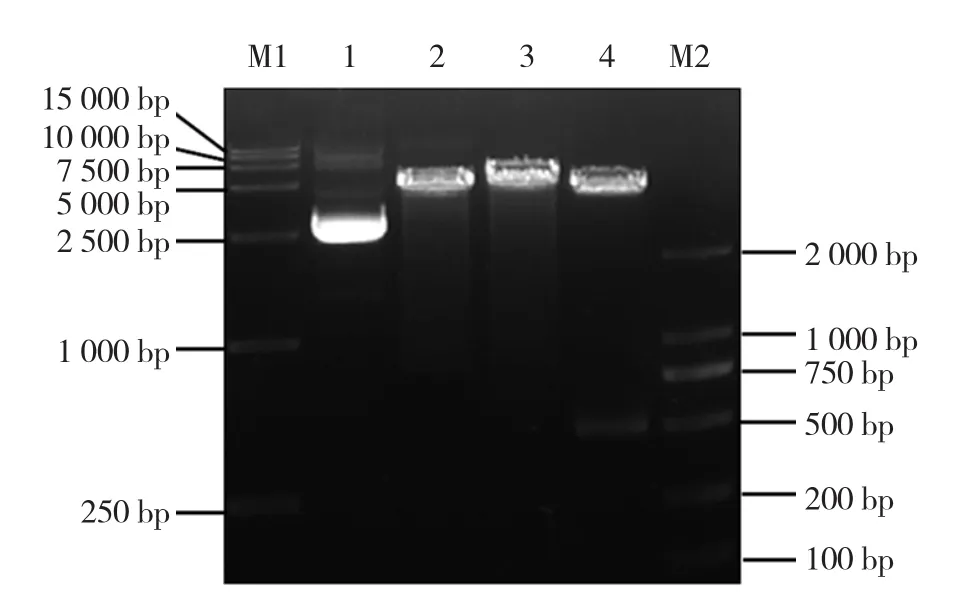
图4 重组质粒pCold-LRCP的酶切图谱
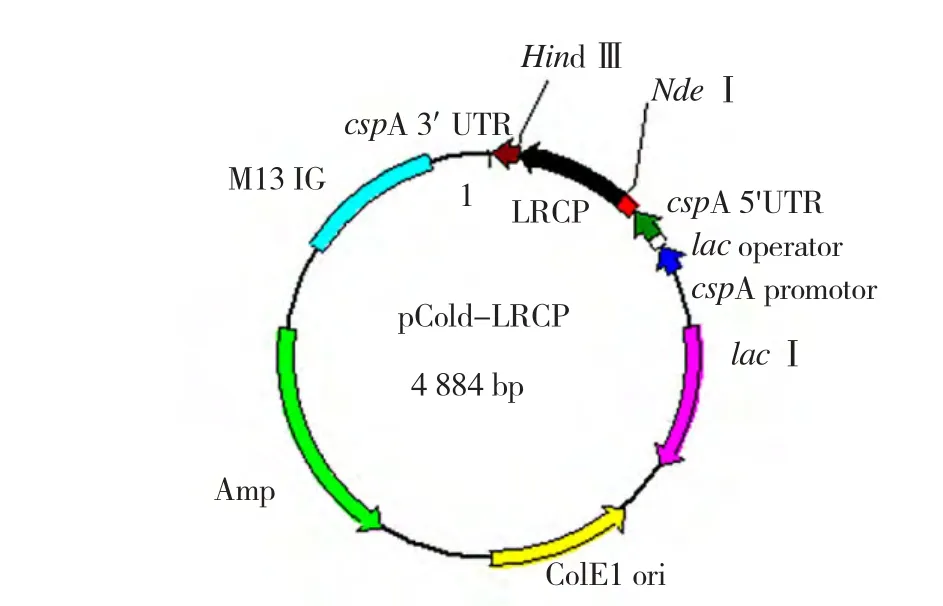
图5 pCold-LRCP质粒图谱
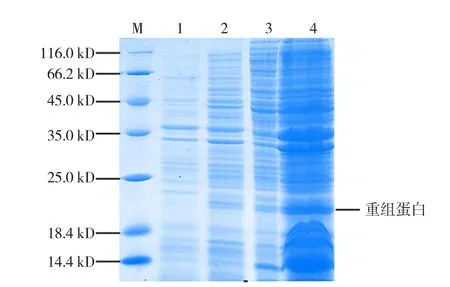
图6 PLRV-CP基因的冷激诱导表达
3 结论与讨论
本试验比较了提高PLRV-CP基因水溶性表达效果的两种途径。首先,用5种表达分子伴侣的质粒转化重组菌TOP10(pBAD-LRCP),均可获得PLRV-CP基因水溶性表达水平提高的转化子,转化子LR-1与LR-2中PLRV重组CP的水溶性表达量较高,另外3种转化子的表达量低。其次,利用pColdⅠ构建出了PLRV-CP基因的原核表达载体,在冷激蛋白基因cspA的启动驱动下,该基因的水溶性表达水平明显提高,且水溶性重组CP表达量高于分子伴侣途径。第二种途径更适合于PLRV水溶性重组CP及其抗血清的大量制备。
大肠杆菌分子伴侣具有协助蛋白质正确折叠,形成天然构象的作用,它可增进原核表达重组蛋白的水溶性(崔硕硕 等,2011;许鹏 等,2012)。本试验中转化子LR-1表达出的伴侣蛋白是DnaKDnaJ-GrpE和GroES-GroEL两组分子伴侣蛋白,LR-2表达出的伴侣蛋白是GroES-GroEL,但两种转化子的水溶性重组蛋白表达量接近。即使在分子伴侣存在的情况下,PLRV重组CP仍然以包涵体形式为主,水溶性表达量较低。亓振国等(2011)研究发现原核表达中,GroES与GroEL具有抑制玉米西罗叶绿三酸:铁螯合酶在菌体内聚集的作用,但DnaK及DnaJ没有这种作用。针对一个具体的基因,分子伴侣对其水溶性原核表达的作用很难预测,需要通过试验确认。
冷激蛋白启动子可实现低温条件下目的基因的原核表达,也具有增强重组蛋白水溶性表达量的作用(屠小菊 等,2010;杜庆辉 等,2012)。本试验表明在冷激诱导启动子驱动下,水溶性PLRV重组CP的带型清晰,在总蛋白中占的比例也明显高于分子伴侣途径。扩大菌液培养与诱导体系,并将提取的上清蛋白液浓缩后,可通过镍离子亲和层析纯化出足量PLRV水溶性CP,满足制备PLRV抗血清之需。同时有必要进一步优化表达体系,提高其表达量,从而提高纯化效率与纯化量。
Raikhy等(2007)利用水溶性重组CP蛋白制备出了香石竹蚀环病毒(CERV)抗血清,表明纯化抗体(IgG)及其酶标抗体可用于CERV的DASELISA检测,效果达到了商品试剂盒的检测水平。马铃薯重组CP抗血清的报道中,均采用了纯化后的变性蛋白作抗原,未见利用水溶性重组蛋白作抗原的研究;用水溶性重组CP作抗原具有制备出高质量马铃薯病毒抗血清的潜力,是一个值得深入研究的新领域。
崔硕硕,张镱,林学政,沈继红.2011.分子伴侣共表达对低温脂肪酶Lip-837异源可溶性表达的影响.海洋科学进展,29(1):105-111.
杜庆辉,贺丽,刘双喜,张莉君,冒艳丽,朱小平,焦红梅,李国才.2012.E. coliM15碱性磷酸酶的表达、纯化及活性分析.生物技术,22(6):35-38.
李楠楠,左玉玲,隋炯明,盖树鹏,樊连梅,李广存,郭宝太.2011.重组CP多克隆抗体在马铃薯卷叶病毒DAS–ELISA检测中的应用.华北农学报,26(6):85-88.
亓振国,张宽亮,陈宗梅,程备久,范军.2011.大肠杆菌分子伴侣表达的辅助载体构建及应用.农业生物技术学报,19(1):171-177.
隋炯明,何心凤,郭真,李广存,王晶珊,郭宝太.2012.马铃薯卷叶病毒缺失突变CP基因的原核表达及抗血清的制备.园艺学报,39(10):1949-1957.
屠小菊,汪启明,李秀山,邓克勤,唐东英,罗泽宇,赵小英,刘选明.2010.拟南芥 DBB1a(double B-box 1a)蛋白的表达、纯化及Western blotting检测.激光生物学报,19(2):224-228.
许鹏,王蕾蕾,程备久,范军.2012.表达大肠杆菌分子伴侣GroEL、GroES和GrpE载体的构建及其应用.激光生物学报,21(1):46-51.
Lopez L,Muller R,Balmori E,de la Riva G,Ramirez N,Doreste V,Lopez M,Perez S,Oramas P,Selman-Housein G.1994. Molecular cloning and nucleotide sequence of the coat protein gene of a Cuban isolate of potato leafroll virus and its expression inEscherichia coli.Virus Genes,9(1):77-83.
Pichova H,Moravec T,Dedic P,Cerovska N.2011.Expression of recombinant potato leafroll virus structural and non-structural proteins for antibody production.Journal of Phytopathology,159(2): 130–132.
Raikhy G,Hallan V,Kulshrestha S,Zaidi A A.2007.Polyclonal antibodies to the coat protein of carnation etched ring virus expressed in bacterial system:production and use in immunodiagnosis.Journal of Phytopathology,155(10):616-622.

