支原体脂肽经EGFR/MMP-9诱导气道上皮细胞分泌MUC5AC
文道林 余敏君 游晓星 李冉辉 陈列松 朱翠明 李媛媛 曾焱华
支原体脂肽经EGFR/MMP-9诱导气道上皮细胞分泌MUC5AC
文道林 余敏君 游晓星 李冉辉 陈列松 朱翠明 李媛媛 曾焱华
目的 观察支原体巨噬细胞活化脂肽-2(MALP-2)诱导人气道上皮细胞分泌粘蛋白MUC5AC的分子机制。方法 体外培养人气道上皮细胞NCI-H292,分别采用0、0.1、1.0和5.0μg/mL MALP-2刺激NCI-H292细胞24h,采用酶联免疫吸附测定(ELISA)检测培养上清中MUC5AC和基质金属蛋白酶9(MMP-9)的含量;Western blot检测表皮生长因子受体(EGFR)磷酸化水平。同时采用EGFR抑制剂AG-1478或MMP-9抑制剂(MMP-9 Inhibitor I)处理细胞,观察其对MUC5AC分泌的影响。结果 NCI-H292细胞未刺激时,MUC5AC以及MMP-9分泌水平极低。当给予0.1~5μg/mL MALP-2作用18h后,MUC5AC的分泌水平显著增高。此外,5μg/mL MALP-2作用NCI-H292细胞1h后可诱导EGFR磷酸化。采用AG-1478预处理细胞1h后,MMP-9及MUC5AC分泌水平明显减少,同时,采用10nmol/L MMP-9抑制剂处理后也能下调MUC5AC水平。结论 支原体MALP-2经EGFR/MMP-9诱导气道上皮细胞分泌MUC5AC。
支原体巨噬细胞活化脂肽2;基质金属蛋白酶9;MUC5AC
黏液是分布于气道表面的一层粘弹性凝胶,它和纤毛共同形成黏液纤毛运输系统,是机体固有免疫系统的重要组成部分[1]。虽然黏液对拮抗病原微生物感染发挥重要作用,但病理条件下气道黏液过度分泌对影响黏膜纤毛的清除功能。临床多种疾病,如哮喘、慢性阻塞性肺疾病(COPD)、囊性纤维化和支气管扩张,往往伴随有黏液的过度分泌,从而加重疾病的病情[2-4]。气道黏液的主要成分是水、离子和粘蛋白组成(其中粘蛋白约占2%)。粘蛋白是由位于上皮杯状细胞和黏膜下层腺体中的黏液细胞分泌。目前已经鉴定的粘蛋白基因至少有12种,其中以MUC5AC最重要[5]。肺炎支原体是引起社区获得性肺炎最常见的病原微生物,在多种慢性呼吸系统疾病如哮喘中发挥重要作用。研究表明,肺炎支原体感染后,可上调气道上皮细胞分泌MUC5AC[6],但其分子机制尚未完全明了。本研究以支原体巨噬细胞活化脂肽2(macrophage-activating lipopeptide-2,MALP-2)为研究对象,观察其处理NCI-H292细胞后,对MUC5AC分泌有何影响,并初步探讨其调控机制,从而进一步明确支原体的致病机制。
1 材料与方法
1.1 主要实验试剂 RPMI-1640培养基、胎牛血清为Invitrogen公司产品(Frederick,MD);人基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)ELISA检测试剂盒购自深圳欣博盛生物有限公司,人MUC5AC ELISA检测试剂盒购自武汉华美生物工程有限公司。鼠抗人磷酸化表皮生长因子受体(epithelial growth factor receptor,EGFR)抗体以及total-EGFR抗体购自Cell signaling(Beverly,MA)。AG1478和基质金属蛋白酶-9抑制剂购自Calbiochem(Darmstadt, Germany)。
1.2 细胞培养与处理 人气道上皮细胞系NCI-H292用含10%胎牛血清的RPMI-1640培养基培养,于37℃、5%CO2条件下培养。待细胞生长丰度达到70%时,将其接种至无血清培养基中继续培养24h以同步细胞周期。MALP-2刺激前将NCI-H292接种至24孔板中(细胞数约5×105),加入终浓度为0、0.1、1.0和5.0μg/mL MALP-2刺激0~4h或24h,随后获取上清或提取总蛋白用于下一步研究。
1.3 MMP-9和MUC5AC检测 细胞处理结束后,通过反复冻融以裂解细胞。经1000r/min离心5min后,弃沉淀,采用双抗体夹心酶联免疫吸附试验(ELISA)法检测上清中
MMP-9和MUC5AC的含量。操作方法按照试剂盒提供的操作步骤进行。结果以相对含量表示(处理组吸光值/对照组吸光值×100%)。
1.4 EGFR磷酸化分析 细胞处理结束后,采用预冷PBS洗涤1次,随后加入100μL裂解液[50mmol/L Tris(pH7.4),150mmol/L NaCl,1% NP-40,0.1% SDS,1μL蛋白酶抑制剂,1μL磷酸酶抑制剂以及1μL PMSF]冰上裂解15min。4℃离心获取上清,测定蛋白浓度后,获取40μg蛋白用于凝胶电泳。随后通过电转印至硝酸纤维素膜上,经5%脱脂奶粉封闭后,分别与抗磷酸化EGFR抗体(1∶1000)和EGFR抗体(1∶1500)孵育。充分洗膜后加入辣根过氧化物酶标记二抗,ECL显影、拍照。
1.5 统计学方法 所有实验数据重复3次,应用SPSS17.0软件进行统计学分析,计量资料用“x±s”表示,组间比较采用单因素方差分析数据。P<0.05为差异具有统计学意义。
2 结果
2.1 MALP-2诱导NCI-H292细胞EGFR磷酸化NCI-H292细胞未经MALP-2刺激时,EGFR磷酸化水平极低。当给予MALP-2刺激0~4h后,细胞内磷酸化EGFR含量显著增多,而对细胞内EGFR总量无明显影响。见图1。
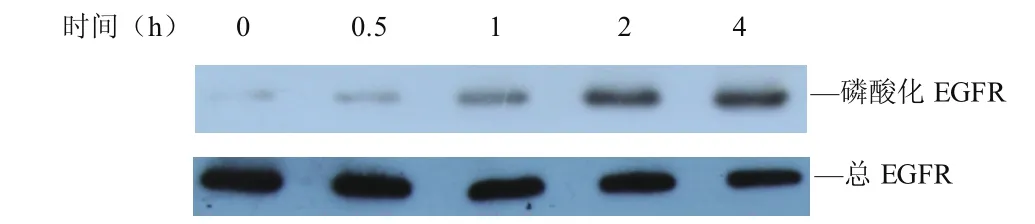
图1 MALP-2作用不同时间对NCI-H292细胞EGFR磷酸化的影响
2.2 MALP-2诱导NCI-H292细胞分泌MMP-9 当给予0.1、1.0、5.0μg/mL MALP-2作用24h后,可显著诱导NCI-H292细胞分泌MMP-9,且随着MALP-2浓度的增加,MMP-9的分泌水平进一步增多。见图2。
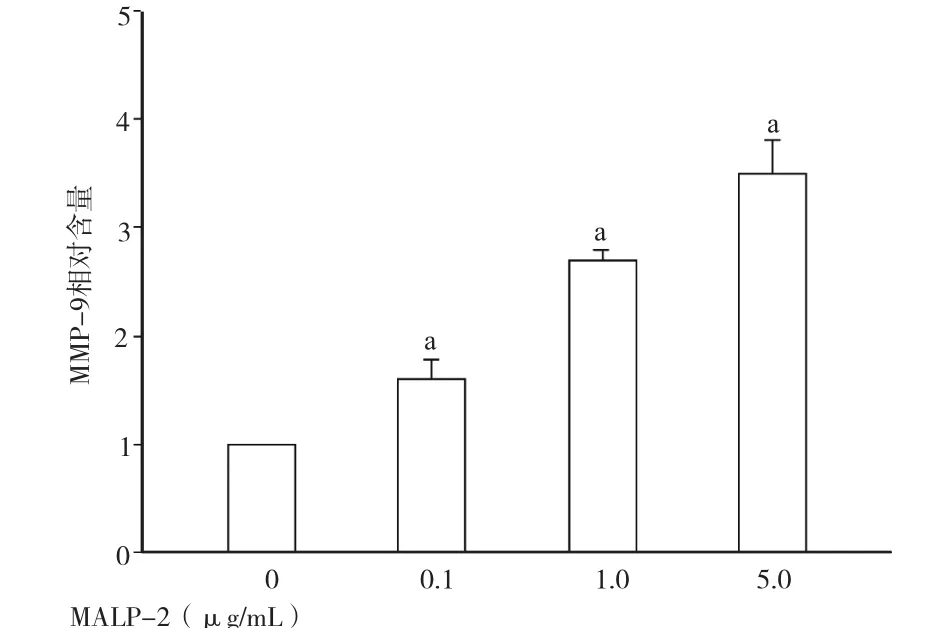
图2 不同浓度MALP-2诱导NCI-H292细胞分泌MMP-9
2.3 EGFR抑制剂处理下调MALP-2诱导分泌MMP-9 NCI-H292细胞在MALP-2处理前,首先用5~10μmol/ L EGFR AG-1478预处理细胞1h,随后再用MALP-2刺激24h,AG-1478处理后,MMP-9分泌水平明显降低(P<0.05)。见图3。

图3 AG-1478抑制MALP-2诱导NCI-H292细胞分泌MMP-9
2.4 抑制MMP-9活性后降低MUC5AC的分泌5μg/mL MALP-2作用NCI-H292细胞后,可显著诱导其分泌MUC5AC。而给予10nmol/L MMP-9抑制剂预处理细胞后,MUC5AC含量显著减少(P<0.05)。见图4。
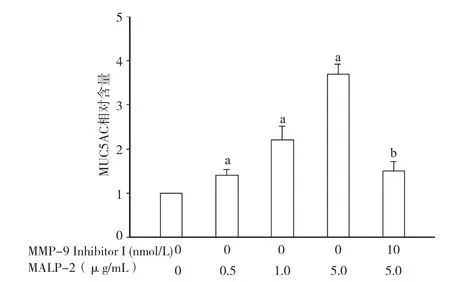
图4 MMP-9抑制剂下调MALP-2诱导NCI-H292细胞分泌MUC5AC
3 讨论
肺炎支原体是导致儿童及成人呼吸系统感染最常见的病原体,并与多种疾病的急性发作有关,如哮喘与COPD。虽然病毒感染是导致哮喘急性发作的重要因素,但该病也与随后引起的肺炎支原体二重感染有关[7]。在这些疾病的急性发作时,粘蛋白的过度分泌是重要的病理学特征。本研究证实支原体致病物质MALP-2可通过EGFR/MMP-9通路诱导NCI-H292细胞分泌MUC5AC,这可能是支原体导致多种慢性肺部疾病急性发作的重要致病因素。
研究表明,MMPs参与多种慢性气道疾病,如COPD、哮喘和囊性纤维化的发病过程,尤其是在气道炎症反应中,MMP-9发挥重要作用[8]。然而,以往的研究大多局限于MMPs对气道重塑和肺实质的破坏作用[9],而MMPs对粘蛋白高分泌的调控作用和机制并不完全清楚。本研究通过ELISA证实,MALP-2处理NCI-H292细胞后,可显著诱导其分泌MMP-9。MMPs异常分泌后可引起细胞外基质降解从而导致炎症反应的异常,如导致血管通透性增加和炎性细胞的渗出等。活化的MMP-9可降解的细胞表面相关分子而产生具有活性的生物成分,并可以通过裂解细胞-细胞之间黏附蛋白来影响细胞的行为[10]。本研究结果显示,MALP-2处理后可诱导EGFR磷酸化,而NCI-H292细胞给予EGFR抑制剂处理后,MMP-9的分泌水平显著降低,表明MMP-9的分泌与EGFR的磷酸化有关。随后的研究也证实MALP-2可上调MUC5AC的表达,而给予MMP-9抑制剂处理后,MUC5AC的含量明显减少,表明MMP-9参与了MUC5AC的分泌。在本研究中,我们并未对EGFR相关配体进行检测,MMP-9诱导MUC5AC的分泌可能是通过MMP-9降解细胞表面相关EGFR的配体分子,或释放一些相关生物活性物质而最终诱导MUC5AC的合成。此外,MALP-2是TLR2和TLR6的配体。MALP-2经TLR2/6识别后,可上调一系列细胞因子或炎性介质的产生,而这些炎性因子也可能诱导粘蛋白的表达[11]。
总之,本研究证实MALP-2通过EGFR/MMP-9诱导MUC5AC分泌,因此,MMP-9除了具有损伤肺泡、气道重构以及降解细胞外基质外,同时也能上调粘蛋白的分泌。在随后的研究当中,我们将对EGFR的上游通路开展研究,从而进一步明确肺炎支原体的致病机制。
[1] Martin C, Frija-Masson J, Burgel PR. Targeting mucus hypersecretion: new therapeutic opportunities for COPD?[J]. Drugs, 2014,74(10):1073-1089.
[2] Grainge CL, Davies DE. Epithelial injury and repair in airways diseases[J]. Chest, 2013,144(6):1906-1912.
[3] Chillappagari S, Preuss J, Licht S, et al. Altered protease and antiprotease balance during a COPD exacerbation contributes to mucus obstruction[J]. Respir Res, 2015,16(1):85.
[4] 王树坚.诱导痰检测对儿童支气管哮喘的诊治进展[J].当代医学, 2011,17(15):25-25.
[5] Chen M, Lv Z, Zhang W, et al. Triptolide suppresses airway goblet cell hyperplasia and Muc5ac expression via NF-kappaB in a murine model of asthma[J]. Mol Immunol, 2015,64(1):99-105.
[6] Hao Y, Kuang Z, Jing J, et al. Mycoplasma pneumoniae modulates STAT3-STAT6/EGFR-FOXA2 signaling to induce overexpression of airway mucins[J]. Infect Immun, 2014,82(12):5246-5255.
[7] Kim S, Kim MJ, Park dY, et al. Mitochondrial reactive oxygen species modulate innate immune response to influenza A virus in human nasal epithelium[J]. Antiviral Res, 2015,119:78-83.
[8] Puljiz I, Markotic A, Cvetko KL, et al. Mycoplasma pneumoniae in adult community-acquired pneumonia increases matrix metalloproteinase-9 serum level and induces its gene expression in peripheral blood mononuclear cells[J]. Med Sci Monit, 2012,18(8):CR500-505.
[9] Papakonstantinou E, Karakiulakis G, Batzios S, et al. Acute exacerbations of COPD are associated with significant activation of matrix metalloproteinase 9 irrespectively of airway obstruction, emphysema and infection[J]. Respir Res, 2015,16(1):78.
[10] Roelle S, Grosse R, Aigner A, et al. Matrix metalloproteinases 2 and 9 mediate epidermal growth factor receptor transactivation by gonadotropin-releasing hormone[J]. J Biol Chem, 2003,278(47):47307-47318.
[11] Ohta K, Ishida Y, Fukui A, et al. Toll-like receptor (TLR) expression and TLRmediated interleukin-8 production by human submandibular gland epithelial cells[J]. Mol Med Rep, 2014,10(5):2377-2382.
Objective To investigate the molecular mechanism of the Macrophage-activating lipopeptide-2 (MALP-2) on secretion of MUC5AC in human airway epithelial cells. Methods The airway epithelial cell line NCI-H292 was cultured in vitro and stimulated with 0, 0.1,1.0 and 5.0 μg/ mL of MALP-2 for 24h. Secretion of MUC5AC and matrix metalloprotein-9 (MMP-9) in the supernatant were detected by ELISA; Phosphorylation of epithelial growth factor receptor (EGFR) was measured by Western blot. To observe the effect of EGFR and MMP-9 on the mediation of MUC5AC secretion, specific inhibitor AG-1478 and MMP-9 Inhibitor I was used before MALP-2 stimulation. Results The secretion level of MUC5AC and MMP-9 was very low in untreated cells. 0.1-5μg/mL of MALP-2 incubation for 18h signifi cantly upregulated MUC5AC secretion. In addition, 5μg/mL MALP-2 could induce EGFR phosphorylation after 1h of incubation. Treatment of AG-1478, an inhibitor of EGFR, signifi cantly abrogated MALP-2-induced MMP-9 and MUC5AC secretion. Furthermore, 10nmol/L MMP-9 inhibitor could also inhibit MUC5AC production. Conclusion Mycoplasma MALP-2 induces MUC5AC secretion via the EGFR/MMP-9 pathways in human airway epithelial cells
Macrophage-activating lipopeptide-2; Matrix metalloprotein-9; MUC5AC
10.3969/j.issn.1009-4393.2015.28.001
国家自然科学基金 (31370207)
湖南 421001 南华大学病原生物学研究所 (文道林 余敏君 游晓星 李冉辉 陈列松 朱翠明 李媛媛 曾焱华) 广东 518106 深圳市光明新区人民医院 (文道林) 湖南 422000 邵阳市中心医院检验科 (李媛媛)
曾焱华 E-mail:zengyihua21cn@126.com

