成品菊粉中果聚糖含量的液相色谱快速分析方法
孙蕊,贾鹏禹,谭策,王学群,李朝阳,李洪飞,刘宪红
(1.黑龙江八一农垦大学,大庆 163319;2.齐齐哈尔市出入境检验检疫局;3.东北林业大学大庆 生物技术研究院)
菊粉别名菊糖或译音成因纽林,是植物中储备性多糖,其主成分为果聚糖,是2009年我国批准的新资源食品之一。菊粉是水溶性极好的膳食纤维,具有预防龋齿、调节脂类代谢、促进钙吸收、降低血清胆固醇、提高免疫力等功能,可作为功能性配料和双歧杆菌增殖因子,广泛应用于功能性食品、饮料、烘焙食品和保健品的制造,同时也是生产低聚果糖、多聚果糖、高果糖浆、结晶果糖等产品的原料[1-4]。2013年,我国黑龙江省建成有亚洲最大的机制菊粉生产线,该生产线采用菊苣根为原料,果聚糖经水提取、离子交换和色谱纯化,去除蛋白,胶质,粗纤维,矿物质和杂糖,最后喷雾干燥得到成品菊粉。
成品菊粉中果聚糖含量快速检测方法是企业工艺过程控制、产品质量控制和全程物料盘点的迫切需求,同时研究采用现代仪器分析测试技术测试菊粉具有方法学意义。已有报道王建华等人采用离子色谱分离几种不同来源菊糖的方法[5-6],方法虽能够区分组成只有一个单糖单位差异的果聚糖同系物,但离子色谱方法设备依赖性强、仪器相对贵重,不适合厂区化验室运用;另有报道张泽生等人用特异性酶进行样品处理的高效液相色谱方法[7-8],方法较为繁琐,耗时长,不适合菊粉企业生产线“半小时”数据反馈的运行机制。首次利用配体交换和尺寸排阻的双机制分离模式,检测了成品菊粉中的果聚糖含量,建立了高效液相色谱检测方法,所建检测方法收到了满意的结果。
1 实验部分
1.1 仪器与试剂
高效液相色谱仪(型号:1200 美国安捷伦公司),配备:在线脱气机、自动进样器、四元梯度泵、示差折光检测器、柱温箱、Chemstation 色谱工作站;电子分析天平(感量:0.000 1 g 瑞士梅特勒托利多公司);真空冷冻干燥机(型号:coolsafe 110-4 丹麦Labogene公司)。
蔗糖、葡萄糖、果糖(标准品,纯度均大于99.5%,中国计量科学院)。实验所用水为超纯水,其他试剂均为国产色谱纯或分析纯试剂;成品菊粉由黑龙江某生物工程科技有限公司提供,高纯菊粉由实验室经制备色谱分离自制。
1.2 标准工作曲线绘制与样品前处理
各精密称取蔗糖、葡萄糖和果糖标准品100.00 mg,用超纯水定容至10 mL 容量瓶中,配制成3 种单糖的混标溶液,再逐级稀释为标准工作曲线系列溶液。标准溶液经0.45 μm 的水相针式滤膜过滤后上机分析,以各浓度对应峰面积做回归方程。
王跃文先生称刘诚龙是“文学特工”,他潜伏官场,当了文学特工兼官场深喉,其语言或是“歪嘴和尚”,其立意却是“观音菩萨”,他借“一品高官”警示:手清与脑清的“双清”官员方可为高品质高地位之社会栋梁!当今时代,反腐路上,利剑高悬,眼看着省级乃至部级“大老虎”接二连三落马,拍手称快过后,忧愤从心底来:浮出水面的“大老虎”,抑或依然深藏的“大老虎”,不归路成定局,皆因未能“双清”,而是“零清”:为官既不清廉,脑子亦不清白——如此,焉能为民做主?焉得不被政法“就地正法”,被正义“清理门户”?《一品高官》给我们奉上的,于高官,是千年不腐的清醒剂;于读者,是百味杂陈的文化大餐。
综上所述,为了推行水价改革,发挥出水价政策的节水杠杆作用,要深入分析水价和水资源需求之间的关系,围绕水权配置、设施完善、价格调整、产权改革、奖补机制、协会规范“六位一体”进行综合改革。进一步加强水资源管理,加快水管单位体制改革,规范计量设施,落实节水措施,促进农业节水和农业可持续发展,有效提高供水效率与供水效益,从而实现用水户节水意识的提升,达到农业增效、农民增收的目的。
1.3 液相色谱条件
实验考察了样品中各组分的分离情况,由图1可见,经标准品保留时间定性,其中杂糖组分蔗糖、葡萄糖和果糖分别在13.3 min,14.7 min 和15.4 min处洗脱,样品分离在16 min 内完成,各目标峰位分离情况良好。
1.4 定性与定量方法
综上,实验选择了Na 型配位体交换和尺寸排阻双模式进行样品组分分离,此外,根据尺寸排阻的分离机理,分子量大的组分先出峰,可以对样品的特性作出判断[12],如图1 中,样品C 和样品D 的峰位坐标比较(左侧红线)显示出样品C 的果聚糖分子量大的组分多于样品D(样品C 灰色区域的面积比样品D 大)。
实验比较了未加带尺寸排阻作用的Ca 配位体交换和加带尺寸排阻作用的Na 配位体交换色谱柱对样品中主要组分的分离效果,样品采用图1 中B样品,Ca 配位体交换色谱柱采用了Rezex RCMMonosaccharide Ca+2(8%),300×7.8 色谱柱(美国Phenomenex 公司),全水流动相,流速0.55 mL·min-1,柱温80℃;示差折光检测器,样品在优化的色谱条件下分离情况如图2 所示,可见色谱柱对果聚糖组分未具有较好的选择性,其在目标物分离优势上较带有尺寸排阻的Na 柱差。
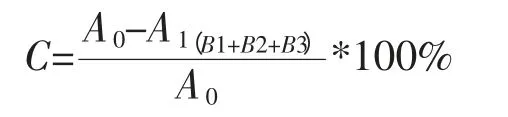
2 结果与讨论
2.1 方法适应性
色谱柱:Shodex SUGAR KS-802(300 mm×8 mm ID,6 μm),配同系保护柱SUGAR(50×8 mm ID,6 μm);流动相:100% 纯水;流速:0.55 mL·min-1;经典柱压:40 Bar;柱温:80 ℃;示差检测器温度:35 ℃;进样量:10 μL。
样品称量前采用真空冷冻进行干燥处理,准确称取5.00 g 样品,用水溶解并定容至100 mL,样液经0.45 μm 的水相针式滤膜过滤后上机分析。
2.2 分离柱的选择
三系杂交种皖芝10号参加2013年安徽省芝麻新品种区试,产量为1 498.50 kg/hm2,比对照品种豫芝4号增产2.04%,2014年通过安徽省鉴定。2015—2016年全国(江淮片)芝麻品种区域试验,两年平均产量1 261.65 kg/hm2,比豫芝4号(CK)增产2.54%;含油量为58.18%,蛋白质含量20.97%;茎点枯和枯萎病病情指数分别为5.07和0.85。该品种具有优质、高油、高产、多抗、综合性状优于全国对照品种豫芝4号等特点,适合制油、食品保健。
菊粉成分主要由线型果聚糖、蔗糖、葡萄糖和果糖等杂糖组成。线型菊糖型果聚糖(linear inulin)是果聚糖的一种天然存在形式,由线性β(2-1)键连接1 个或多个呋喃果糖形成,线型菊糖型果聚糖属菊类植物如菊芋、菊苣等特有[4],现今世界上菊粉加工中所用原料多采用菊芋或菊苣生产,其中菊苣占有相当的比重。线型菊糖型果聚糖和其他杂糖均具有糖类物质的多羟基结构,因此在糖类物质的色谱分离机制上,配位体交换色谱法是较好的选择[9-11];另外,对于样品中的多糖组分,考虑到果聚糖是聚合度不同的多聚体,在分离中我们增加了尺寸排阻作用,提高了色谱柱的选择性。
样品中果聚糖含量:样品重量A0减去杂糖(蔗糖B1、葡萄糖B2和果糖B3)总重A1,所得之差即为果聚糖重量,由果聚糖重量比样品重量即得菊粉中果聚糖的百分含量;各杂糖含量均采用外标法定量测得。果聚糖含量用公式表示为:
组分定性方式采用保留时间定性方法。

图1 样品色谱图Fig.1 Chromatogram of sample

图2 样品B 色谱图Fig.2 Chromatogram of sample B
2.3 回归方程、线性范围与检测限
实验对三种杂糖组分进行线性范围考察,根据峰面积Y 对各杂糖浓度X(mg·mL-1)进行线性回归,依据三倍噪声计算检测限。结果见表1。

表1 线性回归方程(n=6)Table 1 The linear regression equations(n=6)
2.4 方法精密度和回收率
实验考察了方法精密度,在同批次样品中取出样品6 份,分别按照1.2 流程进行前处理,分别进样考察各组分峰面积的相对标准偏差,蔗糖、葡萄糖和木糖的精密度(RSD,n=6)分别为:0.83%、0.98%和1.06%,相对标准偏差均远小于4.6%,方法的稳定性较高;实验采用实际样品中定量加入混标的方式进行了回收率实验,采用外标法定量,测得单糖平均回收率在99.1%~100.8%之间。结果见表2。
因此,在新背景下,开展3D打印技术人才的培养研究相当重要,高校如何培养能够满足社会需求的专业人才,值得探索。
尽管如此,伊朗不会轻易放弃已取得的成绩,必将采取各种方法巩固阵营,并继续在“新月带”的渗透,未来该地区将会陷入长期动荡。如果伊朗深陷地区争端无法抽身,势必影响其经济发展,由此带来的国内经济压力将会激化国内改革派和保守派两大势力的矛盾,甚至可能发生内乱。如果美国制裁导致伊朗政权的执政受到威胁,有可能导致执政当局铤而走险,甚至采取极端手段使地缘局势恶化。

表2 精密度与回收率(n=6)Table 2 The recovery and precision(n=6)
2.5 样品测试结果
实验对3 个不同类型的样品(生产、市售和自制高纯)进行了检测,不同样品所得各结果见表3,表中数据可以看出,生产产品和市售商品均已达到了新资源食品对菊粉成品的含量要求。实验同时比较了各样品经过长时间自然敞开放置的组分含量变化,可见菊粉样品随存放时间的延长,果聚糖发生降解导致果糖含量增加。

表3 样品测定结果(ND:未检出)Table 3 Test results of samples
3 结论
通过配位体交换和尺寸排阻双分离模式高效液相色谱实现了成品菊粉中果聚糖含量的测定,方法简便易操作,快速稳定,重现性好,可为菊粉企业生产工艺提供了快速准确数据;该方法所需仪器机型配置简单,仪器成本和运行成本投入小,适合企业运作,方法操作简单,易于移植;此方法硬件系统中检测器也可采用灵敏度更高的蒸发光散射(ELSD)作为检测器配置以提高方法灵敏度,相比较示差折光检测器而言,应用ELSD 可将检测灵敏度提高10 倍。
[1]Marcel B R.Inulin-type fructans functional food ingredients[J].The Journal of Nutrition,2007,137:2493-2502.
[2]徐雅梅,呼天明,张存莉.菊苣根提取物的抑菌活性研究[J].西北植物学报,2006,26(3):615-619.
[3]吴洪新,单昌辉,李薇,等.紫外分光光度计法测定菊粉多糖[J].安徽农业科学,2008,36(13):5251-5253.
[4]周兰,王强,丛佩华.苹果果实发育过程中绿原酸和总黄酮含量的变化[J].延边大学农学学报,2013(1):6-10.
[5]王建华,张帆,滕达,等.离子色谱法测定菊芋和菊芭中菊糖[J].理化检验:化学分册,2007,43(7):558-560.
[6]Chatterton N J,Harrison P A,Thornley W R,et al.Purification and quantification of kestoses (fruct-osylsucroses)by gel permeation and anion exchange chromatography[J].Plant Physiol Biochem,1989,27:289-295.
[7]张泽生,刘琳,王浩,等.酶-HPLC 联用与苯酚硫酸法测定菊粉含量的比较研究[J].河南工业大学学报:自然科学版,2008,29(6):48-50.
[8]Marsilio R,Naturale M,Manghi P,et al.Rapid and simple determination of inulin in biological fluids high -performance liquid chromatography with light-scattering detection [J].Journal of Chromatography B:Biomedical Sciences and Applications,2000,744(2):241-247.
[9]祝耀初,胡德骅,张奇.糖离子色谱分析进展[J].无锡轻工业学院学报,1992,11(2):176-183.
[10]Rassi E L.Carbohydrate analysis:high performance liquid chromatography and capillary electrophoresis [M].Amsterdam:Elsevier Seience Press,1994:391-429.
[11]贾鹏禹,孙蕊,何冬亮,等.配位体交换色谱法分析果葡糖浆中的单糖[J].黑龙江八一农垦大学学报,2013,25(3):59-62.
[12]吴艳芳,李晓鸽,车铁军,等.低分子量硫酸化多糖的体积排阻色谱法分离及其组成定量分析[J].色谱,2012,30(2):178-183.

