氯化钴诱导上皮间充质转化并增加胶质瘤T 98 G细胞侵袭能力的研究
邓 瑾 叶家才 黄赖机 廖志伟
广州医科大学附属肿瘤医院放疗科,广东 广州 510095
胶质瘤是中枢神经系统常见的肿瘤,尽管神经外科学在近年来得到飞速发展,但目前胶质瘤的临床疗效并没有取得突破性进展。放疗是脑胶质瘤综合治疗的重要手段,但由于多数胶质瘤对放疗敏感性较低,放疗效果并不理想[1]。上皮间充质转化 (epithelialmesenchymal transition,EMT)在胶质瘤细胞的侵袭和转移中起重要作用。细胞发生EMT后表现为对放疗和药物治疗的抵抗,并成为肿瘤复发的根源。
目前肿瘤细胞耐受放射线的机制尚未完全阐明,有研究认为实体瘤中普遍存在的缺氧是影响放射敏感性的重要原因之一[2]。缺氧微环境对肿瘤迁移和进展具有极其重要作用。越来越多的研究表明,缺氧促进肿瘤转移与肿瘤EMT有关[3-4]。既往研究已经显示氯化钴(CoCl2)能模拟体内缺氧环境。因此,本研究拟通过氯化钴模拟体内缺氧环境,进一步讨论氯化钴对胶质瘤细胞EMT和侵袭能力的影响,为胶质瘤治疗提供新的思路。
1 材料与方法
1.1 细胞培养及分组
人脑胶质瘤细胞株T98G购自中科院上海细胞库,按常规方法生长在含10%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素的High Glucose DMEM培养基中,处于对数生长期状态良好的细胞用0.05%胰酶消化传代,取指数生长期细胞进行实验。实验分三组,分别接种至60 mm培养皿,待细胞融合度为80%左右时,以0.3%的低血清培养基继续培养24 h使其同步化,然后向其中一皿加入二甲基亚砜(DMSO)作为对照孔,另外两皿中加入氯化钴诱导细胞缺氧,浓度分别为 100、200 μmol/L。
1.2 蛋白印迹法检测EMT标记蛋白表达
以氯化钴诱导细胞缺氧后,收集各组细胞,裂解液裂解细胞后提取总蛋白,从收集的细胞蛋白提取物中取5 μL进行蛋白定量。定量后进行SDS-PAGE电泳,电泳结束后转膜,放置5%脱脂奶粉封闭液中室温封闭2 h。用5%的脱脂奶粉稀释钙黏蛋白 (E-cadherin)(1∶500)和波形蛋白(Vimentin)(1∶2000)。含目的条带的膜与稀释后一抗4℃孵育过夜,TBS冲洗。辣根过氧化物酶(HRP)偶联的二抗,室温孵育1 h。增强化学发光法(ECL)显色,暗室胶片成像,结果扫描并定量,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照。各蛋白的相对含量通过目的条带的灰度值与内对照条带灰度值的比值表示,通过观察电泳条带的深浅强度判断EMT蛋白的表达水平。
1.3 Transwell和Boyden体外迁移实验
取对数生长期的细胞,消化成单细胞悬液后计数,调整浓度为2.0×105/mL;Boyden实验在小室下部加入一定量基质胶。将细胞加入Transwell或Boyden的上室,每孔加入100 μL细胞悬液。在Transwell或Boyden小室底部加入700 μL无血清培养基。同时在对照孔中加入DMSO,在处理组中加入终浓度为200 μmol/L的氯化钴。37℃,5%CO2培养箱中培养过夜,每组细胞做3个平行孔。取出小室,用镊子小心取出滤膜,吸干上室液体,甲醇室温固定30 min;结晶紫染色。用棉签擦去上层胶和上室未穿膜的细胞。在显微镜100倍光镜下随机挑取10个视野计数穿膜的细胞。以迁移细胞的绝对数目表示肿瘤细胞的迁移能力。
1.4 统计学方法
统计分析使用SPSS 13.0统计软件进行分析。正态分布的计量资料以均数±标准差()表示,多组间的比较采用方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 氯化钴诱导缺氧对T98G细胞形态的改变
将在生长对数期的T98G细胞接种至60 mm培养皿,共2皿。待细胞融合度为70%左右时,换上低血清(0.3%胎牛血清)培养基,向其中一皿加入DMSO作为对照孔,另外一皿中加入氯化钴,使其终浓度为200 μmol/L,继续培养24 h后置于倒置显微镜下观察细胞形态。结果发现对照组细胞大小较为均一,细胞边缘轮廓整齐清晰。200 μmol/L的氯化钴处理后的细胞,细胞轮廓较为粗糙,细胞呈现显著梭型变,部分细胞开始脱落。具体形态见图1。

图1 氯化钴诱导对T98G细胞形态的影响(100×)
2.2 氯化钴对T98G细胞EMT相关蛋白表达的影响
分别用100 μmol/L和200 μmol/L的氯化钴处理细胞后,检测EMT标记蛋白E-cadherin和Vimentin的表达情况。Western blot结果显示,相对于对照组细胞,氯化钴处理细胞诱导细胞缺氧后,E-cadherin表达显著降低(P<0.05或P<0.01),而Vimentin的表达显著增加(P<0.01)。100 μmol/L氯化钴处理细胞后,E-cadherin 的表达由 (100.0±12.1)%降至 (77.0±14.1)%,Vimentin 的 表 达 由 (100.0±11.5)% 增 加 至(179.4±25.4)%,随着氯化钴浓度增加至 200 μmol/L,E-cadherin 也进一步降低至 (68.0±13.8)%(图 2A),Vimentin 的表达也升高至(210.5±34.4)%(图 2B)。但是 100 μmol/L和 200 μmol/L的氯化钴处理的细胞E-cadherin和Vimentin的表达差异无统计学意义(P> 0.05)。
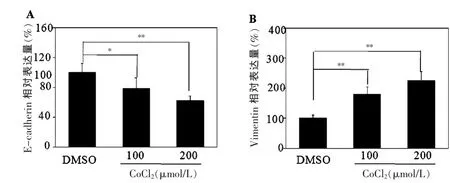
图2 Western blot检测不同浓度CoCl2对T98G细胞EMT相关蛋白E-Cadherin和Vimentin表达的影响
2.3 氯化钴诱导缺氧促进T98G细胞体外迁移能力
通过Transwell侵袭小室观察T98G细胞在缺氧和常氧环境下体外迁移能力的变化。如图3A所示,以氯化钴处理的细胞较对照组细胞迁移率显著增加,透膜细胞数分别为(29±5)个和(53±4)个(P=0.0397)。Boyden实验同样显示,氯化钴处理胶质瘤细胞后,穿过小室细胞数量由对照组的(26±3)个增加至(36±2)个(P=0.0402)(图 3B)。说明氯化钴处理后,T98G 细胞迁移及侵袭能力显著增加。
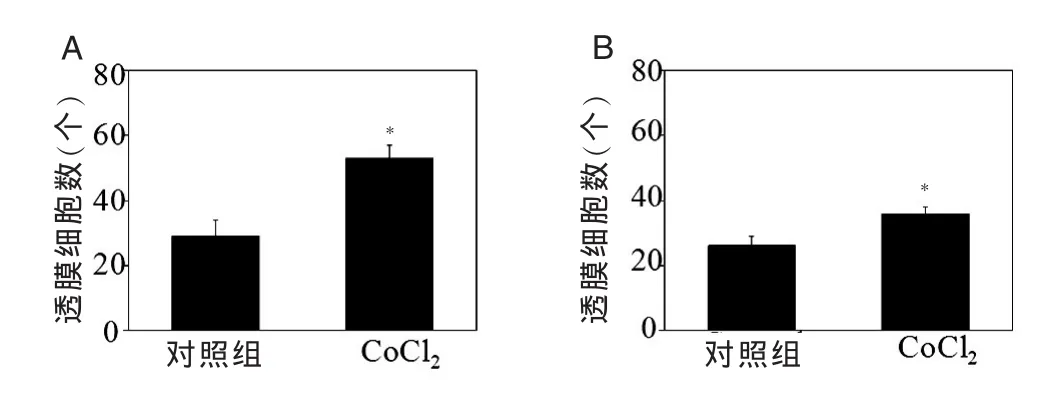
图3 Transwell和Boyden法检测氯化钴对T98G细胞体外侵袭能力的影响
3 讨论
胶质瘤是中枢神经系统最常见的肿瘤。以往脑胶质瘤的治疗以手术为主,但鉴于脑组织功能的特殊性,手术难以扩大切除范围,术后易复发。放疗是脑胶质瘤术后重要的治疗手段,但是脑胶质瘤放射敏感性存在很大差异。EMT在胶质瘤侵袭转移中起关键作用,是肿瘤转移和放化疗抵抗的重要因素。目前肿瘤细胞耐受放射线的机制尚未完全阐明,有研究表明肿瘤微环境缺氧可能是影响肿瘤细胞放射敏感的重要因素[5]。
细胞失控性生长是恶性肿瘤的主要特征,不断增多的细胞导致细胞耗氧量的增加,从而造成肿瘤内缺氧微环境的形成。缺氧可以使细胞产生适应性改变,促进肿瘤细胞迁移、侵袭和转移。缺氧也给肿瘤的治疗带来不便,肿瘤多种恶性生物学行为包括放化疗抵抗、增殖和血管生成等都与缺氧相关[6]。
缺氧诱导模型主要有两种,即物理缺氧模型和化学缺氧模型。物理缺氧模型通过改变氧分压,使细胞处于低氧状态,其优点是与体内细胞缺氧的生理状况相接近,但需要专业的设备和器械,费用高昂。而化学缺氧模型通过氯化钴抑制低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的特异性脯氨酸羟化酶而抑制HIF-1α的强化,从而阻断其泛素化降解,进而活化HIF-1α信号通路。笔者既往研究发现,氯化钴可使T98G细胞HIF-1α蛋白水平明显升高,且其在一定的时间剂量范围内是安全的,并不造成显著的细胞毒性[7]。更重要的是,Manotham等[8]同样通过氯化钴来模拟低氧环境。因此,本实验选择氯化钴化学缺氧模型研究胶质瘤T98G细胞在缺氧条件下的生物学特性。
EMT在肿瘤侵袭转移中起关键作用,肿瘤细胞通过EMT获得侵袭性表型,使得其游走迁移能力及降解细胞外基质能力增强。在EMT的发生过程中,细胞表型发生相应改变:一方面,肿瘤细胞丧失了上皮表型如E-cadherin和β-catenin的表达;另一方面又获得了间充质表型如Vimentin和Fibronectin等表达[9-10]。缺氧是诱导癌细胞EMT转化的重要生物因素之一[11]。本实验结果表明氯化钴诱导缺氧后,T98G细胞中上皮细胞标记表型E-cadherin表达降低,而间充质细胞标志蛋白Vimentin表达增加,提示氯化钴诱导缺氧后T98G细胞发生EMT。肿瘤细胞本身的迁移和运动能力在肿瘤细胞侵袭转移过程中发挥重要作用,通过Transwell侵袭小室实验进一步说明缺氧诱导T98G细胞EMT变化后,T98G细胞迁移能力明显增加。因此逆转缺氧诱导EMT将可能抑制T98G细胞的侵袭转移。与本研究结果一致的是,Zhang等[12]研究显示,氯化钴能通过低氧促进Snail1表达,促进EMT的发生和肝癌细胞侵袭能力;更重要的是,去除氯化钴后能逆转其所诱导的EMT,Snail1 mRNA和蛋白表达水平同样下降至未处理时水平。Duan等[13]研究通过氯化钴建立体外低氧模型,而这种通过氯化钴诱导低氧导致的肝癌细胞迁移和侵袭能力的增加以及EMT的发生能被姜黄素逆转。
综上所述,本研究结果表明,氯化钴模拟体外缺氧可以促进T98G胶质瘤细胞EMT的发生,并增加肿瘤细胞迁移能力。以上发现为未来胶质瘤治疗提供了可能的靶点和理论依据,为我们针对肿瘤周围的低氧环境提供了理论基础。
[1]金志良,孙新臣,魏青.脑胶质瘤放射敏感性基因研究的进展[J].医学研究生学报,2007,20(7):763-765,769.
[2]Hill RP,Marie-Egyptienne DT,Hedley DW.Cancer stem cells,hypoxia and metastasis[J].Semin Radiat Oncol,2009,19(2):106-111.
[3]Zhang L,Huang G,Li X,et al.Hypoxia induces epithelial-mesenchymal transition via activation of SNAI1 by hypoxia-inducible factor-1alpha in hepatocellular carcinoma[J].BMC Cancer,2013,13:108.
[4]Yan W,Fu Y,Tian D,et al.PI3 kinase/Akt signaling mediates epithelial-mesenchymal transition in hypoxic hepatocellular carcinoma cells[J].Biochem Biophys Res Commun,2009,382(3):631-636.
[5]Staab A,Loeffler J,Said HM,et al.Effects of HIF-1 inhibition by chetomin on hypoxia-related transcription and radiosensitivity in HT 1080 human fibrosarcoma cells[J].BMC Cancer,2007,7:213.
[6]Tsai YP,Wu KJ.Hypoxia-regulated target genes implicated in tumor metastasis[J].J Biomed Sci,2012,19:102.
[7]邓瑾,田琪,程国华,等.缺氧诱导因子-1对人脑胶质瘤细胞株T98G放射线敏感性的影响[J].肿瘤预防与治疗,2010,23(2):103-106.
[8]Manotham K,Tanaka T,Matsumoto M,et al.Transdifferentiation of cultured tubular cells induced by hypoxia[J].Kidney Int,2004,65(3):871-880.
[9]Bastid J.EMT in carcinoma progression and dissemination:facts,unanswered questions,and clinical consid erations[J].Cancer Metastasis Rev,2012,31(1-2):277-283.
[10]Thiery JP,Acloque H,Huang RY,et al.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[11]Jiang J,Tang YL,Liang XH.EMT:a new vision of hypoxia promoting cancer progression [J].Cancer Biol Ther,2011,11(8):714-723.
[12]Zhang L,Huang G,Li X,et al.Hypoxia induces epithelial-mesenchymal transition via activation of SNAI1 by hypoxia-inducible factor-1alpha in hepatocellular carcinoma[J].BMC Cancer,2013,13:108.
[13]Duan W,Chang Y,Li R,et al.Curcumin inhibits hypoxia inducible factor1alphainduced epithelialmesenchymal transition in HepG2 hepatocellular carcinoma cells [J].Mol Med Rep,2014,10(5):2505-2510.

