蛇床子素延缓叔丁基过氧化氢诱导的神经干细胞衰老
姚璎珈,孔亮,教亚男,李少恒,陶震宇,闫宇辉,杨静娴
(辽宁中医药大学1.研究生学院,2.药理学教研室,辽宁大连116600)
蛇床子素延缓叔丁基过氧化氢诱导的神经干细胞衰老
姚璎珈1,孔亮1,教亚男1,李少恒1,陶震宇1,闫宇辉1,杨静娴2
(辽宁中医药大学1.研究生学院,2.药理学教研室,辽宁大连116600)
目的通过建立神经干细胞(NSC)体外衰老模型,探讨蛇床子素(Ost)延缓NSC衰老的作用,并探讨其可能调控机制。方法体外培养NSC,在增殖培养基中传代纯化培养至第3代,用于细胞实验。利用叔丁基过氧化氢(t-BHP)50,100和150 μmol·L-1分别与NSC孵育1,2和3 h,CCK-8法检测细胞存活率,确定t-BHP 100 μmol·L-1与NSC孵育2 h为制备细胞衰老模型的最佳条件。再加入Ost 50,100和150 μmol·L-1作用1,2和3 h,CCK-8法检测细胞存活率,选择Ost促进细胞存活的最佳作用浓度和作用时间。实验分为细胞对照组、衰老模型组(NSC与t-BHP 100 μmol·L-1作用2 h)和模型+Ost组(NSC与t-BHP 100 μmol·L-1作用2 h后,再与Ost 100 μmol·L-1作用2 h),用Ki67染色法检测NSC细胞增殖能力,免疫组化法检测NSC分化能力,衰老β-半乳糖苷酶(Sa-β-gal)法检测衰老细胞百分率,RT-PCR法检测p53,p21,p19和p16基因表达,Western蛋白印迹法检测P16、细胞周期蛋白依赖性激酶D1(CDKD1)和磷酸化成视网膜细胞瘤蛋白(pRb)蛋白表达。结果Ost 100 μmol·L-1作用2 h可明显促进NSC存活(P<0.01)。与细胞对照组相比,模型组NSC增殖能力明显下降(P<0.05),分化为星形胶质细胞、神经元和少突胶质细胞的能力亦明显下降(P<0.05),Sa-β-gal阳性衰老细胞百分率升高(P<0.01)。与模型组相比,模型+Ost 100 μmol·L-1组NSC增殖能力升高(P<0.05),分化为星形胶质细胞、神经元和少突胶质细胞的能力亦明显提高(P<0.05),Sa-β-gal阳性衰老细胞百分率下降(P<0.01)。RT-PCR结果显示,与模型组相比,模型+Ost 100 μmol·L-1组p16和p53mRNA表达水平降低(P<0.05),p19和p21mRNA表达无显著性变化;与模型组相比,模型+Ost 100 μmol·L-1组P16蛋白表达降低,同时CDKD1和pRb蛋白表达水平明显升高(P<0.05)。结论Ost具有延缓t-BHP造成NSC衰老的作用,其延缓NSC衰老作用机制可能与调控P16-pRb信号通路有关。
神经干细胞;蛇床子素;增殖;分化;衰老
DOl:10.3867/j.issn.1000-3002.2015.04.006
细胞衰老的概念是由Hayflick和Moorhead在培养正常人成纤维细胞时提出的,他们发现细胞能够进入不可逆转的生长停滞期[1]。人们对衰老机制的认识存在许多假说,例如免疫功能退化学说、自由基学说和线粒体损伤学说等[2]。随着研究的深入,干细胞衰老是迄今解释机体衰老机制的最新学说,人们意识到干细胞并非为“长生不老”的细胞。干细胞衰老表现为增殖能力和分化能力下降、端粒酶活性增强、端粒缩短以及与衰老相关基因和蛋白的表达上调[3]。神经干细胞(neural stem cells, NSC)的衰老表现为自我更新和多向分化能力衰退、对神经保护作用下降以及p16INK4a等衰老基因的表达上调[4]等。
蛇床子素(osthole,Ost)为独活活性单体成分,中药独活为伞形科植物重齿毛当归(Angelica pubescensMaxim.f.biserrataShan et Yuan)的干燥根[5],始载于《神农本草经》,具有祛风除湿、通痹止痛之功。现代药理学研究发现,Ost具有治疗肺炎[6]、改善肾缺血再灌注损伤[7]以及促进新生大鼠成骨细胞增殖[8]等作用。本研究通过建立NSC衰老模型,研究Ost是否具有延缓NSC衰老作用及其机制。
1 材料与方法
1.1 动物、药物、试剂和仪器
自然分娩48 h内的乳小鼠(SPF级昆明种小鼠),体质量2~3 g,购自大连医科大学实验动物中心,动物许可证号:SCXK(辽)2008-0002。Ost,中国食品药品检定研究院。DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶(0.25%)和双抗(100 kU·L-1青霉素+100 mg·L-1链霉素),美国Gibco公司;cAMP、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF),美国Peptide公司;Trizol试剂、B27添加剂(B27)和引物序列,美国Invitrogen公司;p16:(上)ATGATGGGCAACGTTCACGTA;(下)AACGCAAATATCGCACGATGT;p19:(上)TCCAAGATGCCTCCGGTACT;(下)CCTGTGGTGGAGATCAGATTCA;p21:(上)GGGACAAGAGGCCCAGTACTT;(下)TGCGCTTGGAGTGATAGAAATC;p53(上)GCCATGGCCATCTACAAGAAG;(下)GCCTCGGGTGGCTCATAAG;β肌动蛋白:(上)GGGAAATCGTGCGTGACAT;(下)TCAGGAGGAGCAATGATCTTG;DMSO,美国Sigma公司;CCK-8试剂盒,美国Dojindo公司;叔丁基过氧化氢(tert-butyl hydroperoxide,t-BHP),成都格雷西亚化学技术有限公司;大鼠抗巢蛋白(nestin)抗体和兔抗胚胎干细胞关键蛋白(SRY-related HMG-box 2,SOX2)抗体,美国Millipore公司;FITC标记山羊抗大鼠IgG抗体和Cy3标记驴抗兔IgG抗体,美国Jackson公司;兔抗Ki67抗体、兔抗胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体、兔抗少突胶质细胞前体蛋白(oligodendrocyte 2,NG2)抗体、兔抗神经元核(neuronal nuclei,NeuN)抗体、P16抗体、细胞周期蛋白依赖性激酶D1(cyclin-dependent kinases D1,CDKD1)抗体和磷酸化成视网膜细胞瘤蛋白(phosphorylation retinoblastoma protein,pRb)抗体,北京博奥森公司;第一链cDNA合成试剂盒和PCR引物扩增试剂盒,美国Thermo公司;细胞衰老β-半乳糖苷酶(senescence β-galactosidase,Sa-β-gal)染色试剂盒,碧云天公司;全蛋白提取试剂盒、Bradford法检测蛋白浓度试剂盒和蛋白缓冲液上样试剂盒,南京凯基生物科技发展有限公司;DEPC和Triton X-100试剂,美国Amresco公司;牛血清白蛋白(albumin from bovine serum,BSA),北京索莱宝科技有限公司。24孔板培养板和EP管,美国Cyagen公司;倒置荧光生物显微镜,日本尼康公司;超低温冰箱,青岛海尔股份有限公司;CO2培养箱(NU-4750E),美国Nuaire公司;紫外-可见光分光光度计(UV-5600)和酶标仪(MR-96A),深圳迈瑞生物医疗电子股份有限公司;PCR仪(MG96G),杭州朗基科学仪器有限公司;凝胶成像仪(4100),上海天能科技有限公司;水平核酸电泳仪(PowerPac系列),美国Bio-Rad公司。
1.2 NSC培养和鉴定
将自然分娩48 h内的小鼠浸泡在75%乙醇中10 min,将其固定在手术台上,取出海马区,用含双抗的PBS液清洗,收集于EP管内,用手术剪将其剪碎,434.7×g离心8 min。弃上清,加入胰酶,37℃消化15 min,加入培养基终止消化,434.7×g离心8 min。弃上清,加入增殖完全培养基(DMEM/ F12+2%B27+0.2 μg·L-1EGF+0.2 μg·L-1bFGF+ 1%双抗),混悬细胞,434.7×g离心7 min。弃上清,加入增殖培养基,以1×109L-1的密度接种于24孔板,5%CO2,37℃培养箱中培养[9]。培养3~4 d进行细胞传代,培养纯化至第3代NSC接种于96孔板,培养至第3天用于实验。
以5×108L-1密度接种于96孔板,24 h后观察细胞贴壁,用于鉴定。向96孔板每孔加入4%多聚甲醛室温下固定15 min,加入1%Triton X-100透化,PBS清洗3次,加入1%BSA稀释的巢蛋白抗体和SOX2抗体(1∶150),4℃孵育过夜。次晨用PBS清洗细胞,分别加入FITC标记羊抗大鼠IgG和Cy3标记驴抗兔IgG二抗(1∶100),室温孵育1 h,再用DAPI染核15 min,PBS清洗后吸净培养孔内的液体,滴加少量抗荧光淬灭剂,在倒置荧光显微镜下观察染色情况,观察巢蛋白、SOX2和DAPI阳性细胞,重复拍照3次。
1.3 NSC衰老模型的制备[10]
第3代NSC以5×109L-1密度接种于96孔板,培养24 h,将t-BHP溶于完全培养基,t-BHP终浓度分别为50,100和150 μmol·L-1,分别培养1,2和3 h。根据CCK-8试剂盒的说明书,每孔加入10 μL CCK-8溶液后放入培养箱内再培养4 h,用酶标仪检测450 nm处的吸光度值(A),每组3复孔。细胞存活率(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.4 CCK-8法检测NSC存活率
选择t-BHP 100 μmol·L-1作用2 h制备NSC衰老模型,随后再加入Ost 50,100和150 μmol·L-1作用1,2和3 h,细胞密度同1.3,用CCK-8试剂盒检测细胞存活率,选择Ost对NSC存活有促进作用的最佳浓度和作用时间。
1.5 Sa-β-gal法检测NSC衰老阳性率
第3代NSC以5×109L-1密度接种于96孔板中培养24 h,先用t-BHP 100 μmol·L-1作用2 h,再用Ost 100 μmol·L-1作用2 h(同时设正常对照组和t-BHP模型组),然后每孔加入β-gal固定液100 μL,室温15 min后用PBS清洗,每孔再加入100 μL染色工作液37℃孵育过夜,第2天吸出液体置于载玻片上观察染色情况,观察到部分NSC被染成蓝色。每组设3复孔。在光镜下计数NSC,再计数蓝色NSC,蓝色NSC数量占NSC总数百分比表示NSC衰老阳性率[11]。
1.6 免疫荧光染色法检测NSC增殖和分化能力
根据1.5分组的细胞,第3代NSC以5×109L-1密度接种于96孔板中培养24 h,用t-BHP 100 μmol·L-1作用2 h,再用Ost 100 μmol·L-1作用2 h,洗去原培养液,换成不含t-BHP和Ost的培养基进行培养,第3天观察NSC的神经球成球率。将NSC用兔抗Ki67一抗孵育过夜,再用Cy3标记驴抗兔IgG二抗孵育后,用DAPI染核15 min,计数Ki67染色阳性NSC百分率,检测NSC增殖能力[12]。
将第3代细胞接种于分化培养基中(DMEM/F12+ 10%FBS+cAMP 100 mg·L-1+1%双抗)[13],用t-BHP100 μmol·L-1作用2 h,再用Ost 100 μmol·L-1作用2 h后洗去培养液,换成分化培养基再继续培养至第7天,观察各组NSC分化为不同类型的神经细胞。NSC分别用兔抗GFAP一抗、兔抗NG2一抗和兔抗NeuN一抗孵育过夜,再分别用Cy3标记驴抗兔IgG二抗孵育1 h,DAPI染核15 min。GFAP阳性细胞为星形胶质细胞,NG2阳性细胞为少突胶质细胞,NeuN阳性细胞为神经元。
1.7 RT-PCR检测p53,p21,p19和p16基因的表达
取1.5分组并处理的细胞,将培养的神经球打散为单个NSC,培养于6孔板内,弃去培养液,提取细胞总RNA[14]。根据试剂盒的说明书合成cDNA,然后进行PCR扩增。扩增条件:95℃预变性2 min;95℃变性30 s,p16,p19,p21,p53和β肌动蛋白退火温度分别为61.9,65.3,64.4,65.8和53.3℃,30 s,72℃延伸1 min,35个循环;最后延伸10 min。利用ImageJ图像分析软件对条带进行积分吸光度(integrated absorbance,IA)扫描,用待测基因与β肌动蛋白条带IA比值表示待测基因相对表达水平。
1.8 Western蛋白印迹法检测P16,CDKD1和pRb蛋白表达
取1.5分组并处理的细胞,每组1×107细胞,根据全蛋白试剂盒说明书提取蛋白,用Bradford法检测蛋白质浓度,配制SDS-PAGE凝胶,每孔加蛋白100 ng,80 V稳压电泳。在样品过浓缩胶后,调整为100 V,当指示剂达到分离胶底部停止电泳,然后用预饱和的PVDF膜进行转膜,将PVDF膜用TBST液清洗后,用1∶1000稀释的抗P16,CDKD1,pRb和β肌动蛋白一抗孵育,4℃过夜,次晨用1∶2000稀释的二抗37℃孵育1 h,用DAB试剂盒显色,用ImageJ图像分析软件对条带进行IA扫描,用待测蛋白与β肌动蛋白条带IA比值表示待测蛋白相对表达水平。
1.9 统计学分析
2 结果
2.1 NSC培养与鉴定
培养至第3天细胞完全形成NSC球并逐渐增大,第5天形成由大量单个细胞组成近圆形的NSC球(图1A)。巢蛋白免疫荧光染色单个NSC核为绿色(图1B),SOX2为红色(图1C),巢蛋白和SOX2重复(merge)结果(图1D和E)显示,通过机械分离培养的NSC球同时显示巢蛋白和SOX2阳性特征。免疫荧光检测结果显示,巢蛋白特异性标志NSC阳性细胞数占DAPI标记的细胞核阳性细胞数的比例>95%,表明培养纯化至第3代的细胞基本为NSC。

Fig.1 ldentification of neural stem cells(NSCs)from rat hippocampus by immunofluorescent staining.A:Typical neurosphere on the 5th day(×400);B:nestin stained NSCs(×400);C:SRY-related HMG-box 2(SOX2)stained NSCs(×400);D:nestin/SOX2merge photo(×400);E:nestin/SOX2merge photo(×200).
2.2 NSC衰老模型的制备条件
CCK-8法检测结果(图2)表明,t-BHP 50 μmol·L-1作用1~3 h对NSC存活无明显抑制作用;150 μmol·L-1作用2和3 h,>60%细胞死亡;t-BHP 100 μmol·L-1作用2 h NSC存活率为(61.3± 3.6)%。因此,选择t-BHP 100 μmol·L-1作用2 h制备NSC衰老模型。
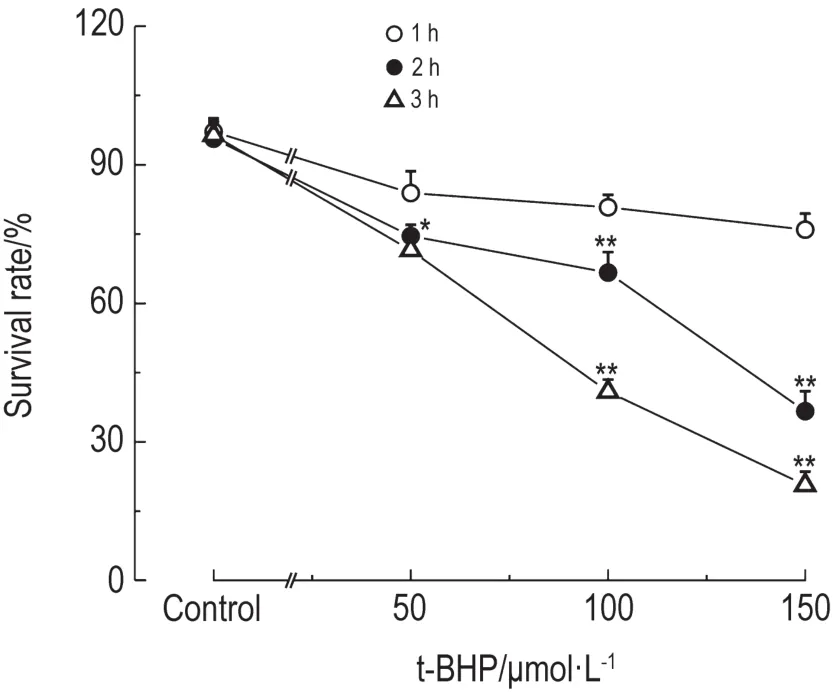
Fig.2 Survival rate of NSCs with tert-butyl hydroperoxide(t-BHP)treatment.compared with t-BHP 1 h group at the same concentration.
2.3 蛇床子素对衰老NSC存活率的影响
由图3可见,t-BHP 100 μmol·L-1作用1~3 h, NSC存活率均明显低于正常对照组(P<0.01);Ost 100和150 μmol·L-1作用2 h对t-BHP导致的NSC存活率下降有改善作用(P<0.01,P<0.05)。Ost其他浓度和其他作用时间无明显作用。

Fig.3 Effect of osthole(Ost)on NSC survival after treatment with t-BHP.compared with normal control group on the same time;#P<0.05,##P<0.01,compared with t-BHP group on the same time.
2.4 蛇床子素对NSC衰老率的影响
由图4所示,与正常对照组相比,模型组Sa-βgal染色阳性细胞百分率明显升高(P<0.01);与模型组比较,Ost 100 μmol·L-1作用2 h Sa-β-gal染色阳性细胞百分率下降30.0%(P<0.01)。
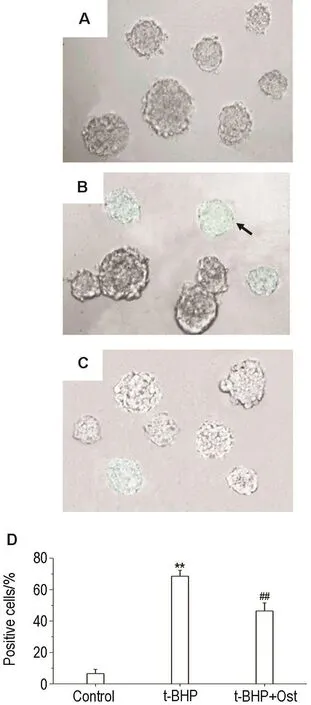
Fig.4 Effect of Ost on percent of senescence β-galactosidase(Sa-β-gal)stainingpositiveNSCsafter treatment with t-BHP(×200).NSCs were incubated with t-BHP 100 μmol·L-1for 2 h,then incubated with Ost 100 μmol·L-1for another 2 h.A:normal control;B:t-BHP group;C:t-BHP+Ost group.The arrow shows senescenced NSCs.D was the quantitative result of A-C.n=3.**P<0.01,compared with normal control group;##P<0.01,compared with t-BHP group.
2.5 蛇床子素对NSC增殖和分化的影响
由图5所示,与正常对照组相比,模型组ki67阳性NSC百分率明显降低(P<0.01),Ost组ki67阳性率与模型组相比增加了43.9%,表明Ost可逆转t-BHP导致的NSC增殖能力的降低。
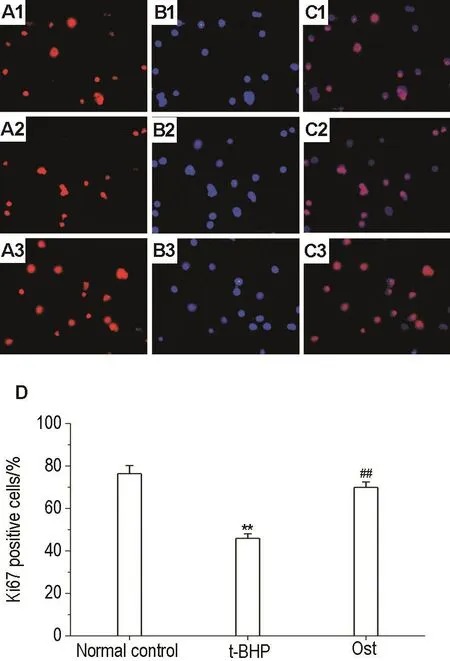
Fig.5 Effect of Ost on proliferation of NSCs after treatment with t-BHP(×200).See Fig.4 for the cell treatment.A:normal control group;B:t-BHP model group;C:t-BHP+ Ost group;1:Ki67 staining cells(red);2:DAPI staining cells (blue);3:Ki67+/DAPI+merge diagram.D was the quantitative result of A-C.compared with normal control group;##P<0.01,compared with t-BHP group.
由图6所示,与正常对照组相比,NSC分化为星形胶质细胞(GFAP,红色)、神经元(NeuN,红色)和少突胶质细胞(NG2,红色)NSC百分率明显降低(P<0.05,P<0.01);与模型组相比,Ost组NSC分化为星形胶质细胞和神经元的百分率分别提高了29.4%和17.8%,但分化为少突胶质细胞的百分率无显著性变化。
2.6 蛇床子素对P53-P21-PRb与P16-PRb通路上的p53,p21,p19和p16mRNA表达的影响
由图7所示,与正常对照组相比,模型组p16,p19,p21和p53mRNA的表达明显提高(P<0.05,P<0.01);与模型组比较,Ost组p16和p53mRNA的表达分别降低至44.7%和38.5%(P<0.05),但p21和p19mRNA的表达无显著性差异,提示Ost可能对NSC的P16-pRb信号通路有影响。
2.7 蛇床子素对NSCP16-pRb通路上的P16,CDKD1和pRb蛋白表达的影响

Fig.6 Effect of Ost on differentiation ability of NSCs after treatment with t-BHP(×200).See Fig.4 for the cell treatment.A:normal control group;B:t-BHP model group;C: t-BHP+Ost group;1:GFAP+(red)/DAPI+(blue)merge diagram; 2:NeuN+(red)/DAPI+(blue)merge diagram;3:NG2+(red)/ DAPI+(blue)merge diagram.D was the quantitative result ofcompared with normal control group;#P<0.05,compared with t-BHP group.

Fig.7 Effect of Ost on p53,p21,p19 and p16 mRNA expression of NSCs after treatment with t-BHP by RT-PCR. See Fig.4 for the cell treatment.Lane 1:normal control group;lane 2:t-BHP model group;lane 3:t-BHP+Ost group.B was the semiquantitative result of A.compared with normal control group;#P<0.05,compared with t-BHP group.
由图8所示,与正常对照组相比,模型组P16蛋白表达升高了49.1%,CDKD1和pRb蛋白表达分别下降了48.8%和35.1%(P<0.05,P<0.01);Ost组与模型组相比,P16蛋白表达降低了20.7%,CDKD1和pRb蛋白表达提高了16.9%和16.6%(P<0.01),进一步表明Ost延缓NSC衰老的作用机制可能是与P16-pRb通路有关。

Fig.8 Effect of Ost on protein expression of P16, cyclin-dependent kinases D1(CDKD1)and phosphorylation retinoblastoma protein(pRb)in NSCs after treatment with t-BHP by Western blotting.See Fig.4 for the cell treatment.Lane 1:normal control group;lane 2:t-BHP model group;lane 3:t-BHP+Ost group.B was the semiquantitative result of A.compared with normal control group;#P<0.05,compared with t-BHP group.
3 讨论
NSC是一种具有自我更新、多向分化的细胞,t-BHP为一种过氧化物,它可通过氧化应激途径造成细胞的增殖能力、分化能力下降而衰老。本研究发现,t-BHP造模后,NSC的增殖和分化能力均明显下降,符合NSC衰老特征。Ost 100 μmol·L-1作用2 h后,与衰老模型组相比,可明显提高NCS存活率;通过免疫荧光染色法发现,Ki67阳性率增加了43.9%,向星形胶质细胞和神经元分化能力提高了29.4%和17.8%,向少突胶质细胞细胞分化不明显。另外,Ost作用后,可降低与衰老相关的β-gal阳性率。上述结果表明,Ost可改善衰老NSC的增殖和分化能力,并降低衰老细胞的百分率,对NSC具有延缓衰老的作用。
P53-P21-pRb和P16-pRb信号途径是诱导细胞衰老的两条途径。p16基因是由Serrano等[15]利用酵母双杂交蛋白互相作用扫描技术发现的一个阳性cDNA克隆蛋白,此蛋白对CDK4活性具有抑制作用,所以将其称为P16INK4a。pRb为人成视网膜瘤细胞,当细胞出现衰老状态,P16使CDKD1活性下降,进而会抑制pRb的磷酸化,使其处在低磷酸化状态[16]。本研究发现,NSC用t-BHP 100 μmol·L-1作用2 h,再用Ost 100 μmol·L-1作用2 h,可明显降低p16mRNA的表达,p21和p19 mRNA表达与模型组相比无显著性差异。提示Ost有可能通过作用于P16-pRb途径发挥延缓NSC衰老的作用。Western蛋白印迹法结果表明,Ost可明显降低NSC P16蛋白表达,增强CDKD1和pRb蛋白表达。说明,Ost对体外培养的NSC具有延缓衰老的作用,并且可能通过P16-pRb途径发挥其作用。
大多数神经退行性疾病与氧化损伤引起的神经元丢失有密切关系[17],例如阿尔茨海默病,公认的致病学说为神经元的丢失,因为随着年龄的增加,NSC出现衰老现象,增殖和分化能力均下降,最终导致疾病的发生。本研究通过Ost作用于衰老NSC,增强其增殖和分化能力,并且分化为更多神经元,这将为治疗有关神经元丢失的疾病提供新的治疗途径。但从遗传因素来看,衰老并非由单一基因所决定,而是由一套成熟的途径中的各种靶点刺激下游基因发生上调或者下调而引起的,本课题组正结合中药多靶点的作用特点,对发挥延缓NSC衰老的作用进行进一步研究。
[1]Collado M,Blasco MA,Serrano M.Cellular senescence in cancer and aging[J].Cell,2007,130(2):223-233.
[2]Harman D.Free radical theory of aging:an update:increasing the functional life span[J].Ann N Y Acad Sci,2006,1067:10-21.
[3]Limke TL,Rao MS.Neural stem cells in aging and disease[J].J Cell Mol Med,2002,6(4):475-496.
[4]Molofsky AV,Slutsky SG,Joseph NM,He S,Pardal R,Krishnamurthy J,et al.Increasing p16INK4a expression decreases forebrain progenitors and neurogenesis during ageing[J].Nature,2006,443(7110):448-452.
[5]The People′s Republic of China Pharmacopeia in 2001(中华人民共和国药典2010年版一部)[S]. Beijing:ChemicalEngineeringIndustryPress:2010.
[6]Li Z,Ji H,Song X,Hu J,Han N,Chen N.Osthole attenuates the development of carrageenan-induced lung inflammation in rats[J].Int Immunopharmacol,2014,20(1):33-36.
[7]Zheng Y,Lu M,Ma L,Zhang S,Qiu M,Ma X.Osthole ameliorates renal ischemia-reperfusion injury by inhibitinginflammatoryresponse[J].UrolInt,2013,91(3):350-356.
[8]Li LH,Ding DF,Du GQ,Gong H,Wang HH,Zhan HS.Effect of osthole on proliferation of neonatal rat osteoblast and the relative mechanism research[J].Chin J Orthop Traumatol(中国骨伤),2013,26(5):419-422.
[9]Yang J,Yan Y,Ciric B,Yu S,Guan Y,Xu H,et al.Evaluation of bone marrow-and brain-derived neural stem cells in therapy of central nervous system autoimmunity[J].Am J Pathol,2010,177(4):1989-2001.
[10]Yao YJ,Hu Y,Li SH,Jiao YN,Kong L,Tao ZY,et al.Osthole promotes the proliferation of neural stem cellsin vitro[J].Chin J Tissue Eng Res(中国组织工程研究),2014,18(32):5184-5189.
[11]ADong CM,Wang XL,Wang GM,Zhang WJ,Zhu L,Gao S,et al.Stress-induced cellular aging model with postnatal neural stem cells[J].Cell Death Dis, 2014,5:e1116.
[12]Scholzen T,Gerdes J.The Ki-67 protein:from the known and the unknown[J].J Cell Physiol,2000,182(3):311-322.
[13]Yang J,Yan Y,Ciric B,Yu S,Guan Y,Xu H,et al.Evaluation of bone marrow-and brain-derived neural stem cells in therapy of central nervous system autoimmunity[J].Am J Pathol,2010,177(4):1989-2001.
[14]Tatsumi K,Okuda H,Makinodan M,Yamauchi T,Makinodan E,Matsuyoshi H,et al.Transient activation of Notch signaling in the injured adult brain[J].J Chem Neuroanat,2010,39(1):15-19.
[15]Serrano M,Hannon GJ,Beach D.A new regulatory motif in cell-cycle control causing specific inhibition of cyclin D/CDK4[J].Nature,1993,366(6456):704-707.
[16]Molofsky AV,He S,Bydon M,Morrison SJ,Pardal R.Bmi-1 promotes neural stem cell selfrenewal and neural development but not mouse growth and survival by repressing the p16Ink4a and p19Arf senescence pathways[J].Genes Dev,2005,19(12):1432-1437.
[17]Li WZ,Li WP,Zhang W,Yin YY,Sun XX,Zhou SS,et al.Protective effect of extract ofAstragaluson learning and memory impairments and neurons′apoptosis induced by glucocorticoids in 12-month-old male mice[J].Anat Rec(Hoboken),2011,294(6):1003-1014.
Osthole delays neural stem cells senescence induced by tert-butylhydroperoxide
YAO Ying-jia1,KONG Liang1,JIAO Ya-nan1,LI Shao-heng1,TAO Zhen-yu1,YAN Yu-hui1,YANG Jing-xian2
(1.Graduate School,2.Department of Pharmacology,Liaoning University of Traditional Chinese Medicine,Dalian 116600,China)
OBJECTlVETo investigate the effect of osthole(Ost)on retardation of neural stem cells(NSCs)senescence induced by tert-butyl hydroperoxide(t-BHP)and to study the related mechanismin vitro.METHODSNSCs were cultured until the 3rd generation in proliferation mediumin vitroand used for subsequent experiments.t-BHP 50,100 and 150 μmol·L-1was incubated with NSCs for 1,2 and 3 h,and the viability of NSCs was determined using CCK-8 assay.Then,Ost 50,100 and 150 μmol·L-1was added for 1,2 and 3 h to choose the suitable concentration of Ost used in the following experiments.The ability of proliferation of NSCs was tested by Ki67 staining and differentiation by immune staining.Assay for aging cells was measured by senescence β-galactosidas(Sa-β-gal)stainingkit.Then,the mRNA expression ofp53,p21,p19andp16gene was detected by RT-PCR,and the expression of P16,cyclinD1 and pRb proteins was detemined by Western blotting.RESULTSThe CCK-8 assay results showed the optimum condition of t-BHP for the NSCs aging model was 100 μmol·L-1for 2 h,and the survival rate with Ost treatment increased significantly(P<0.01).The Ki67 positive rate significantly decreased(P<0.05),the ability of proliferation into astrocytes,neurons and oligodendrocytes also decreased(P<0.05),but Sa-β-gal staining revealed that percentage of aging NSCs increased(P<0.01)in model group compared with control group.The Ki67 positive rate significantly increased(P<0.05),the ability of proliferation into astrocytes,neurons and oligodendrocytes also increased(P<0.05),and Sa-β-gal staining revealed the decreasing percentage of aging NSCs(P<0.01)in Ost group compared with model group.The results of RT-PCR showed that the expression ofp16andp53mRNA levels decreased in Ost group compared with t-BHP group(P<0.05).The expression ofp19andp21mRNA was not significantly different between model group and Ost group. The results of Western boltting showed that the expression of P16 protein decreased,while cyclinD1 and pRb protein increased in Ost group,respectively,compared with modelgroup(P<0.05).CONCLUSIONOst may delay the aging of NSCs induced by t-BHP,which may be related to inhibition of the activation of P16-pRb signaling pathway.
neural stem cells;osthole;proliferation;differentiation;senescence
The project supported by National Natural Science Foundation of China(81173580);National Natural Science Foundation of International Cooperation and Exchange Projects(81210108050);and Liaoning Province Higher Talents to Support Projects(5 group,No.191)
YANG Jing-xian,E-mail:1980483684@qq.com
R285.5
A
1000-3002(2015)04-0565-08
2014-12-04接受日期:2015-07-21)
(本文编辑:齐春会)
国家自然科学基金(81173580);国家自然科学基金国际合作交流项目(81210108050);辽宁省高等学校优秀人才支持计划项目(5组191号)
姚璎珈(1990-),女,硕士研究生,主要从事神经药理学研究。
杨静娴,E-mail:1980483684@qq.com

