辛二酰苯胺异羟肟酸诱导人卵巢癌细胞OC3自噬作用
赵岳,刘朝晖,张思,刘元林,周向东,王洋,童英,张毅
(1.河北北方学院研究生部,河北张家口075000;2.空军总医院妇产科,北京100142;3.军事医学科学院基础医学研究所细胞生物学研究室,北京100850;4.大兴妇幼保健院,北京102600)
辛二酰苯胺异羟肟酸诱导人卵巢癌细胞OC3自噬作用
赵岳1,刘朝晖4,张思2,刘元林3,周向东2,王洋3,童英2,张毅3
(1.河北北方学院研究生部,河北张家口075000;2.空军总医院妇产科,北京100142;3.军事医学科学院基础医学研究所细胞生物学研究室,北京100850;4.大兴妇幼保健院,北京102600)
目的探讨辛二酰苯胺异羟肟酸(SAHA)是否诱导人卵巢癌细胞OC3发生自噬。方法SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1处理OC3细胞24 h后,倒置显微镜吉姆萨和-瑞氏染色观察细胞形态变化;四甲基偶氮唑蓝(MTT)法检测细胞存活;流式细胞术检测自噬微管相关蛋白轻链3B(LC3B)的表达;AO/EB双染色观察红色酸性自噬囊泡的出现;电镜直接观察自噬囊泡的结构。结果不同浓度SAHA处理后,OC3细胞形态呈不规则梭形或多角形,细胞空泡化增多,折光性差。MTT结果表明,不同浓度SAHA处理对OC3细胞的存活具有明显的抑制作用,并存在时间和浓度效应关系,浓度相关系数分别为r12h= 0.898,r24h=0.976和r48h=0.952(P<0.05),SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1时,时间相关系数分别为0.999,0.654,0.999,0.869和0.922(P<0.05)。SAHA与OC3细胞作用24 h后,AO/EB双染色可见红色酸性自噬囊泡出现;进一步电镜观察,可观察到自噬囊泡结构;流式细胞术检测结果表明,与正常对照组相比,SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1处理OC3细胞24 h后,LC3B阳性细胞比率显著升高,分别为(19.4±2.4)%,(28.5±3.4)%,(34.6±3.9)%,(38.6±3.2)%和(61.8±1.0)%(P<0.05)。结论SAHA可能通过诱导人卵巢癌细胞OC3发生自噬而杀伤肿瘤细胞。
辛二酰苯胺异羟肟酸;卵巢肿瘤;自噬
DOl:10.3867/j.issn.1000-3002.2015.04.009
辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)是现今最具代表性的组蛋白去乙酰化酶抑制剂(HDAC inhibitor,HDACI)之一,并已成为第一个获准的HDACI类药物应用于临床肿瘤治疗[1]。研究表明,HDACI具有抑制肿瘤细胞生长、诱导细胞分化,促进细胞凋亡等作用[2-3]。自噬作用是杀伤肿瘤细胞的一个重要方式,诱导肿瘤细胞的自噬作用是目前肿瘤治疗的研究热点[4]。
我们前期的研究表明,SAHA对卵巢癌耐药细胞具有抑制增殖、引发自噬和诱导凋亡的作用[5-6],但SAHA是否对卵巢癌敏感细胞具有同样的作用,目前研究甚少,为此,本研究拟通过探讨SAHA对人卵巢癌细胞系OC3诱导自噬作用,为卵巢癌治疗提供新的实验依据。
1 材料与方法
1.1 细胞、药物、试剂和主要仪器
人卵巢上皮癌细胞株OC3,由北京世纪坛医院妇产科李红霞惠赠。SAHA购自美国Selleck公司;胎牛血清购自奥地利PAA Labo-ratories GmbH公司;RPMI 1640培养基购自美国Gibco公司;青霉素与链霉素,购自华北制药股份有限公司;胰蛋白酶和四甲基偶氮唑蓝(MTT)购自美国Sigma公司;瑞士-吉姆萨复合染色液购自上海远慕生物有限技术公司;吖啶橙/溴化乙锭(AO/EB)双荧光染色试剂盒购自北京索莱宝科技有限公司;自噬微管相关蛋白轻链3B抗体(light chain 3B,LC3B)购自美国Abcam公司;羊抗鼠二抗购自美国SANTACRUZ公司。SC-3610型低速离心机,科大创新股份有限公司中佳分公司;IX71-A12FL/PH型倒置荧光显微镜,日本Olympus公司;H-7650型透射电镜为日本日立公司;FC500Mcl型流式细胞仪,美国BeckmanCoulter公司;Immunoskan 340型酶标仪,英国BDSL公司。
1.2 细胞培养
人卵巢癌OC3细胞采用常规培养。含10%胎牛血清的RPMI 1640培养基(含1%青霉素和链霉素),置于37℃,5%CO2细胞培养箱中培养,取对数生长期细胞进行相关实验。
1.3 细胞分组、显微镜观察及瑞氏-吉姆萨染色形态观察
取对数生长期OC3细胞,分成6组。正常对照组(1640培养基),SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1。SAHA与OC3细胞孵育24 h后,倒置显微镜下观察细胞形态变化并拍照,弃上清,PBS洗2遍,4%多聚甲醛固定15 min后,PBS再洗2次,瑞氏-吉姆萨染色,观察细胞形态变化。
1.4 MTT法检测OC3细胞的存活
取对数生长期OC3细胞,以每孔1.0×104个细胞接种于96孔培养板,按照1.3所述实验分组,SAHA与OC3细胞分别作用12,24,48和72 h后,弃原培养基,每孔加入100 μL MTT(0.5 g·L-1)工作液,置37℃,5%CO2培养箱中孵育4~6 h,弃MTT工作液,每孔加100 μL DMSO,振荡器震荡10 min,结晶充分溶解,在492 nm波长处读取吸光度(A492nm)值。细胞抑制率(%)=(1-实验组A492nm/正常对照组A492nm)×100%。每样本3复孔,实验重复3遍。
1.5 流式细胞术检测OC3细胞自噬相关蛋白LC3B的表达
取对数生长期OC3细胞,按照1.3所述实验分组,SAHA与OC3细胞作用24 h后,收集细胞,1000×g离心5 min;PBS洗2次,每次1000×g离心10 min;细胞破膜处理,4℃摇床30 min,破膜缓冲液洗2次,每次1000×g离心10 min;按1∶1000稀释度加入LC3B一抗,室温避光孵育15 min,破膜缓冲液洗2次,每次1000×g离心10 min;按1∶1000稀释度加入FITC标记羊抗鼠二抗,室温孵育15 min,破膜缓冲液洗2次,每次1000×g离心10 min;500 μL PBS重悬细胞,流式细胞仪检测LC3B蛋白表达水平。
1.6 AO/EB双染色观察OC3细胞自噬囊泡
取对数生长期细胞,以每孔2.0×104个细胞接种于24孔培养板,按照1.3所述实验分组,SAHA分别与OC3细胞作用24 h后,弃掉原培养基,PBS洗2次,加入AO/EB工作液(终浓度1 mg·L-1)室温下孵育5~10 min,PBS洗2次,荧光显微镜下观察自噬囊泡的产生。
1.7 透射电镜观察OC3细胞自噬囊泡的结构
取对数生长期OC3细胞,按照1.3所述实验分组,SAHA分别与OC3细胞作用24 h后,收细胞,PBS洗2次,1000×g离心5 min,加3%戊二醛固定,包埋、切片、染色,透射电镜观察自噬囊泡的结构并拍照。
1.8 统计学分析
2 结果
2.1 SAHA对OC3细胞形态的影响
倒置显微镜观察显示,与正常对照组(图1A)相比,SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1处理OC3细胞24 h后,SAHA组OC3细胞形态出现不规则梭形或多角形、细胞空泡化增多、折光性差和密度降低等现象(图1B,C,D,E和F)。

Fig.1 Effect of suberoylanilide hydroxamic acid(SAHA)on morphological changes in ovarian cancer OC3 cells observed under an inverted microscope.A:normal control group;B,C,D,E and F:SAHA 0.05,0.25,1.25,6.25 and 31.25 μmol·L-1for 24 h,respectively.
吉姆萨-瑞氏染色结果表明,与正常对照组(图2A)相比,随着SAHA浓度升高,OC3细胞空泡化增多、核碎裂现象逐渐严重(图2B,C,D,E和F)。提示SAHA对卵巢癌OC3细胞具有一定杀伤作用。

Fig.2 Effect of SAHA on nucleus morphological changes in OC3 cells(Giemsa-Wright staining).A: normal control group;B,C,D,E and F:SAHA 0.05,0.25,1.25, 6.25 and 31.25 μmol·L-1for 24 h,respectively.Arrows show nuclear fragmentation.
2.2 SAHA抑制OC3细胞的存活
SAHA在0.05~31.25 μmol·L-1浓度范围内对OC3细胞的存活具有明显的抑制作用,且呈浓度依赖关系(图3)。随着SAHA作用时间的延长,对OC3细胞存活的抑制作用也逐渐增强。浓度效应相关系数分别为r12h=0.898,r24h=0.976和r48h= 0.952(P<0.05);SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1的时间相关系数r值分别为0.999,0.654,0.999,0.869和0.922(P<0.05),提示SAHA可显著抑制OC3细胞的存活。

Fig.3 Effect of SAHA on survival of OC3 cells tested by MTT assay.Inhibitory rate(%)=of SAHA group/of normal control group)×100%.
2.3 SAHA对OC3细胞LC3B表达的影响
流式细胞仪检测结果显示,正常对照组LC3B阳性细胞百分率为(13.0±3.5)%(图4A),SAHA 0.05,0.25,1.25,6.25和31.25 μmol·L-1处理细胞后,LC3B阳性细胞百分率分别为(19.4±2.4)%,(28.5±3.4)%,(34.6±3.9)%,(38.6±3.2)%和(61.8±1.0)%(图4B,C,D,E,F),与正常对照组相比差异均具有统计学意义(P<0.05)。提示SAHA可能诱导OC3细胞发生自噬。

Fig.4 Effect of SAHA on light chain 3B(LC3B)expression by flow cytometry.A:normal control group;B,C,D,E and F:SAHA 0.05,0.25,1.25,6.25 and 31.25 μmol·L-1for 24 h,respectively.
2.4 SAHA对OC3细胞产生自噬囊泡的影响
2..4.1 AO/EB双染色
倒置荧光显微镜观察结果显示,正常对照组(图5A)细胞着色均匀一致,核染色质着绿色并呈正常结构,SAHA处理24 h后,OC3活细胞密度减小,出现红色酸性自噬囊泡(图5B,C,D,E和F),提示SAHA可能引发OC3细胞发生自噬。
2.4.2 电镜观察
电镜观察结果显示,正常对照组(图6A)细胞没有自噬囊泡的产生,SAHA各组细胞内出现包含未消化细胞器的双层膜结构,即自噬囊泡(图6B, C,D,E和F),说明SAHA可引发OC3细胞发生自噬。

Fig.5 Effect of SAHA on autophagy of OC3 cells detected with fluorescence microscopy(AO/EB staining). A:normal control group;B,C,D,E and F:SAHA 0.05,0.25,1.25,6.25 and 31.25 μmol·L-1for 24 h,respectively.Arrows show autophagic cells.
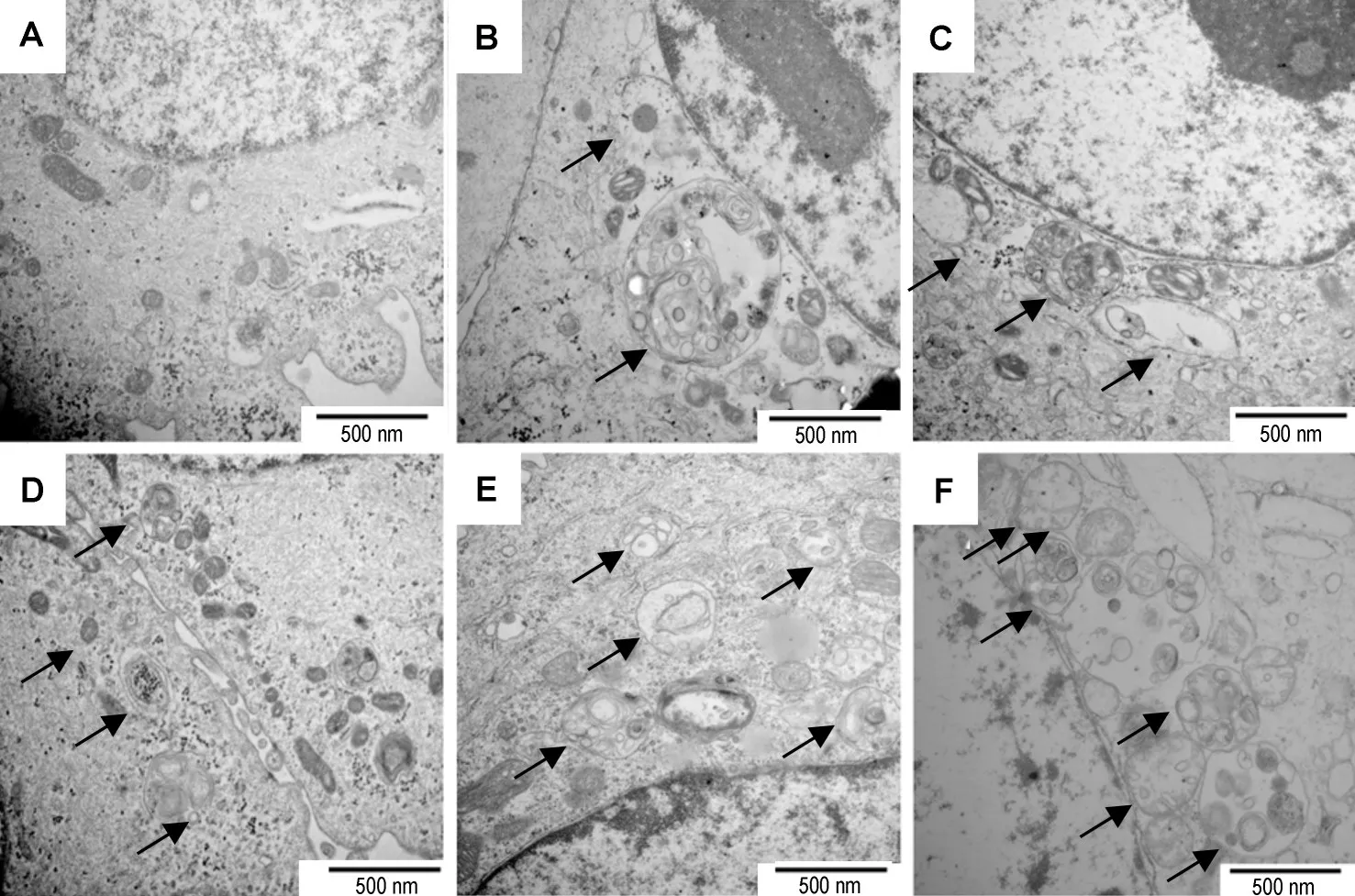
Fig.6 Effect of SAHA on autophagy of OC3 cells observed by transmission electron microscopy.A:normal control group;B,C,D,E and F:SAHA 0.05,0.25,1.25,6.25 and 31.25 μmol·L-1for 24 h,respectively.Arrows show autophagic vacuoles.
3 讨论
本研究发现,SAHA可使OC3细胞形态发生明显改变,细胞空泡化增多,折光性差,活细胞数目明显减少,电镜下可见自噬囊泡比例随SAHA浓度增加而增多,提示SAHA可能对OC3细胞具有一定杀伤效应。随着SAHA浓度的增加和作用时间的延长,其对OC3细胞的存活具有显著的抑制作用。流式细胞仪检测到自噬相关蛋白LC3B随SAHA浓度增加,在OC3细胞中的阳性表达率也相应增加。上述结果提示,SAHA对卵巢癌敏感细胞株OC3细胞的存活具有抑制作用。
HDACI具有诱导肿瘤细胞自噬、凋亡、阻滞细胞周期和抑制血管新生等诸多作用,是国内外肿瘤治疗的关注焦点。同时HDACI还可与许多化疗药物联用,起到增敏、协同抑制肿瘤生长等作用[7-10],因此有望成为肿瘤治疗的新靶点。研究发现,SAHA作为HDACI类药物之一,可调节乳腺癌MCF-7细胞的周期蛋白A2及周期蛋白D1起到显著抑制细胞增殖作用[11];同时SAHA还具有增强乳腺癌分化特征标志物表达,从而诱导乳腺癌细胞向正常细胞分化作用[12];另外,SAHA通过上调p21和Bax基因介导卵巢癌SKOV3细胞凋亡,还可下调成胶质细胞瘤干细胞中AKT-MTOR信号来触发自噬[13-15]。有学者研究发现,SAHA对卵巢癌部分敏感细胞具有抑制增殖和诱导凋亡的作用[16]。
本研究发现,SAHA对OC3细胞具有抑制作用,表明SAHA可能通过诱导细胞自噬发挥杀伤肿瘤作用。但SAHA如何诱导OC3细胞发生自噬及其作用机制目前尚不清楚,有待深入研究。
[1]Mann BS,Johnson JR,Cohen MH,Justice R,Pazdur R.FDA approval summary:vorinostat for treatment of advanced primary cutaneous T-cell lymphoma [J].Oncologist,2007,12(10):1247-1252.
[2]Lane AA,Chabner BA.Histone deacetylase inhibitors in cancer therapy[J].J Clin Oncol,2009,27(32): 5459-5468.
[3]Kim HJ,Bae SC.Histone deacetylase inhibitors:molecular mechanisms of action and clinical trials as anticancer drugs[J].Am J Transl Res,2011,3(2):166-179.
[4]Shi Z,Li CY,Zhao S,Yu Y,An N,Liu YX,et al.A systems biology analysis of autophagy in cancer therapy[J].Cancer Lett,2013,337(2):149-160.
[5]Chen MY,Liao WS,Lu Z,Bornmann WG,Hennessey V, Washington MN,et al.Decitabine and suberoylanilide hydroxamic acid(SAHA)inhibit growth of ovarian cancer cell lines and xenografts while inducing expression of imprinted tumor suppressor genes, apoptosis,G2/M arrest,and autophagy[J].Cancer,2011,117(19):4424-4438.
[6]Liu ZH,Liu YX,Li JF,Zhao Y,Liu YL,Tong Y,et al. Effect of suberoylanilide hydroxamic acid on survival and apoptosis of human paclitaxel-resistant ovarian cancer OC3/P cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(6):966-970.
[7]Park SJ,Kim MJ,Kim HB,Sohn HY,Bae JH,Kang CD,et al.Trichostatin A sensitizes human ovarian cancer cells to TRAIL-induced apoptosis by downregulation of c-FLIPL via inhibition of EGFR pathway [J].Biochem Pharmacol,2009,77(8):1328-1336.
[8]Kwon HJ,Kim MS,Kim MJ,Nakajima H,Kim KW. Histone deacetylase inhibitor FK228 inhibits tumor angiogenesis[J].Int J Cancer,2002,97(3):290-296.
[9]Cao Q,Yu C,Xue R,Hsueh W,Pan P,Chen Z,et al. Autophagy induced by suberoylanilide hydroxamic acid in Hela S3 cells involves inhibition of protein kinase B and up-regulation of Beclin 1[J].Int J Biochem Cell Biol,2008,40(2):272-283.
[10]Lee CK,Wang S,Huang X,Ryder J,Liu B.HDAC inhibition synergistically enhances alkylator-induced DNA damage responses and apoptosis in multiple myeloma cells[J].Cancer Lett,2010,296(2):233-240.
[11]Nie JY,Chen YP,Huang YC.Effect of histone deacetylase inhibitor SAHA on breast cancer cell in animal mode[J].Pract J Cancer(实用癌症杂志), 2011,26(3):221-225.
[12]Munster PN,Troso-Sandoval T,Rosen N,Rifkind R, Marks PA,Richon VM.The histone deacetylase inhibitor suberoylanilide hydroxamic acid induces differentiationofhumanbreastcancercells[J].Cancer Res,2001,61(23):8492-8497.
[13]Al-Hassan NN,Behzadian A,Caldwell R,Ivanova VS, Syed V,Motamed K,et al.Differential roles of uPARinperitonealovariancarcinomatosis[J].Neoplasia,2012,14(4):259-270.
[14]Chiao MT,Cheng WY,Yang YC,Shen CC,Ko JL. Suberoylanilide hydroxamic acid(SAHA)causes tumor growth slowdown and triggers autophagy in glioblastoma stem cells[J].Autophagy,2013,9(10):1509-1526.
[15]Dietrich CS 3rd,Greenberg VL,DeSimone CP,Modesitt SC,van Nagell JR,Craven R,et al.Suberoylanilide hydroxamic acid(SAHA)potentiates paclitaxel-induced apoptosis in ovarian cancer cell lines [J].Gynecol Oncol,2010,116(1):126-130.
[16]Liu Z,Tong Y,Liu Y,Liu H,Li C,Zhao Y,et al. Effects of suberoylanilide hydroxamic acid(SAHA)combined with paclitaxel(PTX)on paclitaxel-resistant ovarian cancer cells and insights into the underlying mechanisms[J].Cancer Cell Int,2014,14(1): 112-123.
Effect of suberoylanilide hydroxamic acid on autophagy of human ovarian cancer OC3 cells
ZHAO Yue1,LIU Zhao-hui4,ZHANG Si2,LIU Yuan-lin3,ZHOU Xiang-dong2,WANG Yang3, TONG Ying2,ZHANG Yi3
(1.Graduate School,Hebei North College,Zhangjiakou 07500,China;2.Department of Obstetrics and Gynecology,Air Force General Hospital,Beijing 100142,China;3.Department of Cell Biology,Institute of Basic Medical Sciences,Academy of Military Medical Sciences,Beijing 100850,China;4.Department of Obstetrics and Gynecology,Daxing Maternal-Child Health Hospital,Beijing 102600,China)
OBJECTlVETo evaluate the effect of suberoylanilide hydroxamic acid(SAHA)on autophagy of human ovarian cancer OC3 cells.METHODSOC3 cells were treated with SAHA 0.05,0.25,1.25,6.25 and 31.215 μmol·L-1for 24 h,and then stained by Giemsa-Wright′s.The morphological changes of OC3 cells were observed under an inverted microscope and cell proliferation was detected by MTT assay.The autophagy related proteins were analyzed by flow cytometry.The cell ultrastructure changes were identified by transmission electron microscopy and autophagic vacuoles of OC3 cells were observed by AO/EB double staining.RESULTSAfter treatment with SAHA 0.05-31.25 μmol·L-1, the morphology of OC3 cells became irregularly spindle-shaped with more vacuolization and less refraction.The activity and proliferation of OC3 cells were significantly decreased in a time-dependent and SAHA concentration dependent manner by MTT assay.Concentration-dependent correlation coefficients werer12h=0.898,r24h=0.976 andr48h=0.952(P<0.05),respectively.SAHA time correlation coefficients were 0.999,0.654,0.999,0.869 and 0.922(P<0.05),respectively.Using AO/EB double staining, the amount of acidic autophagic vacuoles was augmented.With transmission electron microscopy,the structure of autophagic vacuoles could be seen clearly.Flow cytometry results showed that the positive rate of LC3B cells was significantly increased in SAHA 0.05-31.25 μmol·L-1,which was(19.4±2.4)%,(28.5±3.4)%,(34.6±3.9)%,(38.6±3.2)%,and(61.8±1.0)%,respectively.CONCLUSlONSAHA can inhibit and kill human ovarian cancer cells OC3 by inducing autophagy.
suberoylanilide hydroxamic acid;ovarian neoplasms;autophagy
The project supported by National Natural Science Foundation of China(31070996);and National Natural Science Foundation of China(31171084)
s:TONG Ying,Tel:(010)66926371,E-mail:tongying7326@sina.com;ZHANG Yi,Tel:(010)66930315,E-mail:zhangyi612@hotmail.com
R979.3
A
1000-3002(2015)04-0585-06
2015-02-02接受日期:2015-07-31)
(本文编辑:贺云霞)
国家自然科学基金(31070996);国家自然科学基金(31171084)
赵岳(1983-),女,硕士研究生,主要从事卵巢癌化疗研究,E-mail:rainheart2489@126.com;张毅(1966-),女,研究员,博士生导师,主要从事细胞生物学研究。
童英,E-mail:tongying7326@sina.com;Tel:(010)66926371;张毅,E-mail:zhangyi612@hotmail.com,Tel:(010)66930315

