新型孕激素衍生物3α-羟基-3β-甲氧基甲基-16,17-亚甲基-孕甾-20-酮对硝普钠损伤PC12细胞的保护作用
刘 玲,李瑞芳,段冷昕,何 玲
(1.河南科技大学医学院药学系,河南洛阳471003;2.中国药科大学药理学教研室,江苏南京210009)
新型孕激素衍生物3α-羟基-3β-甲氧基甲基-16,17-亚甲基-孕甾-20-酮对硝普钠损伤PC12细胞的保护作用
刘 玲1,李瑞芳1,段冷昕1,何 玲2
(1.河南科技大学医学院药学系,河南洛阳471003;2.中国药科大学药理学教研室,江苏南京210009)
目的探讨新型孕激素衍生物3α-羟基-3β-甲氧基甲基-16,17-亚甲基-孕甾-20-酮(CPU)对硝普钠(SNP)诱导的PC12细胞损伤的神经保护作用及其机制。方法用终浓度为0.01,0.10,1.00 μmol·L-1的CPU预处理30 min,然后加入SNP共同作用24 h。采用MTT法检测细胞存活率,分光光度计法检测乳酸脱氢酶(LDH)漏出率、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的变化;流式细胞仪检测活性氧(ROS)、线粒体膜电位和细胞凋亡率;Western蛋白质印迹法检测Bcl-2、Bax和活化的胱天蛋白酶3蛋白表达水平。结果与细胞对照组比较,SNP模型组PC12细胞的存活率显著降低,LDH的释放明显增加(P<0.01),MDA生成增多,SOD活性降低,ROS水平升高,线粒体膜电位水平降低,细胞凋亡率由细胞对照组(1.20±0.14)%增加至(55.52±3.56)%(P<0.01);Bcl-2蛋白表达降低,而Bax表达升高,Bax/Bcl-2比值升高,同时胱天蛋白酶3被激活(P<0.01)。与模型组比较,CPU 0.01,0.10和1.00 μmol·L-1作用24 h后,细胞存活率显著升高,LDH的释放减少(P<0.01),MDA的生成量减少,SOD活性增加,ROS累积减少,线粒体膜电位水平升高(P<0.01);凋亡细胞分别降至(37.79±4.85)%,(22.31±4.25)%和(10.39± 2.65)%;Bcl-2蛋白表达增加,Bax和活化的胱天蛋白酶3表达降低。结论CPU对SNP所致损伤的PC12细胞有一定的保护作用,其作用机制可能与其抗氧化和抗凋亡作用有关。
神经甾体;神经保护;细胞凋亡;硝普钠
DOl:10.3867/j.issn.1000-3002.2015.04.003
脑卒中是一种以微循环血流量下降及葡萄糖和能量代谢障碍为主要特征的老年性疾病,氧化损伤在神经毒性机制研究中占有重要地位。神经活性甾体是指神经组织中具有活性的所有甾体激素,包括神经甾体和外周内分泌腺分泌的甾体激素,如孕烯醇酮及其硫酸盐、孕酮、别孕烯醇酮和脱氢表雄酮等[1-2]。神经甾体、其代谢物以及它们的合成类似物具有麻醉、催眠、抗癫痫、扰焦虑、保护神经细胞、促进学习记忆和改善认知能力等作用[3-4]。以神经甾体激素为靶点的新药研究多集中在以下两个方面:①以神经类固醇母核为基础开发出结构类似、口服吸收更好、生物利用度更高的神经类固醇类化合物;②选择性地影响体内神经类固醇合成、代谢及转化酶活性的药物,可以纠正神经类固醇的失调、恢复机体的稳态平衡,又可避免直接应用类固醇激素所产生的副作用。3α-羟基-3β-甲氧基甲基-16,17-亚甲基-孕甾-20-酮(3α-hydroxy-3β-methoxymethyl-16,17-methylene-pregna-20-keto,CPU)是以神经类固醇母核为基础开发的一种新型孕激素衍生物(图1)。研究表明,氧化应激在多种病理生理过程中发挥着重要的作用,如心血管疾病、肿瘤、神经系统疾病等。而一氧化氮(nitric oxide,NO)可与氧分子相互作用生成活性氮族(reactive nitrogen species,RNS),包括二氧化氮(NO2)、三氧化二氮(N2O3)和四氧化二氮(N2O4),RNS可与蛋白通过氧化作用引起组织损伤;NO可与超氧阴离子结合形成过氧亚硝酸盐(ONOO-),诱导DNA损伤、脂质过氧化、蛋白降解和通过半胱氨酸残基的S-亚硝酰化作用,导致细胞损伤甚至死亡;ONOO-还可与H+形成ONOOH,继而迅速分解成许多毒性代谢产物如羟自由基(OH-)等[5-6]。超氧阴离子、H2O2和OH-统称为活性氧(reactive oxygen species,ROS)。RNS和ROS均可造成细胞毒性。研究表明,硝普钠(sodium nitroprusside,SNP)在体外细胞实验模型中可释放出NO,引起神经细胞损伤[7-8]。前期研究显示,CPU对Aβ25-35和H2O2损伤模型均有一定的保护作用[9]。研究表明,中枢神经系统疾病的发病机制与炎症介质释放、氧化应激水平过高均有一定的关系[10]。神经损伤的病理状态下,大量ROS的产生可以促进多种炎症介质的表达;而在神经损伤后期,神经元型NO合酶(neuronal nitric oxide synthase,nNOS)和诱导型NOS (inducible NOS,iNOS)可产生高浓度NO,进一步加剧神经细胞的氧化损伤[11]。因此,本研究通过SNP所致PC12细胞损伤模型,观察CPU对神经炎症损伤中氧化应激和凋亡作用的影响。
1 材料与方法
1.1 药物、细胞和试剂
CPU为孕激素衍生物(相对分子质量374.57)由中国药科大学向华副教授提供,纯度>90%,溶于二甲亚砜(DMSO)配制成100 mmol·L-1的母液,用时加PBS稀释至所需浓度。
PC12细胞株购自上海细胞生物学研究所。SNP注射液(130502,北京双鹤现代医药技术有限责任公司);胰蛋白酶、DMEM培养基、小牛血清和四甲基偶氮唑盐(MTT)(美国Gibco公司);AnnexinⅤ-FITC凋亡检测试剂盒(美国BD公司);乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(均南京建成生物工程研究所);ROS以及JC-1线粒体膜电位检测试剂盒、细胞裂解液和BCA蛋白含量检测试剂盒(均碧云天生物技术研究所);ECL检测试剂盒(南京凯基生物技术有限公司);Bax、Bcl-2、活化胱天蛋白酶3、β肌动蛋白和辣根过氧化物酶标记的羊抗兔IgG抗体(二抗)购于美国Bioworld公司。其余试剂均为市售分析纯。
1.2 仪器
SW-CJ-2J洁净工作台,苏州安泰空气技术有限公司;二氧化碳培养箱,美国Thermo Electron公司;SH-1000 Lab全波长酶标仪,日本日立公司;BD FACSCanto流式细胞仪,美国BD公司。DYY-11B型三恒电泳仪和DYCP-31DN型电泳仪,均北京市六一仪器厂;Clinx ChemiScope2850荧光及化学发光成像系统,上海勤翔科学仪器有限公司。
1.3 细胞培养
PC12细胞复苏后接种于培养瓶中,加入含10%小牛血清的DMEM培养液,置于37℃,5% CO2,饱和湿度条件下培养,2~3 d换液1次。待细胞长满瓶底后,倾去培养液,用D-Hanks液轻轻荡洗2次,加入适量的0.25%胰蛋白酶溶液,37℃消化3~5 min后加入含10%小牛血清的DMEM培养液终止消化,用吸管轻轻吹打数次,使细胞分散成单细胞悬液,按5×108L-1的密度,每孔200 μL传代随机接种于预先用明胶处理过的96孔培养板上培养。
1.4 实验分组
参照文献[8]建立SNP损伤模型。实验分为空白对照组、SNP 100 μmol·L-1模型组及CPU 0.01,0.10和1.00 μmol·L-1+SNP组。每组6孔,每孔200 μL,待细胞贴壁并进入对数生长期后,按分组分别换液,培养24 h。CPU预处理30 min后加入SNP共同作用24 h。
1.5 MTT法检测细胞存活率
取1.4处理的细胞,每孔加入20 μL MTT 5 g·L-1,置于培养箱中继续孵育4 h后,吸弃孔内上清液,每孔加入DMSO 150 μL,振摇10 min,使结晶充分溶解。用酶标仪在波长为570 nm处测定每孔的吸光度(absorbance,A570nm)值,记录结果并计算PC12细胞的存活率。存活率(%)=(给药组A570nm/细胞对照组A570nm)×100%。
1.6 比色法检测LDH,MDA和SOD水平
收集对数期细胞,用胰酶将细胞制成2×108L-1悬液,置于6孔培养板内。按照1.4处理细胞。24 h后取细胞上清液,按LDH测定试剂盒说明书操作,比色法于450 nm处测定A并计算LDH释放量。
收集经药物处理后的细胞,并悬浮于0℃生理盐水,冰浴中用超声细胞破碎仪完全破碎细胞(20 kHz,2 min),显微镜下观察无细胞后分别取一定量的细胞悬液,按MDA及SOD测定试剂盒说明书操作,测定其A并计算活性。BCA法定量蛋白。
1.7 流式细胞仪检测ROS水平
取1.4处理的细胞,按照1∶1000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol·L-1。加入适当体积稀释好的DCFH-DA。37℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。用流式细胞仪检测细胞的平均荧光强度,表示细胞内的ROS水平。
1.8 流式细胞仪检测线粒体膜电位水平
收集对数期细胞,用胰酶将细胞制成2×108L-1悬液,置于6孔培养板内,细胞贴壁后给药。PBS洗涤2次,4℃,352×g离心5 min,弃上清,重悬于3%DMEM培养基0.5 mL细胞培养液中。加入0.5 mL JC-1染色工作液,颠倒数次混匀。细胞培养箱中37℃孵育20 min。孵育结束后,4℃下600×g离心3~4 min,弃上清,用JC-1染色缓冲液洗涤2次后,用适量JC-1染色缓冲液重悬后,用流式细胞仪分析。JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针,JC-1聚集在线粒体的基质中,形成聚合物而产生红色荧光,在线粒体膜电位较低时,JC-1不能形成聚合物,以单体的形式存在,而产生绿色荧光。用红绿荧光的相对比例来衡量线粒体膜电位的变化程度。
1.9 流式细胞仪检测PC12细胞凋亡率
取处于对数生长期状态良好的细胞,加入0.25%胰蛋白酶消化,计数板计数,配成1.0×106L-1的细胞悬液后,接种于6孔板中,置恒温CO2培养箱中培养24 h。换用含3%血清的DMEM培养基,加入SNP和药物继续培养24 h。胰酶消化,收集细胞,PBS洗涤2次,4℃下352×g离心5 min,弃上清。加入500 μL的缓冲液悬浮细胞。加入5 μL AnnexinⅤ-FITC混匀后,加入5 μL碘化丙啶,混匀。室温下避光反应20 min。1 h内进行流式细胞仪的观察和检测。
1.10 Western蛋白印迹法检测凋亡相关蛋白表达水平
取1.4处理的细胞,收集细胞并用裂解液裂解细胞获得总蛋白。采用BCA试剂盒于562 nm处测定样品蛋白含量。然后,采用12%浓度的SDSPAGE分离总蛋白,蛋白质转移到PVDF膜,5%的脱脂奶粉室温封闭2 h。封闭过的膜用TBST洗涤3次。将膜放入杂交袋中,加入一抗4℃孵育过夜,使抗原抗体充分结合。隔天,将膜从杂交袋中取出,用TBST洗涤3次;再放入新杂交袋中,加入二抗体以结合一抗,室温孵育膜2 h。化学发光法检测,用凝胶成像系统拍照成像。以目的蛋白积分吸光度值与内参吸光度值的比值表示某样品的目的蛋白相对含量。
1.11 统计学分析
2 结果
2.1 CPU对SNP损伤PC12细胞存活率的影响
表1结果显示,与细胞对照组相比,SNP模型组的细胞存活率明显下降(P<0.01),为(40.8± 4.5)%。CPU 0.01,0.10和1.00 μmol·L-1能明显抑制SNP所致的PC12细胞损伤,存活率分别为(55.8±3.9)%,(66.6±5.0)%和(80.0±5.4)%。表明SNP可造成PC12细胞损伤,而CPU对SNP诱导的PC12细胞损伤有一定的抑制作用。

Tab.1 Effect of CPU on cell viability of PC12 cells treated with sodium nitroprusside(SNP)
2.2 CPU对SNP损伤PC12细胞LDH,MDA和SOD活性的影响
表2结果显示,与空白对照组相比,SNP模型组培养液内LDH的释放量增加了117%;同时,脂质过氧化物MDA生成显著增多而抗氧化酶SOD活性降低了46%;CPU 0.01,0.10和1.00 μmol·L-1对LDH的释放量分别减少了16%,39%和50%;MDA的生成量分别减少了31%,60%和83%;SOD活性分别增加了9%,24%和46%。表明CPU可减轻SNP造成的PC12细胞氧化应激损伤。
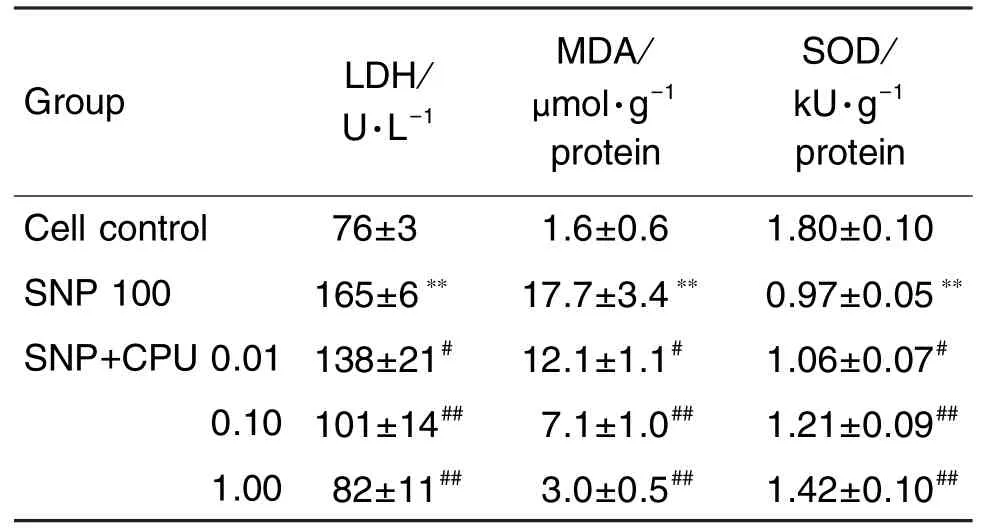
Tab.2 Effect of CPU on lactate dehydrogenase (LDH),malondialdehyde(MDA)and superoxide dismutase(SOD)in PC12 cells treated with SNP
2.3 CPU对SNP损伤PC12细胞ROS水平的影响
表3结果显示,与细胞对照组相比,SNP模型组中ROS的平均荧光强度水平明显升高了383% (P<0.01);加入CPU 0.01,0.10和1.00 μmol·L-1后,能明显减少ROS的累积,荧光强度分别降低了18%,44%和63%(P<0.01)。结果提示,CPU可减少SNP导致的PC12细胞损伤后所引起ROS累积。

Tab.3 Effect of CPU on reactive oxygen species (ROS)production of PC12 cells treated with SNP by flow cytometry
2.4 CPU对SNP损伤PC12细胞线粒体膜电位的影响
图2和表4结果显示,与细胞对照组相比,SNP模型组线粒体膜电位水平显著降低,红绿荧光比值显著下降(P<0.01);加入CPU 0.01,0.10和1.00 μmol·L-1后,线粒体膜电位水平逐渐升高,红绿荧光比值呈升高趋势(P<0.05,P<0.01)。结果提示,CPU可通过提高线粒体膜电位,从而减轻SNP所致PC12细胞的线粒体损伤。
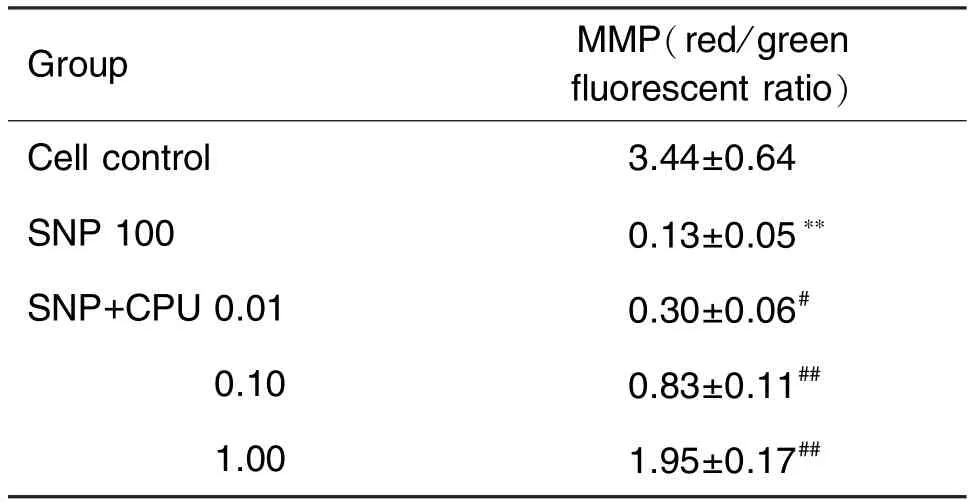
Tab.4 Effect of CPU on mitochondrial membrane potential of PC12 cells treated with SNP
2.5 CPU对SNP损伤PC12细胞凋亡的影响
图3和表5结果显示,与细胞对照组凋亡细胞相比,SNP损伤模型组细胞凋亡率明显增加(P<0.01),加入CPU 0.01,0.10和1.00 μmol·L-1,细胞的凋亡率较SNP模型组明显降低(P<0.01),提示CPU对SNP诱导的PC12细胞凋亡有一定的抑制作用。
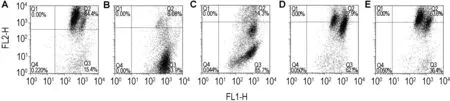
Fig.2 Effect of CPU on mitochondrial membrane potential(MMP)of PC12 cells treated with SNP.See Tab.1 for the treatment.A:cell control;B:SNP 100 μmol·L-1;C-E:CPU 0.01,0.10 and 1.00 μmol·L-1+SNP 100 μmol·L-1,respectively.
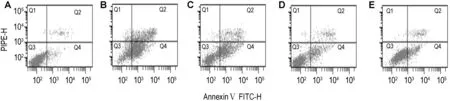
Fig.3 Effect of CPU on apoptosis of PC12 cells treated with SNP.See Tab.1 for the treatment.A:cell control;B:SNP 100 μmol·L-1;C-E:CPU 0.01,0.10 and 1.00 μmol·L-1+SNP 100 μmol·L-1,respectively.
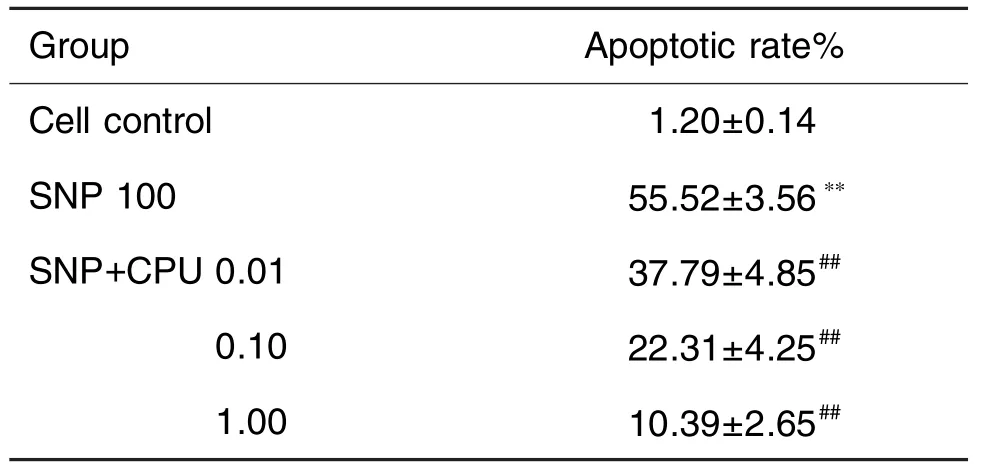
Tab.5 Effect of CPU on apoptosis rate of PC12 cells treated with SNP
2.6 CPU对PC12细胞SNP损伤蛋白表达的影响
图4结果显示,与细胞对照组相比,SNP模型组中Bcl-2蛋白表达降低,而Bax表达升高,Bax/Bcl-2比值由细胞对照组的0.27±0.07升高至1.36±0.18,同时胱天蛋白酶3被激活,蛋白表达由细胞对照组0.20±0.05升高至1.12±0.12;与SNP模型组相比,加入CPU 0.01,0.10和1.00 μmol·L-1后,可增加Bcl-2表达,减少Bax表达,Bax/Bcl-2比值分别降低至0.49±0.14,0.81±0.14和1.14± 0.15,胱天蛋白酶3蛋白表达降低至0.33±0.05,0.65±0.13和0.89±0.09。结果表明,CPU减轻SNP所致的PC12细胞损伤,可能与其抗凋亡有关。

Fig.4 Effect of CPU on expression of Bcl-2,Bax and cleaved-caspase-3 protein in PC12 cells by Western blotting.See Tab.1 for the treatment.B and C were the semiquantitative results of A.IA:integrated absorbance.Lane 1:cell control;lane 2:SNP group;lanes 3-5:SNP+CPU 1.00,0.10 and 0.01 μmo·lL-1groups.compared with cell control group;compared with SNP group.
3 讨论
本研究结果表明,SNP可造成PC12细胞氧化损伤以及诱导细胞凋亡,而新型孕激素衍生物CPU可显著升高细胞存活率,减少LDH释放和MDA生成,增加SOD活性,减少ROS累积,升高线粒体膜电位水平;使Bcl-2蛋白表达增加、Bax和活化的胱天蛋白酶3表达降低,从而降低细胞凋亡的发生。表明CPU对SNP所致的损伤有一定的保护作用。
SNP是NO的供体,可以在水溶液中快速释放出NO,直接造成PC12细胞损伤[12-13]。NO可与超氧阴离子自由基发生快速反应,生成强氧化性的过氧化亚硝基,导致神经细胞发生膜脂质过氧化,蛋白质氧化及DNA损伤[14]。细胞受损后使膜通透性提高,LDH和MDA等物质释放到胞浆中,进一步加剧了细胞的损伤。本研究中SNP 100 μmol·L-1可显著降低PC12细胞的存活率,增加LDH漏出率,引起MDA水平升高,而抗氧化酶SOD活性降低。上述结果表明,SNP增加了脂质过氧化物的生成,抑制抗氧化酶的活性,改变了氧化/抗氧化系统的平衡,引起了细胞存活率降低。CPU 0.01,0.10和1.00 μmol·L-1作用PC12细胞24 h后,可提高损伤细胞存活率,减少LDH漏出量和MDA的生成,提高SOD活性,提示CPU对PC12细胞SNP损伤模型的保护作用与其抗脂质过氧化作用、增加抗氧化酶活性有关。
ROS包括氧自由基、过氧化氢及下游产物氧化物等,参与细胞生长增殖、发育分化、衰老和凋亡以及许多生理和病理过程。NO可与超氧阴离子结合形成过氧亚硝酸盐(ONOO-),产生大量ROS,ROS爆发产生氧化应激,引起膜电位下降甚至消失,同时线粒体通透性转运孔开放,引起线粒体内容物如细胞色素c等因子释放,最终激活胱天蛋白酶3,诱导细胞凋亡的发生[15]。另外,在凋亡过程中,线粒体膜电位是细胞凋亡早期的一个重要指标,其下降预示细胞线粒体受到损伤;细胞内的Bax与Bcl-2比值决定了线粒体外膜孔道的形成,而胱天蛋白酶3直接参与了染色体凝聚和DNA片段化等过程,是细胞凋亡中的关键执行者[16]。SNP可增加PC12细胞内ROS水平,降低线粒体膜电位,升高Bax/Bcl-2比值,激活胱天蛋白酶3。上述结果表明,SNP可提高PC12细胞氧化应激水平,引起线粒体膜电位水平下降,破坏线粒体结构和功能,进一步产生大量的ROS,从而攻击DNA引起细胞损伤。另一方面,SNP通过降低抗凋亡蛋白Bcl-2表达,同时引起促凋亡蛋白Bax在线粒体上易位,最终激活胱天蛋白酶3启动凋亡级联反应。CPU可减少ROS累积,提高线粒体膜电位,降低Bax/Bcl-2比值,减少胱天蛋白酶3的活化,从而减少SNP损伤引起的细胞凋亡,提示CPU的保护作用可能是通过增强Bcl-2蛋白表达,抑制Bax蛋白表达,从而抑制Bax二聚体的形成,保护线粒体结构而发挥抗凋亡的作用。
综上所述,SNP对PC12细胞具有损伤作用,其损伤机制可能与细胞膜损伤、氧化应激水平升高、线粒体结构和功能紊乱,以及相关抗凋亡蛋白Bcl-2蛋白表达降低、促凋亡蛋白Bax和胱天蛋白酶3表达增高有关。新型孕激素衍生物CPU对上述SNP造成的损伤具有一定的保护作用,其作用机制可能与其抗氧化和抗凋亡有关。本研究为神经甾体及其代谢物进行结构修饰和构效关系的研究提供了一定的实验依据,以期找到作用专属性强、活性好、毒性低的化合物用于某些神经系统疾病,并有望在这方面取得更大的进展。
[1] Schüle C,Eser D,Baghai TC,Nothdurfter C,Kessler JS,Rupprecht R.Neuroactive steroids in affective disorders:target for novel antidepressant or anxiolytic drugs?[J].Neuroscience,2011,191:55-77.
[2] Bicíková M,Hampl R.Neurosteroids and their function[J].Cas Lek Cesk,2007,146(3):223-226.
[3] Schüle C,Nothdurfter C,Rupprecht R.The role of allopregnanolone in depression and anxiety[J].Prog Neurobiol,2014,113:79-87.
[4] Zhang LN,Hao L,Wang HY,Su HN,Sun YJ,Yang XY,et al.Neuroprotective effect of resveratrol against glutamate-induced excitotoxicity[J].Adv Clin Exp Med,2015,24(1):161-165.
[5] Savidge TC.Importance of NO and its related compounds in enteric nervous system regulation of gut homeostasis and disease susceptibility[J].Curr Opin Pharmacol,2014,19:54-60.
[6] Peña-Altamira E,Petazzi P,Contestabile A.Nitric oxide control of proliferation in nerve cells and in tumor cells of nervous origin[J].Curr Pharm Des,2010,16(4):440-450.
[7] Chen X,Deng A,Zhou H,Gu J.Neuroprotective effect of 2-(4-methoxyphenyl)ethyl-2-acetamido-2-deoxy-β-D-pyranoside againstsodiumnitroprusside-induced neurotoxicity in HT22 cells[J].Mol Cell Biochem,2013,383(1-2):149-159.
[8] Pandareesh MD,Anand T.Neuroprotective and anti-apoptoticpropensityofBacopamonnieraextract against sodium nitroprusside induced activation of iNOS,heat shock proteins and apoptotic markers in PC12 cells[J].Neurochem Res,2014,39(5):800-814.
[9] Liu L,He L,Xiang H.Protective effects of neurosteroids on PC12 damage[J].Shangdong Med J(山东医药),2010,30(10):1391-1393.
[10] Hsieh HL,Yang CM.Roleof redox signaling in neuroinflammation and neurodegenerative diseases[J].Biomed Res Int,2013,2013:484613.
[11] Peña-Altamira E,Petazzi P,Contestabile A.Nitric oxide control of proliferation in nerve cells and in tumor cells of nervous origin[J].Curr Pharm Des,2010,16(4):440-450.
[12] Bátor J,Varga J,Berta G,Barbakadze T,Mikeladze D,Ramsden J,et al.Sodium nitroprusside,a nitric oxide donor,fails to bypass the block of neuronal differentiation in PC12 cells imposed by a dominant negative Ras protein[J].Cell Mol Biol Lett,2012,17(3):323-332.
[13] Muñoz M,Bermejo-Bescós P,Romero C,Benedí J,Martín-Aragón S.SNP-mediated neuroprotection under glucose deprivation is enhanced byHypericum perforatum[J].CNS Neurol Disord Drug Targets,2012,11(2):162-173.
[14] Shiva S.Nitrite:a physiological store of nitric oxide and modulator of mitochondrial function[J].Redox Biol,2013,1(1):40-44.
[15] Kim SF.Theroleof nitric oxide in prostaglandin biology;update[J].Nitric Oxide,2011,25(3): 255-264.
[16] Zeng KW,Wang XM,Ko H,Yang HO.Neuroprotective effect of modified Wu-Zi-Yan-Zong granule,a traditional Chinese herbal medicine,on CoCl2-induced PC12 cells[J].J Ethnopharmacol,2010,130(1):13-18.
Protective effect of 3α-hydroxy-3β-methoxymethyl-16,17-methylenepregna-20-keto on PC12 cells injured by sodium nitroprusside
LIU Ling1,LI Rui-fang1,DUAN Leng-xin1,HE Ling2
(1.Department of Pharmacy,Henan University of Science and Technology,Luoyang471003,China;2.Department of Pharmacology,China Pharmaceutical University,Nanjing210009,China)
OBJECTlVETo investigate the protective effects of a novel progesterone derivative,3α-hydroxy-3β-methoxymethyl-16,17-methylene-pregna-20-keto(CPU),on PC12 cell damage models induced by sodium nitroprusside(SNP).METHODSPC12 cells were pretreated with CPU 0.01,0.10 and 1.00 μmol·L-1for 30 min before SNP 100 μmol·L-1was added to the medium for 24 h.The colorimetric MTT assay was used to evaluate cell viability.The transudation content of lactate dehydrogenase (LDH)was observed by colorimetry reaction,the degree of injury to PC12 cells was evaluated by measuring the blank content of malondialdehyde(MDA)in conditioned medium,and the activity of superoxide dismutase(SOD)in cells was measured by kits.The levels of intracellular reactive oxygen species (ROS)were quantified by the Reactive Oxygen Species Assay Kit.The mitochondrial membrane potential was investigated with the fluorescent probe JC-1.The apoptosis rate was assayed by FITC-AnnexinⅤ/PI staining while the protein expression of Bcl-2,Bax,and cleaved caspase 3 was measured by Western blotting.RESULTSCompared with blank control group,the survival rate of PC12 cells decreased to(40.8±4.5)%(P<0.01),LDH release increased from(75.6±3.4)U·L-1to(165.2±6.4)U·L-1(P<0.01);the MDA activity significantly increased,SOD activities were significantly decreased(P<0.01),the generation of ROS was increased and the levels of MMP were decreased,the rate of apoptosis increased from(1.20±0.14)%to(55.52±3.56)%(P<0.01),the positive rate of Bcl-2 decreased while the positive rate of Bax and cleaved caspase 3 increased(P<0.01),respectively,in SNP model group. Compared with SNP model group,after 24 h of incubation with CPU 0.01,0.10 and 1.00 μmol·L-1,PC12 cell survival rate increased to(55.8±3.9)%,(66.6±5.0)%and(80.0±5.4)%(P<0.05),respectively,LDH release was reduced to 137.6±21.4,100.8±14.5 and(82.5±11.3)U·L-1,respectively,the activities of antioxidant enzyme SOD were increased while lipid peroxidation(MDA)production was decreased.CPU 0.01,0.10 and 1.00 μmol·L-1could reduce the accumulation of ROS and increase the levels of mitochondrial membrane potential.The rate of apoptosis decreased to(37.79±4.85)%,(22.31±4.25)%and (10.39±2.65)%(P<0.01).CPU could up-regulate Bcl-2,down-regulate Bax and activate caspase 3(P<0.01).CONCLUSlONCPU protects PC12 cells from SNP injury models probably via anti-oxidation and anti-apoptosis.
neurosteroids;neuroprotection;apoptosis;sodium nitroprusside
LIU Ling,Tel:(0379)64830345,E-mail:liuling921@126.com
R966
:A
:1000-3002(2015)04-0545-07
2014-09-05 接受日期:2015-03-09)
(本文编辑:乔 虹)
刘 玲,博士,副教授,主要从事生化药理学研究。
刘 玲,Tel:(0379)64830345,E-mail: liuling921@126.com

