复合诱变选育衣康酸高产菌株的研究
杨 静,蒋剑春*,张 飞,张 宁,卫 民,赵 剑
(1.中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.江苏警官学院刑事科学技术系,江苏 南京 210031)
目前气候变化、环境危机、能源资源短缺正在引起世界范围内产业格局的深刻变革,可再生、无污染的生物质能源已成为当今的研究热点。而生物炼制技术由于其高效、绿色、低碳、可持续等特征,已经成为生物质资源化利用的发展趋势,并成为世界各国的战略研究方向[1-3]。生物炼制技术通常将玉米秆、稻秆、麦秆等木质纤维素原料转化为单糖,进而通过微生物发酵将单糖转化为生物基产品。衣康酸学名为甲叉琥珀酸、亚甲基丁二酸[4-5],是世界上第五大有机酸,并被美国能源部选为12种可从糖平台技术出发制备的最具开发和应用潜力的生物精炼高附加值产品之一。由于分子内存在1个不饱合双键和2个活泼的羧基,衣康酸能够进行加成、聚合、酯化等多种反应,其中尤其重要的是衣康酸的酯化反应。衣康酸酯类是生产腈纶、树脂、塑料、橡胶、药物、表面活性剂、无毒食品包装材料等的工业原料,广泛用于化工行业[6-7]。衣康酸的生产方法有化学合成法、柠檬酸分解法和微生物发酵法。其中微生物发酵法由于原料来源广泛、成本低、生产条件温和,是目前国内外生产衣康酸的主要方法[8-9]。在衣康酸的生产过程中,如何快速高效地获得高产菌株至关重要。目前,衣康酸生产菌种主要有属于土曲霉群的土曲霉(Aspergillus terreus)和属于灰绿曲霉群的衣康酸曲霉(A.itaconicus)[10-11]。实际生产中应用最多的是土曲霉,但是A.terreus野生菌株一般产量都很低,因此运用诱变育种的方法来获得高产菌株的研究日益增加。近年来有研究者认为,对野生型菌株单一诱变因素有时也能取得好的效果,但是利用复合因素诱变效果更好,特别是经过多次诱变后的高产菌株更是如此,可利用复合因素来扩大诱变幅度,提高诱变效果[12]。本研究选择土曲霉作为出发菌株,通过紫外线-LiCl、硫酸二乙酯(DES)对其进行复合诱变,以期进一步提高其衣康酸产量,为衣康酸的工业化发酵生产提供优良菌株。
1 实验
1.1 菌株
土曲霉(Aspergillus terreus)2433,购自于中国工业微生物菌种保藏管理中心(CICC)。将购买的土曲霉2433经斜面活化2~3代后,稀释涂指示剂平板。根据变色圈与菌落直径比,选取20个单菌落进行斜面培养,并进行摇瓶发酵产酸实验,5 d后测定衣康酸产量。其中5株产酸量在15 g/L以上,3号菌产酸量为18.83 g/L,相对较高,此时的残糖量为18.70 g/L,糖酸转化率为30.7%。选该菌为诱变筛选的出发菌株。
1.2 培养基
1.2.1斜面培养基 马铃薯汁1.0 L,葡萄糖10.0 g,琼脂20 g,pH值6.8。其中,马铃薯汁制备方法为:马铃薯洗净去皮,称取200 g,切成小块,加1 000 mL水煮沸1 h,用双层纱布滤成清液,加水补足蒸发而减少的水分。
1.2.2种子培养基 葡萄糖 45 g/L,(NH4)2SO45 g/L,MgSO4·7H2O 1 g/L,KH2PO41 g/L,FeSO4·7H2O 0.04 g/L,ZnSO4·7H2O 0.05 g/L,玉米浆1 g/L,定容至1 L,pH 值 3.0 ~3.5。
1.2.3发酵培养基 葡萄糖 80 g/L,(NH4)2SO45 g/L,MgSO4·7H2O 1 g/L,KH2PO41 g/L,FeSO4·7H2O 0.04 g/L,ZnSO4·7H2O 0.05 g/L,玉米浆3 g/L,定容至1 L,pH 值 3.5。
1.2.4指示剂平板培养基 葡萄糖80 g/L,(NH4)2SO45g/L,MgSO4·7H2O 1 g/L,KH2PO41 g/L,玉米浆1 g/L,琼脂2.0%,0.2%的溴甲酚绿溶液50 mL/L用硫酸调pH值3.5(将0.5 g溴甲酚绿溶于250 mL 20%的乙醇溶液即制成0.2%的溴甲酚绿溶液)。
1.3 诱变
1.3.1单孢子悬液的制备 用无菌水将28℃恒温培养5 d的斜面孢子洗下,接入种子培养基中,振荡培养至孢子刚刚萌发(约6 h)。放入装有玻璃珠的三角瓶,加入无菌水,振荡打碎孢子团块(15 min),以脱脂棉过滤,用血球计数法进行孢子计数,将孢子浓度调整为1×106个/mL。
1.3.2紫外线-LiCl复合诱变 吸取单孢子悬浮液5 mL,加入到放于磁力搅拌器上的直径9 cm的培养皿中,在15 cm的距离下用18 W的紫外灯照射0、50、100、150、200和250 s,边搅拌边照射,使孢子均匀的吸收紫外线光波。达到照射时间后,立即盖上皿盖,将孢子悬液适当稀释后涂LiCl平板(指示剂平板培养基另外加质量分数为0.3%的LiCl),用黑布包好,28℃恒温培养3~5 d,并计算致死率。选取致死率为70%~80%的UV诱变剂量,对土曲霉单孢子悬液进行诱变后涂布于LiCl平板,筛选优良菌株,进行摇瓶筛选。
1.3.3DES诱变 按照1.3.1节中所述方法,以0.1 mol/L的磷酸缓冲液(pH值7.2)取代无菌水制备孢子悬液。并用0.1 mol/L的磷酸缓冲液(pH值7.2)分别配置体积分数为0.5%、1.0%、1.5%、2.0%、2.5%的DES溶液。各取以上DES溶液和菌悬液等量加入到无菌试管内混匀,室温振荡处理10 min,诱变处理结束后加入0.5 mL 2%Na2S2O3终止反应。将孢子悬液适当稀释后涂布,28℃恒温培养3~5 d,并计算致死率。选取致死率为70%~80%的DES诱变剂量,对土曲霉单孢子悬液进行诱变,筛选优良菌株,进行摇瓶筛选。
1.4 筛选方法
1.4.1平板筛选 将稀释后的孢子悬液0.1 mL涂布指示剂平板上,倒置于28℃培养箱中,培养3~5 d,挑选生长快、产生变色圈与菌落直径比大的单菌落,进行斜面培养。
1.4.2摇瓶筛选 土曲霉突变菌株经斜面培养后,取一环接种于种子培养基中(摇瓶容积为100 mL,装液量为30 mL),37℃、200 r/min摇床培养48 h。然后按10%的接种量接种于发酵培养基(摇瓶容积为250 mL,装液量为50 mL),37℃、200 r/min摇床培养5 d,发酵结束后测定衣康酸。筛选出产酸较高的突变株,每株接入3个三角瓶中进行摇瓶复筛。并按照下式计算糖酸转化率。

1.5 突变株的稳定性考察
选取产酸量高的突变株进行传代稳定性试验,连续传代5次,测定其产酸能力。
1.6 分析方法
残余葡萄糖和衣康酸含量用高效液相色谱(HPLC)分析,色谱条件:Agilent 1200 system,Aminex HPX-87H色谱柱,流动相为5 mmol/L的硫酸,流速0.6 mL/min,柱温55℃,示差检测器,检测器温度30 ℃,进样量10 μL。
2 结果与讨论
2.1 紫外线-LiCl诱变
2.1.1紫外线诱变剂量的确定 将单孢子悬液经紫外灯照射0、50、100、150、200和250 s后,涂0.3%LiCl平板,测定不同诱变时间的致死率,绘制致死率曲线,结果见图1。
由图可以看出,在照射强度一定的情况下,紫外线对菌株的致死率与照射时间有关。当照射时间在150~250 s范围内,土曲霉2433的致死率均大于70%。研究表明,菌株突变率随着诱变剂量的增大而增高,但达到一定剂量后,再加大剂量反而会使突变率下降。一般认为,致死率在70% ~80%时突变率较高[13]。因此,紫外线诱变时间定为150 s。
2.1.2紫外线-LiCl复合诱变结果 出发菌株孢子悬液经紫外线诱变150 s后,涂布于含有0.3%LiCl的指示剂平板上,28℃恒温培养,5 d后从中选出36株变色圈与菌落直径比较大的菌株,进行摇瓶初筛和复筛实验,其中6株产酸量有所提高,结果见表1。
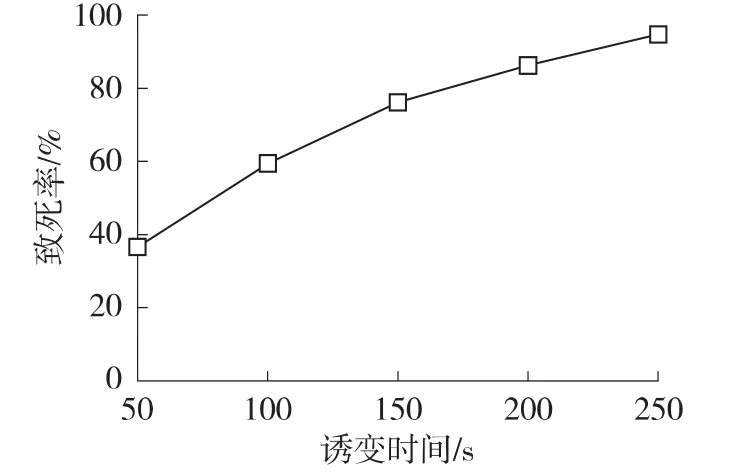
图1 紫外线诱变致死率曲线Fig.1 Lethal-rate curve of UV treatment
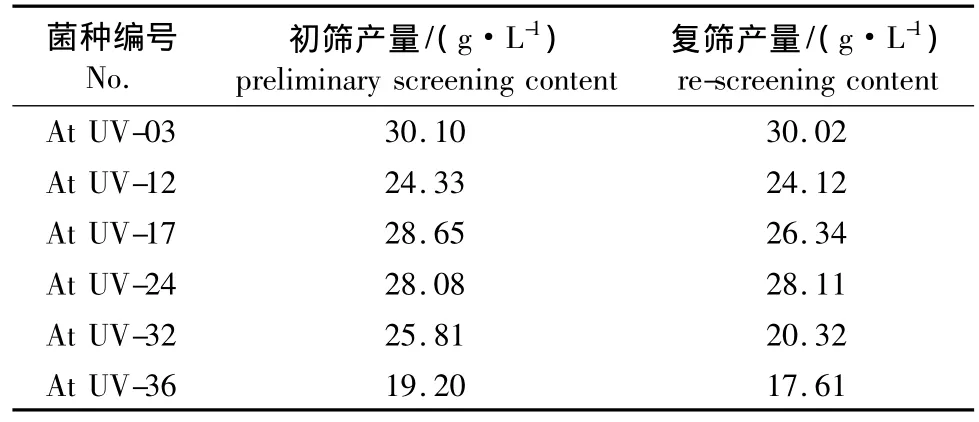
表1 紫外线-LiCl复合诱变的摇瓶发酵结果Table 1 Results of fermentation in shaking flasks bycompound mutation of UV-LiCl
LiCl是一种碱金属类诱变剂,本身并无诱变作用,但其可以改变细胞膜通透性,通常多作为促进其他诱变剂作用的敏化剂[14]。由表1结果可以看出,菌株At UV-03、At UV-24复筛产酸分别达到30.02和28.11 g/L。较出发菌株18.83 g/L提高了59.43%和49.28%。且经过多次分离,At UV-03菌株产酸量在30 g/L以上,因此选为下一轮诱变的出发菌株。
2.2 DES 诱变
2.2.1DES诱变剂量的确定 与物理诱变剂相比,化学诱变剂具有专一性的优点,每种诱变剂只会引起基因某一部位的突变,而不会对其它部位造成影响。选取DES作为诱变剂,以0.5%、1.0%、1.5%、2.0%、2.5%不同的剂量进行诱变,绘制致死率曲线,结果见图2。
由图2可以看出,随着DES体积分数的增加,菌种的存活率逐步降低,当DES体积分数为1.5%时,致死率在70%~80%之间,因此选为最适诱变剂量。
2.2.2DES诱变结果 At UV-03菌株经1.5%DES诱变后,涂布指示剂平板上,28℃恒温培养,选出35株变色圈与菌落直径比较大的菌株,进行摇瓶初筛和复筛实验,其中5株产酸量有所提高,结果见表2。
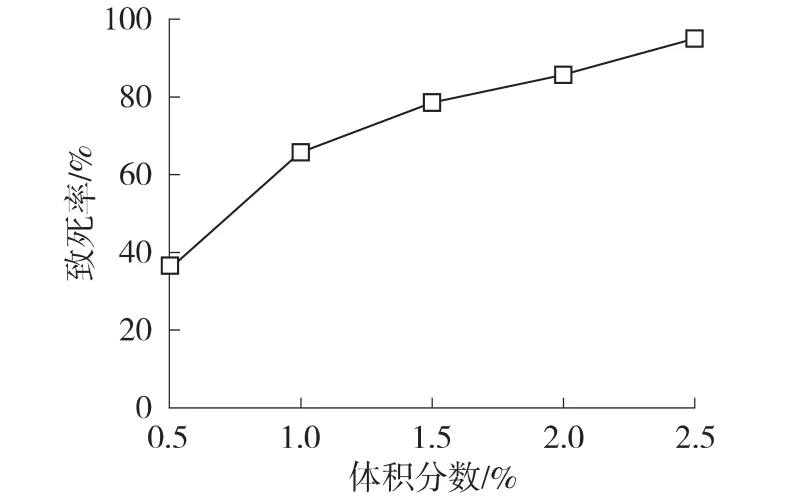
图2 DES诱变致死率曲线Fig.2 Lethal-rate curve of DES treatment
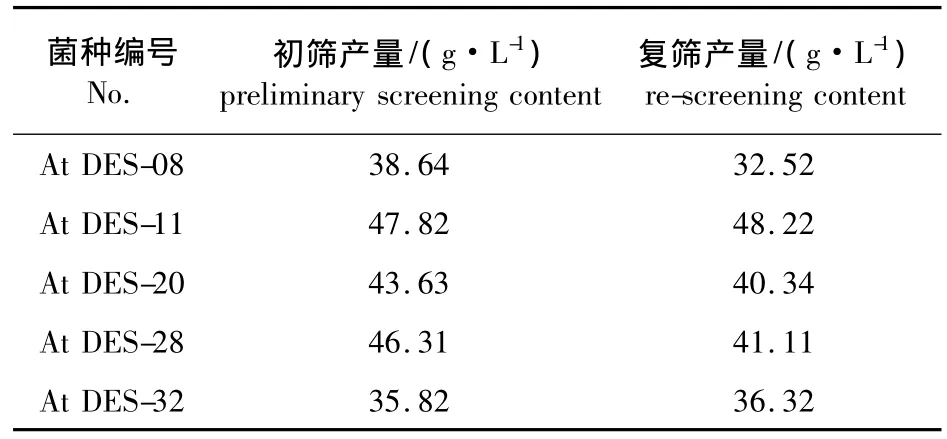
表2 DES诱变的摇瓶发酵结果Table 2 Results of fermentation in shaking flasks bycompound mutation of DES
由表2结果可以看出,这5株菌株的产酸量较出发菌株有很大提高,其中菌株At DES-11复筛产酸达到48.22 g/L,较出发菌株提高了156.08%,糖酸转化率为61.82%,较出发菌株提高了101.36%。这说明所采用的复合诱变方法能显著提高土曲霉的衣康酸产量。
2.3 突变株At DES-11的稳定性考察
为了考察诱变菌株的遗传稳定性,对诱变后的At DES-11进行摇瓶发酵,连续培养5代。结果表明,经过连续传代培养AtDES-11的产酸量分别为48.22、48.18、48.16、48.08和48.05 g/L。培养5代后,At DES-11菌株产酸量稳定在48 g/L左右,观察菌落及菌丝形态基本无改变,说明菌株土曲霉At DES-11有较好的遗传稳定性。
3 结论
对土曲霉(Aspergillus terreus)2433出发菌株进行紫外-LiCl和DES复合诱变,选育衣康酸高产菌株。最后得到一株编号为At DES-11的菌株,产酸量为48.22 g/L,较出发菌株提高了156.08%;糖酸转化率为61.82%,较出发菌株提高了101.36%,且经连续传代5次,遗传稳定性良好,产酸量稳定在48 g/L左右,菌落及菌丝形态基本不变。
[1]王久臣,戴林,田宜水,等.中国生物质能产业发展现状及趋势分析[J].农业工程学报,2007,23(9):276-282.
[2]陈雅琳,高吉喜,李咏红.中国化石能源以生物质能源替代的潜力及环境效应研究[J].中国环境科学,2010,30(10):1425-1431.
[3]KAMM B,KAMM M.Principles of biorefineries[J].Applied Microbiology and Biotechnology,2004,64(2):137-145.
[4]刘建军,姜鲁燕,李丕武,等.衣康酸的性质、生产及应用[J].山东科学,2002,15(3):38-42.
[5]杨华.国内外衣康酸生产消费与市场分析[J].上海化工,2007,32(2):46-48.
[6]WILLKE T H,VORLOP K D.Biotechnological production of itaconic acid[J].Applied Microbiology and Biotechnology,2001,56(3/4):289-295.
[7]OKABE M,LIES D,KANAMASA S,et al.Biotechnological production of itaconic acid and its biosynthesis in Aspergillus terresu[J].Applied Microbiology and Biotechnology,2009,84(4):597-606.
[8]LOCKWOOD L B,REEVES M D.Some factors affecting the production of itaconic acid by Aspergillus terrus[J].Archives of Biochemistry,1945,6(3):455-469.
[9]KUENZ A,GALLENMÜLLER Y,WILLKE T,et al.Microbial production of itaconic acid:Developing a stable platform for high product concentrations[J].Applied Microbiology and Biotechnology,2012,96(5):1209-1216.
[10]PETRUCCIOLI M,PULCI V,FEDERICI F.Itaconic acid production by Aspergillus terreus on raw starchy materials[J].Letters in Applied Microbiology,1999,28(4):309-312.
[11]张建峰,黄梅花,张岩.红曲霉紫外诱变选育多糖高产菌株[J].吉林农业大学学报,2006,28(1):23-31.
[12]白冬梅.L—乳酸高产菌株的诱变选育及其代谢通量分析[D].天津:天津大学博士学位论文,2001.
[13]王登宇,臧威,孙剑秋,等.细菌原生质体融合育种技术及其应用进展[J].中国酿造,2008,7(4):1-6.
[14]王博彦,金其荣.发酵有机酸生产与应用手册[M].1版.北京:中国轻工业出版社,2000.

