牻牛儿基牻牛儿基焦磷酸合酶和紫杉二烯合酶基因在灰盖鬼伞中的组合表达
尤琳烽,杨海星,林俊芳,2,柳永,叶志伟,郭丽琼,2,辛燕花
牻牛儿基牻牛儿基焦磷酸合酶和紫杉二烯合酶基因在灰盖鬼伞中的组合表达
尤琳烽1,杨海星1,林俊芳1,2,柳永3,叶志伟1,郭丽琼1,2,辛燕花1
1 华南农业大学食品学院,广东广州 510640 2 华南农业大学生物质能研究所,广东广州 510640 3 浙江省农科院植物保护与微生物研究所,浙江杭州 310021

尤琳烽, 杨海星, 林俊芳, 等. 牻牛儿基牻牛儿基焦磷酸合酶和紫杉二烯合酶基因在灰盖鬼伞中的组合表达. 生物工程学报, 2015, 31(3): 375–383.You LF, Yang HX, Lin JF, et al. Combinational expression of geranylgeranyl diphosphate synthase and taxadiene synthase in Coprinopsis cinerea. Chin J Biotech, 2015, 31(3): 375–383.
紫杉二烯是紫杉醇合成途径中的前体物质。紫杉醇是红豆杉的一种重要的次级代谢产物,是一种重要的新型抗癌药物。然而,紫杉醇在植物中含量低且难提取,限制了高效应用。利用基因工程手段,借助担子菌类真菌灰盖鬼伞具有的内源类异戊二烯合成途径,构建含有牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl diphosphate,GGPP) 合酶和紫杉二烯合酶的融合基因表达载体pBgGGTS和独立表达盒表达载体pBgGGgTS,并分别转入灰盖鬼伞LT2菌株中,经过选择性筛选、PCR鉴定、Southern blotting杂交验证,分别获得了5株融合表达的灰盖鬼伞工程菌和5株独立表达盒的灰盖鬼伞工程菌株。各随机挑选了1株工程菌株,分别提取菌丝体和发酵液分析。GC-MS分析表明,两种工程菌株与原出发菌株的菌丝提取物无明显差异峰,而与出发菌株的发酵液提取物相比,两种转基因灰盖鬼伞的发酵液中均出现了明显的差异峰,采用GC-MS特征质量离子分析方法判定为紫杉二烯,分别为44 ng/L (转化pBgGGgTS) 和30 ng/L (转化pBgGGTS)。结果表明,通过在灰盖鬼伞融合基因或各自独立表达的形式共表达和基因,可以生物合成紫杉二烯。
灰盖鬼伞,牻牛儿基牻牛儿基焦磷酸合酶,紫杉二烯合酶,紫杉二烯,组合生物合成
紫杉醇是红豆杉spp. 产生的一种具有显著抗癌功效的二萜类生物碱,被广泛应用于乳腺癌、卵巢癌等治疗中。但紫杉醇的自然来源匮乏,对其应用和研究造成了严重的影响。目前,紫杉醇的来源主要依靠化学半合成和植物细胞培养。二者均存在产量低、产率不稳定的问题。随着合成生物学技术的发展,紫杉醇的生物合成也成为了关注的热点。
至今,紫杉醇生物合成途径大部分得到解析,编码参与合成酶的基因得到解析[1]。其中,牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl diphosphate,GGPP) 是所有二萜类化合物的共同前体,它的生物合成是由牻牛儿基牻牛儿基焦磷酸合酶(GGPP synthase,GGPPS) 催化,将15碳的法尼基焦磷酸(FPP) 和5碳的异戊烯基焦磷酸(IPP) 缩合生成20碳的GGPP。紫杉二烯合酶(Taxadiene synthase,TS) 定位于质体,催化GGPP环化成紫杉烷类化合物独特的骨架结构紫杉二烯(Taxa-4(5),11(12)-diene),这一步反应是紫杉醇生物合成途径中的限速步骤。
随着紫杉醇生物合成过程逐步明确,研究者尝试在不同的生物体系里组合表达紫杉醇生物合成过程[2-3]。比较典型的是在大肠杆菌里构建了紫杉醇生物合成途径前几步,通过多元模块化代谢途径,过量表达限速基因和抑制副产物途径的手段,Ajikumar等[4]创造性地在分批式发酵罐中得到1.02 g/L的紫杉二烯。但由于大肠杆菌在组合表达较多基因时存在能量代谢障碍、表达质粒缺乏足够的兼容性、没有完整的细胞内膜系统、大量异源基因的表达和中间代谢产物均对细胞有毒害作用等问题,使其应用受到局限[5]。
以高等的真核生物作为合成萜类物质的真核表达系统逐渐得到研究者的重视[5-6]。酿酒酵母具有内源类异戊二烯代谢途径,可为萜类生物合成提供丰富的前体物质。通过对其上下游途径的多个基因表达进行优化和对蛋白进行亚细胞定位,实现了紫杉醇前体物质的组合生物合成[5,7-8]。也有不少研究者选择进化地位上更有优势的藻类[9]、拟南芥[10]、烟草[11]、番茄[12]、人参[13]等表达紫杉醇合酶基因。因为它们具有大肠杆菌和酿酒酵母一样的基因操作的简便性,和哺乳细胞一样对产物的更复杂的折叠和翻译后修饰。更重要的是,它们本身含有的合成次生代谢产物的酶系更加发达,拥有丰富的萜类物质,如类胡萝卜素、赤霉素、质体醌和多种维生素,为生产更多紫杉醇及其中间产物提供了较为完善的代谢池。
灰盖鬼伞是担子菌类的模式真菌,它在两周的生活史内任何一个时期都能被突变和遗传转化,常被用在真菌多细胞发育的研究[14-15]。另外,灰盖鬼伞遗传操作较简便,本实验室也将其用于表达功能蛋白[16-17]。灰盖鬼伞的全基因组得到测序并注解,遗传背景清晰,并分离得到了大量的细胞色素P450氧化还原酶,这些酶往往参与了萜类物质生物合成。其中,灰盖鬼伞的几种倍半萜合成酶,能催化FPP生成相应的倍半萜[18]。而且,从灰盖鬼伞中分离得到了多种具有生物活性的倍半萜及其衍生物[19-20]。这些都表明灰盖鬼伞具有紫杉醇合成关键酶基因中的组合表达的萜类代谢池。
灰盖鬼伞能够通过内源类异戊二烯合成途径合成GGPP,但是水平较低,限制了紫杉二烯的合成量,因此提高细胞内GGPP供给是增加紫杉二烯产量的关键。本研究在已经成功表达来源于短叶红豆杉的紫杉二烯合酶基因的基础上[21-22],采用不同的组合表达策略,进一步调控灰盖鬼伞类异戊二烯生物合成途径,实现了牻牛儿基牻牛儿基焦磷酸合成酶基因() 和紫杉二烯合酶基因() 的组合表达,得到了目标产物紫杉二烯,为紫杉醇的生物合成提供了新的尝试途径。
1 材料与方法
1.1 菌株与质粒
色氨酸营养缺陷型灰盖鬼伞LT2和营养恢复质粒pCc1001,由英国牛津大学Casselton LA教授赠送,本实验室保存。双基因表达载体pBgGGTS和pBgGGgTS,均含有香菇小片段启动子和潮霉素抗性基因(),分别设置牻牛儿基牻牛儿基焦磷酸合成酶基因(,GenBank登录号JQ029687) 和紫杉二烯合酶基因(,GenBank登录号U48796,美国华盛顿州立大学Rodney Croteau教授赠送) 以融合蛋白和独立表达盒两种形式,为本实验室构建,表达质粒图谱如图1。其中,在pBgGGgTS中,和是分别以独立表达盒存在,而pBgGGTS中则构建了和的双基因融合表达盒。
1.2 试剂
T载体和T4 DNA连接酶购自美国Promega公司;Ex聚合酶、RⅠ,d Ⅲ和Ⅰ等限制性内切酶购自大连TaKaRa公司;PCR引物和Southern blotting杂交探针合成及序列测定由上海捷瑞生物工程有限公司完成;杂交试剂盒购自瑞士Roche公司;溶壁酶购自广东省微生物研究所;正十九烷购自Sigma公司;其他化学试剂均为进口或国产分析纯。
1.3 遗传转化
将上述两种含有紫杉醇合成关键酶基因的重组质粒分别和含有色氨酸恢复基因的辅助质粒pCc1001,利用PEG介导法共转化灰盖鬼伞菌色氨酸营养缺陷型菌株LT2,菌株通过溶壁酶酶解去壁制备原生质体,重组质粒在PEG介导下转化原生质体,转化质粒pCc1001后的缺陷型菌株能够在无色氨酸的营养缺陷性固体平板培养基上生长。
1.4 PCR和Southern blotting杂交鉴定
提取灰盖鬼伞原种及两种拟转化子的基因组DNA,分别以两对特异引物对GGPPSJDF/ GGPPSJDR、TSJDF/TSJDR进行PCR扩增鉴定(表1)。
Southern杂交鉴定采用地高辛荧光标记法,探针的引物同样采用上述两对引物,以筛选出真实的阳性灰盖鬼伞工程菌株。
1.5 转基因菌株的产物鉴定
根据报道对产物进行提取和检测[4,23]。收集培养好的菌丝并冷冻干燥,液氮研磨后加入10 mL正己烷,室温振荡20 min,5 000 r/min离心1 min,取上清旋转蒸发后加入1 mL正己烷溶解。发酵液过滤去除菌丝后冷冻干燥,再参照菌丝体的处理方式添加正己烷萃取并溶解。上机前均用0.22 μm的有机相滤膜过滤。
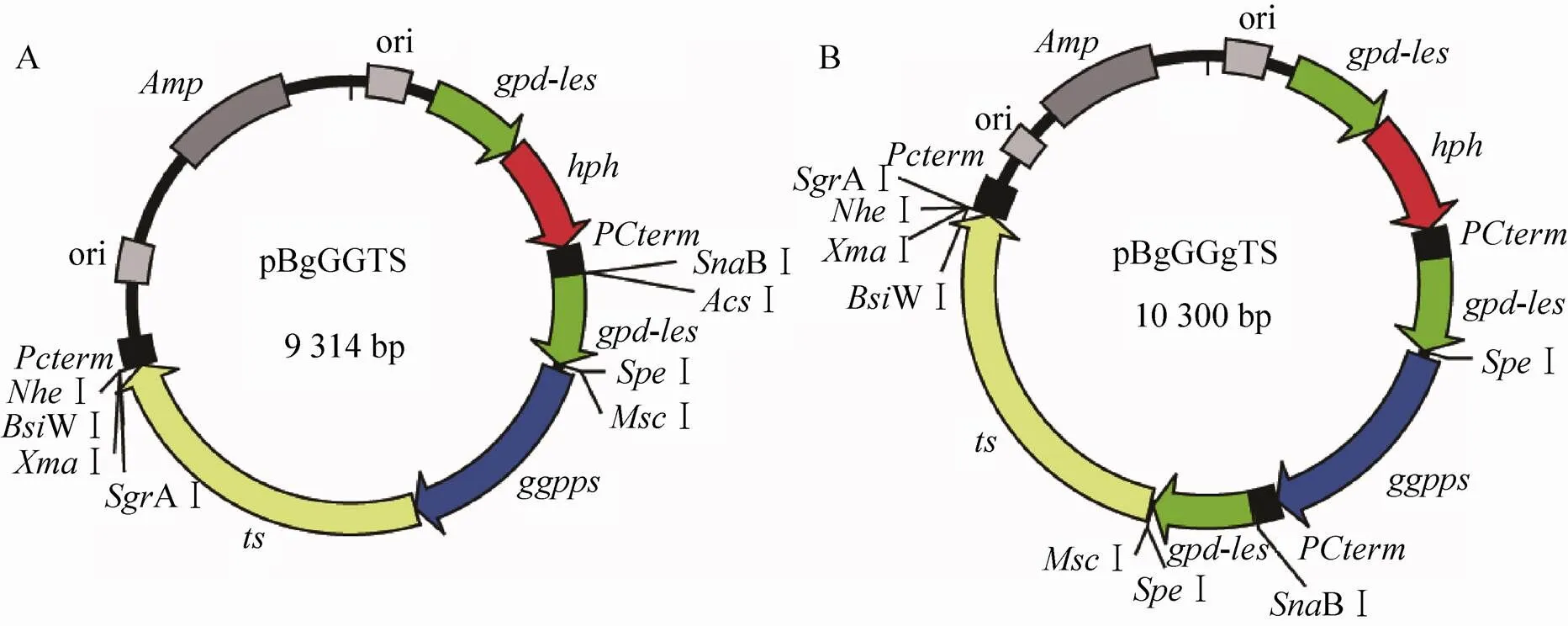
图1 表达质粒
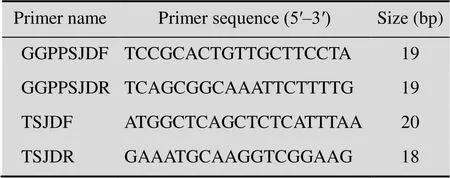
表1 本研究所用的引物
产物检测采用Agilent 7890/5975C-GC/MSD,色谱柱:DB-1ms (30 m×0.25 mm ID,0.25 μm),不分流进样,进样体积1 μL。载气:氦气,流速1 mL/min;电离模式:EI,能量70 eV;离子源温度250 ℃;扫描方式:选择离子监测(SIM) 模式。升温程序按照参考文献进行[21],进样温度250 ℃,初始温度100 ℃,保留1 min,每分钟升高8 ℃,加热到300 ℃,保留2 min。
2 结果与讨论
2.1 灰盖鬼伞的遗传转化
收集培养一周的粉孢子,30 ℃酶解得到原生质体。利用PEG介导的方法,将色氨酸营养恢复型质粒pCc1001分别与构建的表达载体pBgGGTS、pBgGGgTS共转化灰盖鬼伞原生质体,经过不含色氨酸的再生培养基得到拟转化子(图2)。
2.2 转化子的PCR鉴定
随机挑取两种载体转化灰盖鬼伞获得的潜在转化子各13个,并分别转接至最小培养基上进行扩大培养。以小量法提取的菌丝基因组DNA为模板,分别以特异引物对GGPPSJDF/ GGPPSJDR和TSJDF/TSJDR扩增,同时设阳性对照(带有基因和基因的质粒为模板) 和阴性对照(灰盖鬼伞原种LT2基因组DNA为模板)。
结果如图3所示。转化pBgGGTS质粒的5株工程菌株(2、3、4、10和11号),同时整合了和两个基因;以pBgGGgTS质粒进行转化获得6株工程菌株(2、3、6、8、11、12和13号)。在挑取的26个两种潜在转化子中,同时整合、和基因的共转化率分别为38%和53%。
图2 灰盖鬼伞拟转化子在再生培养基平板上的生长情况
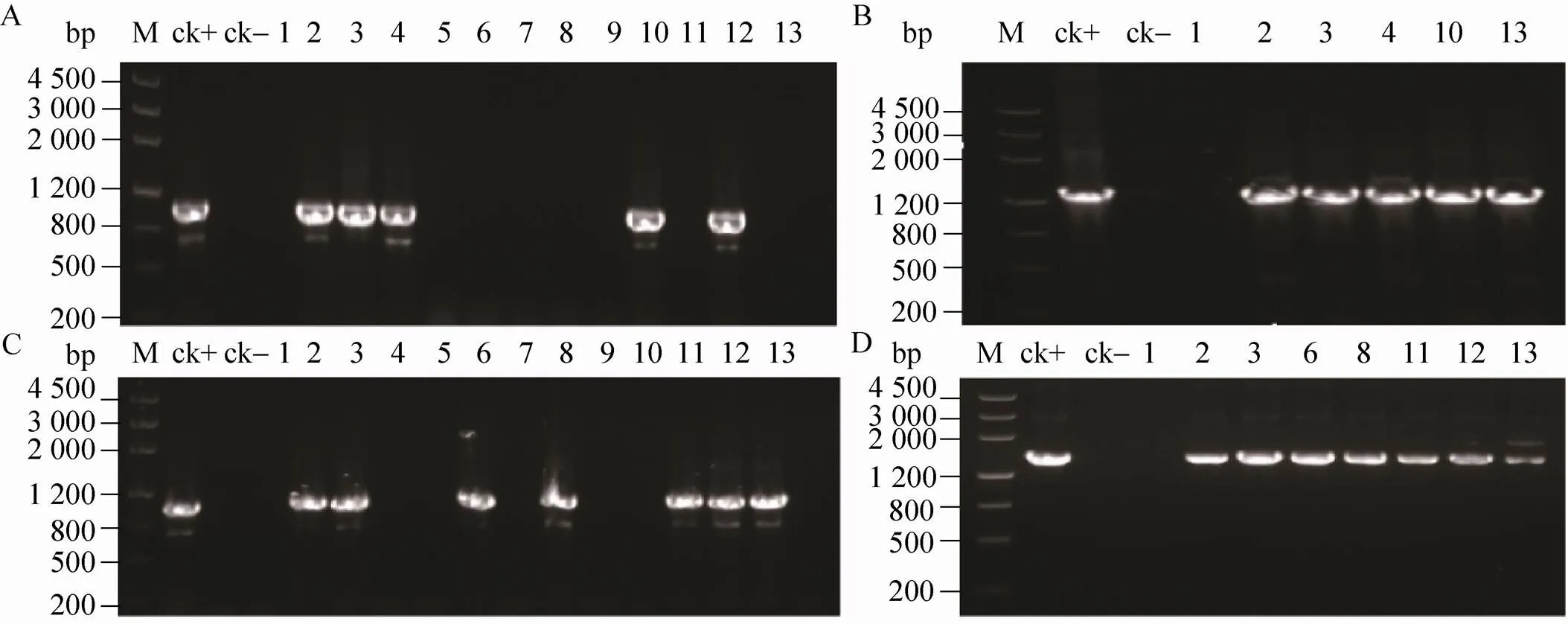
图3 灰盖鬼伞两种拟转化子PCR扩增结果
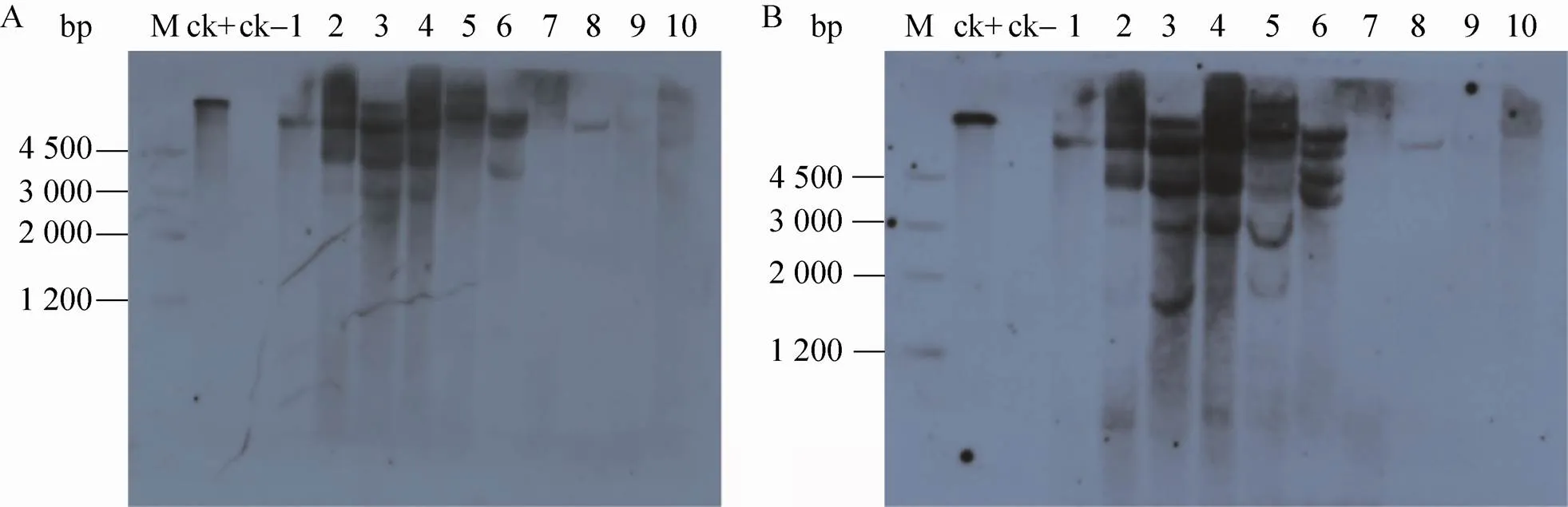
图4 灰盖鬼伞转化子的Southern blotting杂交
2.3 转化子的Southern blotting杂交鉴定
为了进一步验证转化结果,提取整合pBgGGTS质粒的5个转化子和整合pBgGGgTS质粒的5个转化子,以及灰盖鬼伞原种共11株的基因组DNA进行Southern blotting杂交分析。通过酶切、电泳、转膜、分别与地高辛标记的目的基因和探针杂交,杂交膜中出现明显信号条带 (图4),表明和分别整合到这些转化子的基因组上,该结果与PCR鉴定一致,进一步证明两种策略下的目标基因均已经稳定整合进转化子染色体上。
2.4 转基因灰盖鬼伞的GC-MS分析
分别对转基因灰盖鬼伞菌丝体和发酵液的代谢产物经过提取进行GC-MS分析。分别转化pBgGGTS和pBgGGgTS的两种工程菌株与出发菌株相比,菌丝体提取物没有明显差异峰(图未展示)。但与未转化的灰盖鬼伞发酵液相比,两种质粒转化的工程菌株的发酵液提取的化合物中,在保留时间16.762 min处,均出现了差异峰(图5),它的分子离子峰和基峰与紫杉二烯的标准图谱一致[23];紫杉二烯的分子离子峰和基峰分别为/272 [M+]和/122(C9H44),特征碎片离子峰为/107[122-15(CH3)],121,123[C环片段] (图6)。以正十九烷为内标,转化pBgGGgTS和pBgGGTS的工程菌株紫杉二烯的含量分别为44 ng/L和30 ng/L。就紫杉二烯的产量而言,和基因以独立表达盒形式略高于融合基因形式。
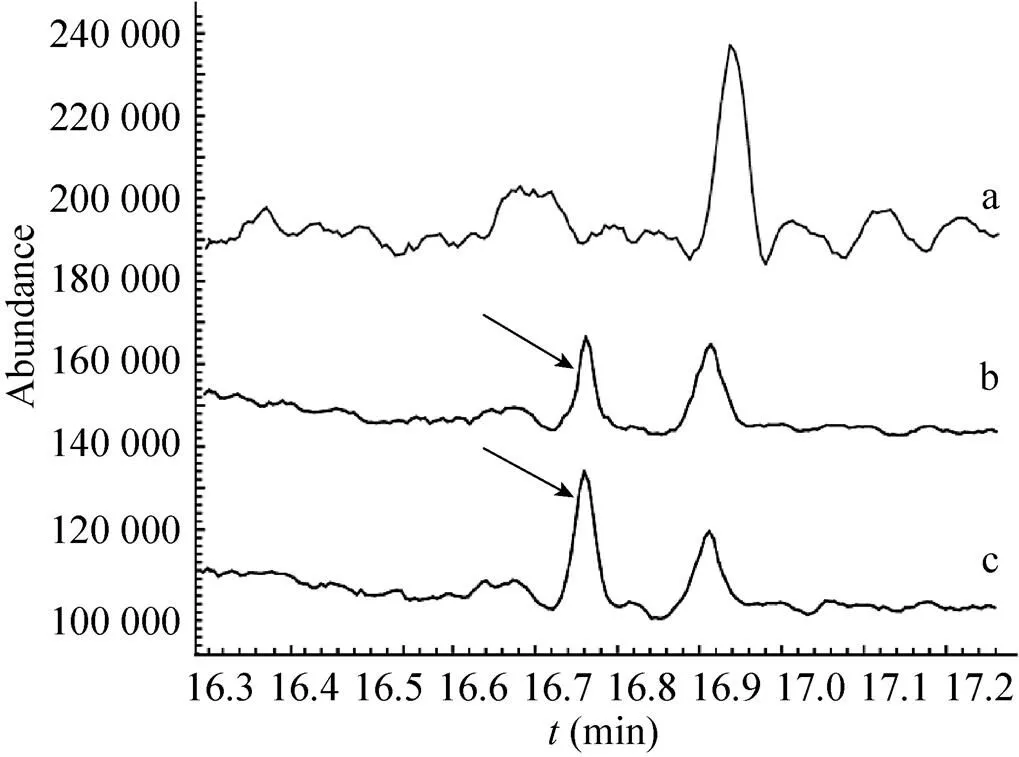
图5 GC-MS分析灰盖鬼伞对照菌株和工程菌株
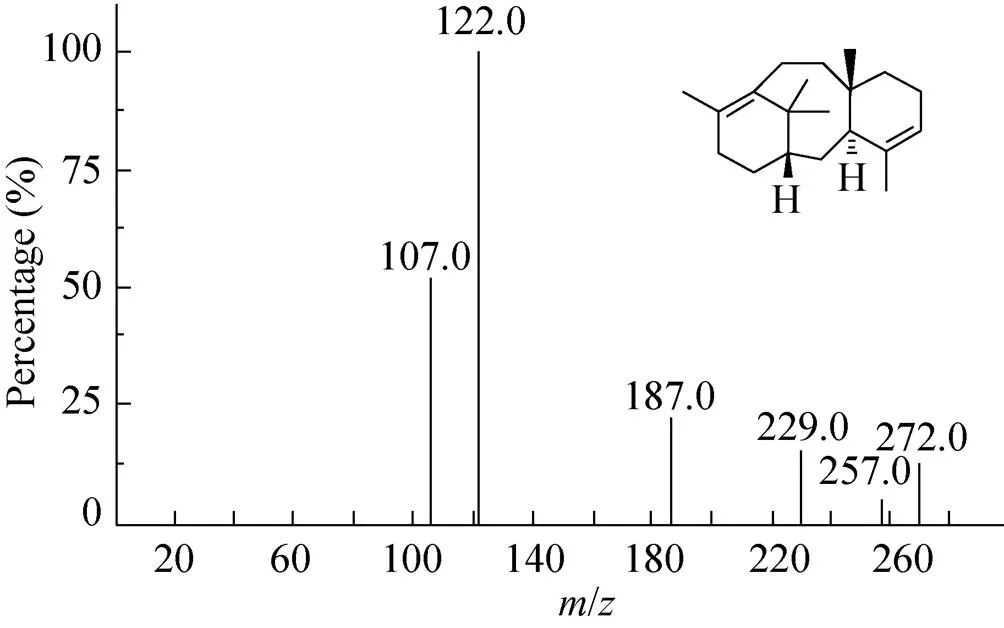
图6 新产生的峰裂解碎片离子图
3 讨论
灰盖鬼伞的全基因组分析表明拥有丰富的内源萜类合成途径,具有生物合成紫杉二烯的潜力。本研究在灰盖鬼伞中引入紫杉醇生物合成的前两个关键酶基因,即和,不论采用融合还是各自独立表达,均都能耦合反应,生成紫杉二烯。两种策略下得到的转基因工程菌株,Southern blotting杂交鉴定表明,两个外源基因均能稳定地整合到基因组上。GC-MS分析表明,两种工程菌株与出发菌株的菌丝提取物对照并无差异峰。两种工程菌株的发酵液与对照相比,出现了紫杉二烯的差异峰。和独立表达时,产生的紫杉二烯为44 ng/L,略高于以融合基因表达的30 ng/L。这表明,灰盖鬼伞具备组合生物合成紫杉二烯的能力,并可以进一步研究以提高产量。
以紫杉二烯的产量而言,灰盖鬼伞相比大肠杆菌(1.02 g/L)[4]和小立碗藓(0.05%鲜重)[9]都较低,和拟南芥(~24.64 ng/g DW)[10]、人参(5.9 μg/g DW)[13]等相差不大。一方面,相对单个基因操作,灰盖鬼伞更适合多个基因协同表达调控,尤其是基于代谢网络的模块化和全局调控,可以极大地提高紫杉二烯的产量。另外,一些反向遗传学技术如RNAi和基因敲除等技术已经在灰盖鬼伞中有了初步应用,可以通过抑制或敲除掉其代谢途径中与紫杉二烯合成竞争底物的旁路基因来提高紫杉二烯的表达量。
以合成生物学的视角来看,灰盖鬼伞本身具有丰富的萜类代谢池、精细的调控机制和复杂的细胞器膜结构,可极大地拓展元件库和模块库。相比其他平台生物,还需要进一步研究以提高紫杉二烯的产量。
[1] Kong JQ, Wang W, Zhu P, et al. Recent advances in the biosynthesis of taxol. Acta Pharm Sin, 2007, 42(4): 358–365 (in Chinese). 孔建强, 王伟, 朱平, 等. 紫杉醇生物合成的研究进展. 药学学报, 2007, 42(4): 358–365.
[2] Wang W, Yang Y, Zheng XD, et al. The advance in synthetic biology: towards a microbe-derived paclitaxel intermediates. Acta Pharm Sin, 2013, 48(2): 187–192 (in Chinese). 王伟, 杨燕, 郑晓东, 等. 紫杉醇药物中间体的合成生物学研究进展. 药学学报, 2013, 48(2): 187–192.
[3] Guerra-Bubb J, Croteau R, Williams RM. The early stages of taxol biosynthesis: an interim report on the synthesis and identification of early pathway metabolites. Nat Prod Rep, 2012, 29(6): 683–696.
[4] Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for taxol precursor overproduction in. Science,2010, 330(6000): 70–74.
[5] Li J, Wang CM. Advances of taxol combinatorial biosynthesis. Chin J Biotech, 2014, 30(3): 355–367 (in Chinese).李杰,王春梅. 紫杉醇组合生物合成的研究进展. 生物工程学报, 2014, 30(3): 355–367.
[6] Zerbe P, Hamberger B, Yuen MM, et al. Gene discovery of modular diterpene metabolism in nonmodel systems. Plant Physiol,2013, 162(2): 1073–1091.
[7] Siddiqui MS, Thodey K, Trenchard I, et al. Advancing secondary metabolite biosynthesis in yeast with synthetic biology tools. FEMS Yeast Res, 2012, 12(2): 144–170.
[8] Wang YX, Wang CM. Advances of paclitaxel combinatorial biosynthesis in Yeast. Pharm Biotechnol, 2013, 20(3): 271–275 (in Chinese).王玉霞, 王春梅. 紫杉醇在酵母中的组合生物合成. 药物生物技术, 2013, 20(3): 271–275.
[9] Anterola A, Shanle E, Perroud PF, et al. Production of taxa-4(5),11(12)-diene by transgenic. Transgenic Res, 2009, 18(4): 655–660.
[10] Besumbes O, Sauret-Gueto S, Phillips MA, et al. Metabolic engineering of isoprenoid biosynthesis infor the production of taxadiene, the first committed precursor of taxol. Biotechnol Bioeng, 2004, 88(2): 168–175.
[11] Rontein D, Onillon S, Herbette G, et al. CYP725A4 from yew catalyzes complex structural rearrangement of taxa-4(5),11(12)-diene into the cyclic ether 5(12)-oxa-3(11)-cyclotaxane. J Biol Chem, 2008, 283(10): 6067–6075.
[12] Kovacs K, Zhang L, Linforth RS, et al. Redirection of carotenoid metabolism for the efficient production of taxadiene [taxa-4(5),11(12)-diene] in transgenic tomato fruit. Transgenic Res, 2007, 16(1): 121–126.
[13] Cha M, Shim SH, Kim SH, et al. Production of taxadiene from cultured ginseng roots transformed with taxadiene synthase gene. BMB Reports, 2012, 45(10): 589–594.
[14] Kues U. Life history and developmental processes in the basidiomycete. Microbiol Mol Biol Rev, 2000, 64(2): 316–353.
[15] Stajich JE, Wilke SK, Ahren D, et al. Insights into evolution of multicellular fungi from the assembled chromosomes of the mushroom(). Proc Natl Acad Sci USA, 2010, 107(26): 11889–11894.
[16] Cheng SJ, Yang PZ, Guo LQ, et al. Expression of multi-functional cellulase geneinunder control of different basidiomycete promoters. Bioresour Technol, 2009, 100(19): 4475–4480.
[17] Han F, Liu Y, Guo LQ, et al. Heterologous expression of the immunomodulatory protein gene fromin the basidiomycete. J Appl Microbiol, 2010, 109(5): 1838–1844.
[18] Lopez-Gallego F, Agger SA, Abate-Pella D, et al. Sesquiterpene synthases Cop4 and Cop6 from: catalytic promiscuity and cyclization of farnesyl pyrophosphate geometric isomers. Chembiochem, 2010, 11(8): 1093–1106.
[19] Pettit GR, Meng Y, Pettit RK, et al. Antineoplastic agents. 556. Isolation and structure of Coprinastatin 1 from. J Nat Prod, 2010, 73(3): 388–392.
[20] Pettit GR, Meng Y, Pettit RK, et al. Antineoplastic agents 582. Part 1: Isolation and structure of a cyclobutane-type sesquiterpene cancer cell growth inhibitor from(). Bioorg Med Chem, 2010, 18(14): 4879–4883.
[21] Xin YH, Xiao ZY, You LF, et al. Heterologous expression of taxadiene synthase gene in. Sci Agric Sin, 2014, 47(3): 546–552 (in Chinese).辛燕花, 肖招燕, 尤琳烽, 等. 紫杉二烯合酶基因在灵芝中的表达. 中国农业科学, 2014, 47(3): 546–552.
[22] Kang LZ, Lin JF, Huang XQ, et al. Genetic transformation ofwith taxadiene synthase gene. Sci Technol Food Industry, 2013, 34(2): 190–193 (in Chinese).康林芝,林俊芳,黄秀琴, 等. 紫杉烯合酶基因遗传转化金针菇的研究. 食品工业科技, 2013, 34(2): 190–193.
[23] Anterola A, Shanle E, Perroud PF, et al. Production of taxa-4(5), 11(12)-diene by transgenic. Transgenic Res, 2009, 18(4): 655–660.
[24] Wildung MR, Croteau R. A cDNA clone for taxadiene synthase,the diterpene cyclase that catalyzes the committed step of taxol biosynthesis. J Biol Chem, 1996, 271(16): 9201–9204.
(本文责编 陈宏宇)
Combinational expression of geranylgeranyl diphosphate synthase and taxadiene synthase in
Linfeng You1, Haixing Yang1, Junfang Lin1, 2, Yong Liu3, Zhiwei Ye1, 2, Liqiong Guo1, 2, and Yanhua Xin1
1,,510640,,2,,510640,,3,,310021,,
Taxa-4(5),11(12)-diene is the precursor for paclitaxel biosynthesis. The diterpenoid paclitaxel (marketed as Taxol), a plant secondary metabolite isolated from yew, is an effective drug widely used in the treatment of numerous cancers. However, further application of taxol has been restricted due to its low yield in plants and the difficulties in extraction. To increase the intact isoprene flux, we constructed the fusion gene plasmid pBgGGTS and individual cassette plasmid pBgGGgTS to enhance the expression levels of geranylgeranyl diphosphate synthase gene () and a taxadiene synthase gene () in. These two plasmids were separately transformed into.LT2 strain, resulting in several putative transformants. Putative transformants were determined by PCR technique, indicating that 5 out of 13 putative transformants transformed by pBgGGTS and 6 out of 13 putative transformants transformed by pBgGGgTS, respectively. Additionally, the Southern blotting analysis of these 10 transformants confirmed that bothandgene were stably integrated into the genome of.. Crude extracts from each of the transformants were analyzed. There is no difference in the mycelium extracts among the wild-type LT2 and two types of transformants. However, analysis of culture filtrates indicated that an additional GC peak was found at the retention time of 16.762 min which was absent in the wild type control. The mass fragmentation pattern of this peak had the same diagnostic ions with taxa-4(5),11(12)-diene. According to peak area, the amounts of taxa-4(5),11(12)-diene in each fermented broth were 44 ng/L (transformed with pBgGGgTS) and 30 ng/L (transformed with pBgGGTS), respectively. In conclusion, co-expression of theandgene could increase the taxadiene production in..
, geranylgeranyl diphosphate synthase, taxadiene synthase, taxa-4(5),11(12)-diene, combinatorial biosynthesis
July 9, 2014; Accepted: October 11, 2014
Liqiong Guo. Tel: +86-20-85285382; Fax: +86-20-85280270; E-mail: guolq@scau.edu.cn
Supported by:National Natural Science Foundation of China (Nos. 31071837, 31272217).
国家自然科学基金(Nos.31071837, 31272217) 资助。

