重组人神经生长因子rh-β-NGF真核表达载体的构建及其在HEK293细胞中的表达
李景传,薛博夫,袁媛,马墨,朱林,Rebecca Milburn,李乐,胡沛臻,叶菁
重组人神经生长因子rh-β-NGF真核表达载体的构建及其在HEK293细胞中的表达
李景传1,薛博夫2,袁媛1,马墨2,朱林2,Rebecca Milburn2,李乐1,胡沛臻1,叶菁1
1 第四军医大学基础部病理教研室,陕西西安 710032 2 深圳市港科深研生物科技有限公司,广东深圳 518067

李景传, 薛博夫, 袁媛, 等.重组人神经生长因子rh-β-NGF真核表达载体的构建及其在HEK293细胞中的表达. 生物工程学报, 2015, 31(3): 411–420.Li JC, Xue BF, Yuan Y, et al. Construction of recombinant human nerve growth factor (rh-β-NGF) eukaryotic vector and its expression in HEK293 cells. Chin J Biotech, 2015, 31(3): 411–420.
为大量制备β-NGF,构建了一种稳定、高效表达重组人神经生长因子(Recombinant human nerve growth factor,rh-β-NGF) 的真核表达载体及含该重组载体的HEK293细胞株。首先,构建重组质粒pCMV-β-NGF-IRES-dhfr并转染至HEK293细胞系,用MTX加压筛选和有限稀释法进行选择,获得高效表达rh-β-NGF的单克隆重组细胞株;随后逐步降低血清培养,最终使细胞株完全适应无血清培养基并稳定表达rh-β-NGF;SDS-PAGE分析该表达产物,可见相对分子质量约13 kDa的条带,纯度大于50%,经质谱法测定得到其肽图谱与理论序列完全匹配,接着利用离子交换层析和分子筛层析纯化rh-β-NGF;最后进行重组细胞株表达效率和表达稳定性检测,表明重组细胞株可稳定、高效表达rh-β-NGF,其分泌效率大于20 pg/(cell·d),并能诱导PC12细胞的分化,具有良好的生物学活性。
重组,神经生长因子,真核载体,HEK293细胞,活性鉴定
神经生长因子(NGF) 是神经营养因子中最早被发现、目前研究最为透彻的一种神经细胞生长调节因子,具有神经元营养和促突起生长双重生物学功能,它对中枢及周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用[1]。关于NGF,已有很多的基础研究和临床应用,旨在应用NGF作为保护和治疗神经系统疾病的高效药物。而且近年研究认识到NGF并不仅仅局限于中枢以及周围神经系统甚至不仅局限在神经细胞水平,还在褥疮[2]、角膜溃疡[3]、青光眼[4]和免疫性疾病的治疗中发挥着积极的作用[5]。目前生产NGF的方法主要有两种[6]:一种是从小鼠颌下腺提取的分子量约为13−14 kDa,沉降系数为2.5 S的β-NGF,此种方式所获得的β-NGF具有如下缺点:1) 鼠NGF与人NGF在蛋白序列上有10%的差异[7],使其具有免疫原性,可能诱发抗体反应,从而降低药效;2) 具有鼠源病毒交叉感染的安全隐患;3) 生产依赖活体动物。另一种是由原核表达系统 () 重组表达制备,此种方式的缺陷是蛋白不能进行翻译后修饰,所得β-NGF活性明显低于天然β-NGF[6,8]。因此,开发一种可稳定、高效表达天然活性β-NGF的表达系统具有重要的临床意义及商业价值。本实验在人HEK293细胞中表达重组人β-NGF (Recombinant human β-NGF,rh-β-NGF),构建一种可稳定、高效表达天然活性β-NGF的重组表达载体,和基于该重组表达载体的重组真核细胞株,以及基于该重组真核细胞株的生产人β-NGF的方法,为大量制备β-NGF提供了实验基础。
1 材料与方法
1.1 主要材料、试剂
人HEK293细胞、PC12细胞购自ATCC细胞库;pCMV-MCS载体、pIRES2-EGFP质粒购自Addgene公司;Trizol试剂盒、MTX、Superscript Ⅲ逆转录酶、DNA聚合酶、FreeStyle293培养基购自Invitrogen公司;DNA marker、Ⅰ和Ⅱ剪切酶、HⅠ酶和d Ⅲ酶购自TaKaRa公司;DEME完全培养基、胎牛血清、马血清购自Gibco公司;蛋白marker购自Thermo Fisher公司;注射用鼠神经生长因子购自舒泰神(北京) 生物制药股份有限公司产品,即苏肽生;引物合成和基因测序由北京奥科鼎盛生物科技有限公司完成。
1.2 人基因的克隆及pCMV-β-NGF重组载体的构建
使用Trizol试剂盒提取人胎盘细胞总RNA,所得总RNA为模板,使用Superscript Ⅲ逆转录酶逆转录合成cDNA库,使用特异性扩增基因全长的引物,在DNA聚合酶的催化下进行PCR扩增;PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸1 min,30个循环。特异性扩增基因全长的上、下游引物序列如表1所示,引物分别包括了HⅠ和d Ⅲ的酶切位点,上游引物上还设计了序列 (GCCACCATGG)[9],并且点突变了基因ATG启动密码子后第一个碱基 (T突变成G);下游引物上包含两个终止码 (TGATAA)。收集并纯化PCR扩增产物,利用上、下游引物上的酶切位点:HⅠ和d Ⅲ将扩增片段构建到pCMV-MCS载体 (包含CMV启动子和β球蛋白基因内含子序列) 上,得到重组质粒pCMV-β-NGF,进行酶切电泳及测序分析。
1.3 重组质粒pCMV-β-NGF-IRES-dhfr的构建
1.3.1 PCR扩增
以pIRES2-EGFP质粒为模板,以正向引物 (包含Ⅰ酶切位点) 和反向融合引物 (表1) 为引物进行PCR扩增,PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,68 ℃延伸45 s,30个循环,得到长度为612 bp的扩增片段IRES,收集并纯化。
1.3.2 PCR扩增
以人HEK293细胞总RNA逆转录合成的cDNA为模板,以正向融合引物和反向引物 (包含Ⅱ酶切位点,序列如表1所示) 为引物进行PCR扩增,PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,50 ℃退火30 s,68 ℃延伸45 s,30个循环。得到长度为592 bp的扩增片段,收集并纯化。
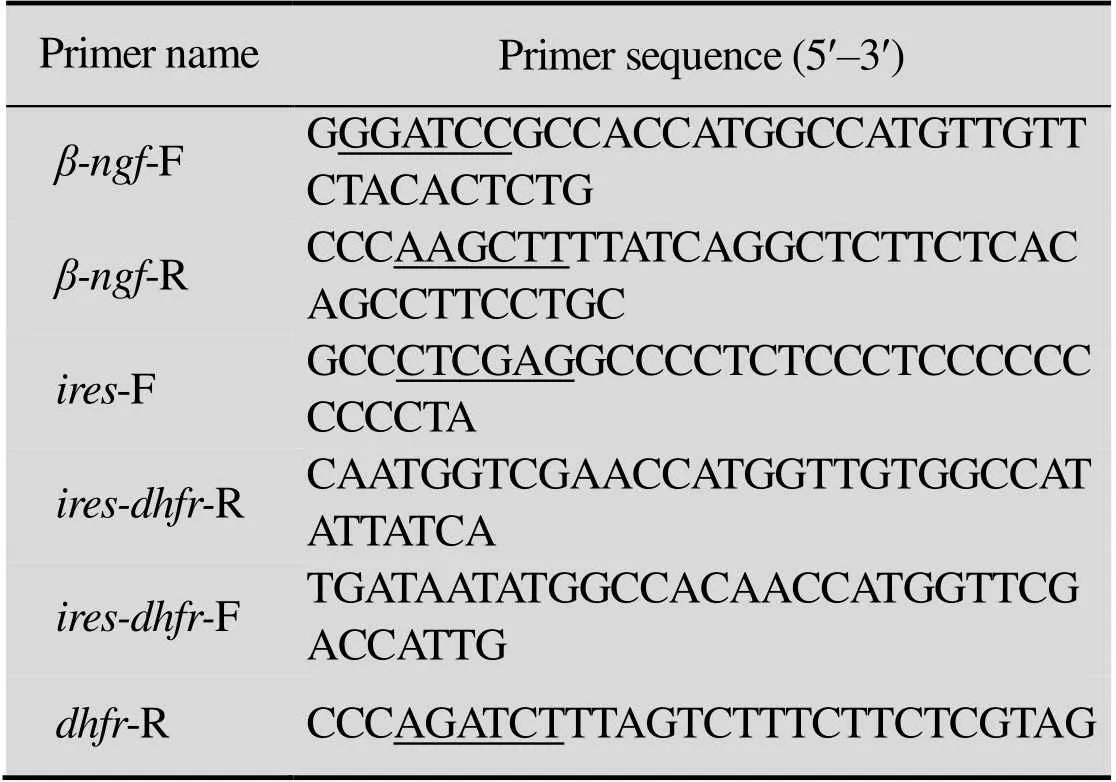
表1 PCR引物序列
Restriction site were underlined. F: forward primer; R: reverse primer.
1.3.3 PCR融合扩增
将以上PCR扩增片段和为模板,以正向引物和反向引物进行PCR扩增,PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,48 ℃退火30 s,68 ℃延伸45 s,5个循环;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸80 s,55个循环,得到与的融合片段,片段长度为1 170 bp,收集并纯化融合片段。
1.3.4构建至pCMV-β-NGF
将上述融合片段用Ⅰ和Ⅱ双酶切,所得酶切产物与经Ⅰ和Ⅱ酶切处理的pCMV-β-NGF重组载体连接,即得pCMV-β-NGF-IRES-dhfr重组质粒,进行酶切电泳及测序分析。
1.4 β-NGF重组细胞株的构建及鉴定
1.4.1 HEK293细胞的转染与稳定筛选
使用氯化铯密度梯度离心法纯化pCMV-β- NGF-IRES-dhfr质粒,备后续步骤使用。用DEME完全培养基 (含10%小牛血清),在37 ℃、5% CO2的环境下培养HEK293细胞至60%单层,用磷酸钙共沉淀方法转染纯化后的pCMV-β-NGF-IRES-dhfr质粒至HEK293细胞中;24 h后更换培养基,并加入50 nmol/L的MTX进行筛选。当细胞适应选择压力后,逐次递增MTX浓度,依次为100、200、400、800 nmol/L。当细胞适应800 nmol/L的MTX后,进一步提升MTX浓度至1 000 nmol/L,并使用有限稀释法选择高效表达β-NGF的单克隆细胞株,即为β-NGF重组细胞株。我们通过此方法筛选出10株可稳定表达β-NGF的重组细胞株。
1.4.2 重组细胞株无血清培养基适应及表达产物的电泳鉴定
重组细胞株通过逐步降低血清培养的方式,使其先适应了含1% FBS的DMEM培养基,接着在转瓶培养的方式下,逐步用FreeStyle293无血清培养基替换DMEM培养基,最终完全替换,使其完全适应FreeStyle293无血清培养基。收集适量培养基,取样进行SDS-PAGE和考马斯亮蓝染色、脱色。
1.4.3 质谱鉴定表达产物rh-β-NGF
实验采用毛细管液相色谱分离-电喷雾离子化-四级杆-飞行时间质谱法 (UPLC-ESI-Q-TOF-MS) 对β-NGF进行肽图谱测定:β-NGF用胰蛋白酶水解后溶于0.1% (/) 甲酸溶液,用反相纳升级液相色谱-电喷雾串联质谱进行分析。采用BEH130毛细管液相色谱,样品上样10 μL至富集柱 (180 µm×20 mm, Symmetry C18 trap column) 上,用缓冲液A (即0.1%甲酸水溶液) 以10 μL/min流速脱盐10 min,在线切换至反相C18分离柱 (75 µm×250 mm)。洗脱梯度为:体积含量为1%−5%的缓冲液B (即含0.1%甲酸的乙腈溶液) 5 min,然后在90 min内升高至体积含量为40%的缓冲液B,之后以体积含量为99%的缓冲液B冲洗分离柱15 min,流速为200 nL/min。根据由胰蛋白酶理论水解位点推断的β-NGF胰蛋白酶肽图谱的特征碎片离子数据,对所得质谱肽图进行分析。
1.4.4 rh-β-NGF的纯化及纯化产物的鉴定
收集含rh-β-NGF的培养上清1 200 mL,用0.45 μm滤膜微滤,随后用超滤膜超滤浓缩约8倍。超滤液上样于SP Sepharose FF强阳离子层析介质 (机型:GE Healthcare 的AKTA Purifier 10),平衡缓冲液是20 mmol/L磷酸盐缓冲液,pH 6.0,洗脱缓冲液是20 mmol/L磷酸盐缓冲液、1 mol/L NaCl,pH 6.0,流速3 mL/min,用20个柱体积进行0−100%线性洗脱,收集目标峰,无菌分装。另外,为检测纯化后rh-β-NGF的纯度和浓度,取以上小量目标蛋白洗脱峰,上样于Superdex 75 10/300 GL预装柱 (机型:Agilent公司的1260 Infinity LC),层析缓冲液是20 mmol/L磷酸盐缓冲液,pH 6.0,流速1 mL/min,收集目标峰。在液相色谱曲线中,根据各组分的峰面积值计算出rh-β-NGF的纯度,采用内标对比法测定蛋白的浓度。纯化后rh-β-NGF进行SDS-PAGE和考马斯亮蓝染色、脱色。
1.5 PC12诱导法检测重组细胞株所分泌rh-β-NGF的活性
在37 ℃、5% CO2环境下用DMEM完全培养基 (含5%胎牛血清,12%马血清) 培养PC12细胞至90%单层,胰酶消化细胞,并将消化后的细胞按每孔5×105个细胞种植于六孔板中;24 h后,清除所有培养基并于每孔内加入2 mL新鲜培养基和系列浓度的rh-β-NGF,rh-β-NGF终浓度为0、10、25、50、100、150 ng/mL,于37 ℃、5% CO2的饱和水汽二氧化碳培养箱中培养24 h;以空载体pCMV-MCS转染的HEK293细胞上清组作阴性对照组,以加入相应等同终浓度的注射用鼠神经生长因子 (苏肽生) 作阳性对照组,在相差显微镜下观察PC12细胞形态。
1.6 重组细胞株分泌rh-β-NGF的效率检测
选出6株稳定表达β-NGF的重组细胞株置于装有低血清培养基 (含1% FBS) 的摇瓶中培养,1−2 d后,离心收集细胞,并用新鲜培养基悬浮,调整细胞密度为1×106细胞/mL,继续培养24 h后收集培养基,进行SDS-PAGE凝胶电泳,同时进行电泳的还有系列稀释的BSA标准品,电泳结束后将凝胶进行考马斯亮蓝染色和脱色。
1.7 重组细胞的细胞系稳定性试验
重组细胞株在无MTX低血清的培养基 (含1% FBS) 中传代30、40、50次和60次后,各取2×106个细胞种植在60 mm培养皿里,更换新鲜培养基培养24 h后,收集培养基进行SDS-PAGE凝胶电泳,每泳道上样15 μL,电泳结束后用考马斯亮蓝染色和脱色。
2 结果与分析
2.1 重组表达质粒pCMV-β-NGF的鉴定
重组表达质粒pCMV-β-NGF经测序分析证实,基因片段已整合重组质粒中,含有与GenBank (Accession No. 4803)公开的人基因全长序列完全相同的序列。对pCMV-β-NGF进行酶切鉴定,得到大小为749 bp和4 270 bp的两条带,结果与预期一致 (图1)。
2.2 重组表达质粒pCMV-β-NGF-IRES-dhfr的鉴定
DNA测序结果显示该重组质粒包含CMV启动子、β球蛋白基因内含子、基因全长、序列和基因。用Ⅰ和Ⅱ双酶切对pCMV-β-NGF-IRES-dhfr进行酶切鉴定,得到大小为1 158 bp 和4 942 bp的两条带,结果与预期一致 (图2)。
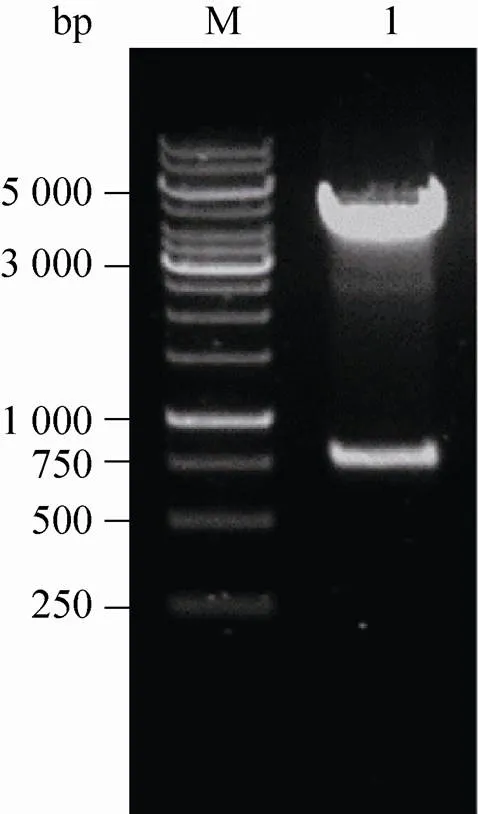
图1 重组质粒pCMV-β-NGF琼脂糖电泳分析
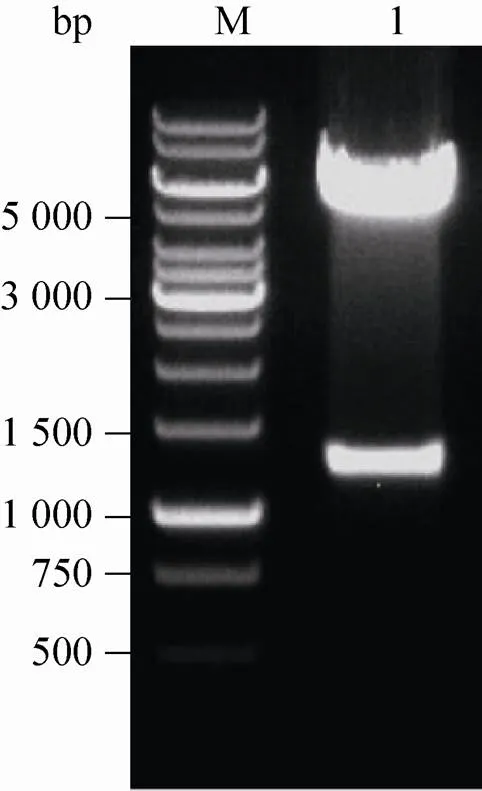
图2 重组质粒pCMV-β-NGF-IRES-dhfr琼脂糖电泳分析
2.3 重组细胞株分泌rh-β-NGF的SDS-PAGE鉴定
重组细胞株可以分泌rh-β-NGF到液态培养基中。我们将一株已适应FreeStyle293无血清培养基的β-NGF重组细胞株按1×106/mL的起始密度置于装有FreeStyle293无血清培养基的摇瓶中连续培养6 d,期间每天收集适量培养基,并更换新鲜培养基。对第1−6天的取样结果进行SDS-PAGE凝胶电泳 (1、2、3、4、5、6分别代表第1、2、3、4、5、6 d所收集的培养基,每个泳道上样量为15 μL培养基),以FreeStyle293无血清培养基作阴性对照。经考马斯亮蓝染色和脱色 (图3),在大约13 kDa的位置处有明显条带,纯度在50%以上。
2.3.1 rh-β-NGF的质谱鉴定结果
分泌所得rh-β-NGF经质谱鉴定,有13段与理论序列相匹配的肽段,其中有代表性的6段序列及所处位置如表2所示,部分相应质谱图如图4所示。质谱所测得的rh-β-NGF肽段序列与理论基因翻译蛋白序列相符。
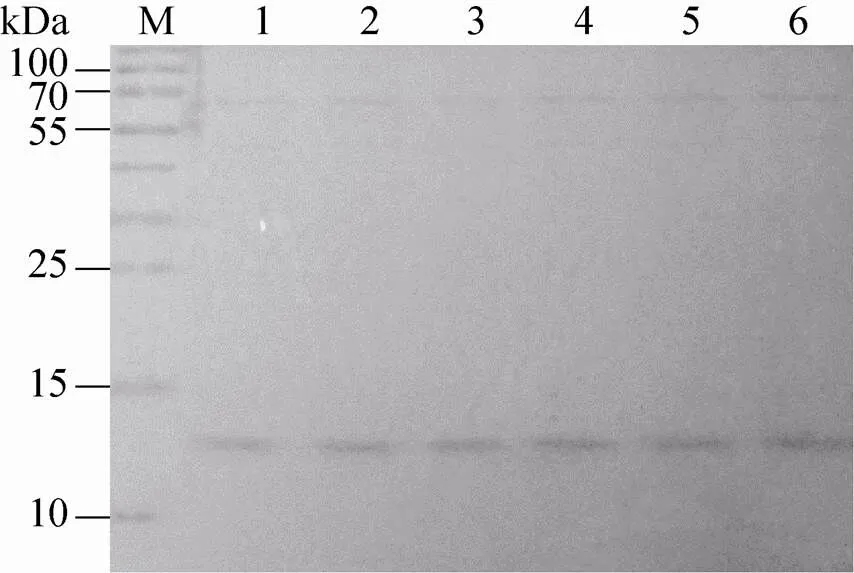
图3 重组细胞株表达rh-β-NGF的SDS-PAGE分析

表2 与理论序列相匹配的肽段及位置
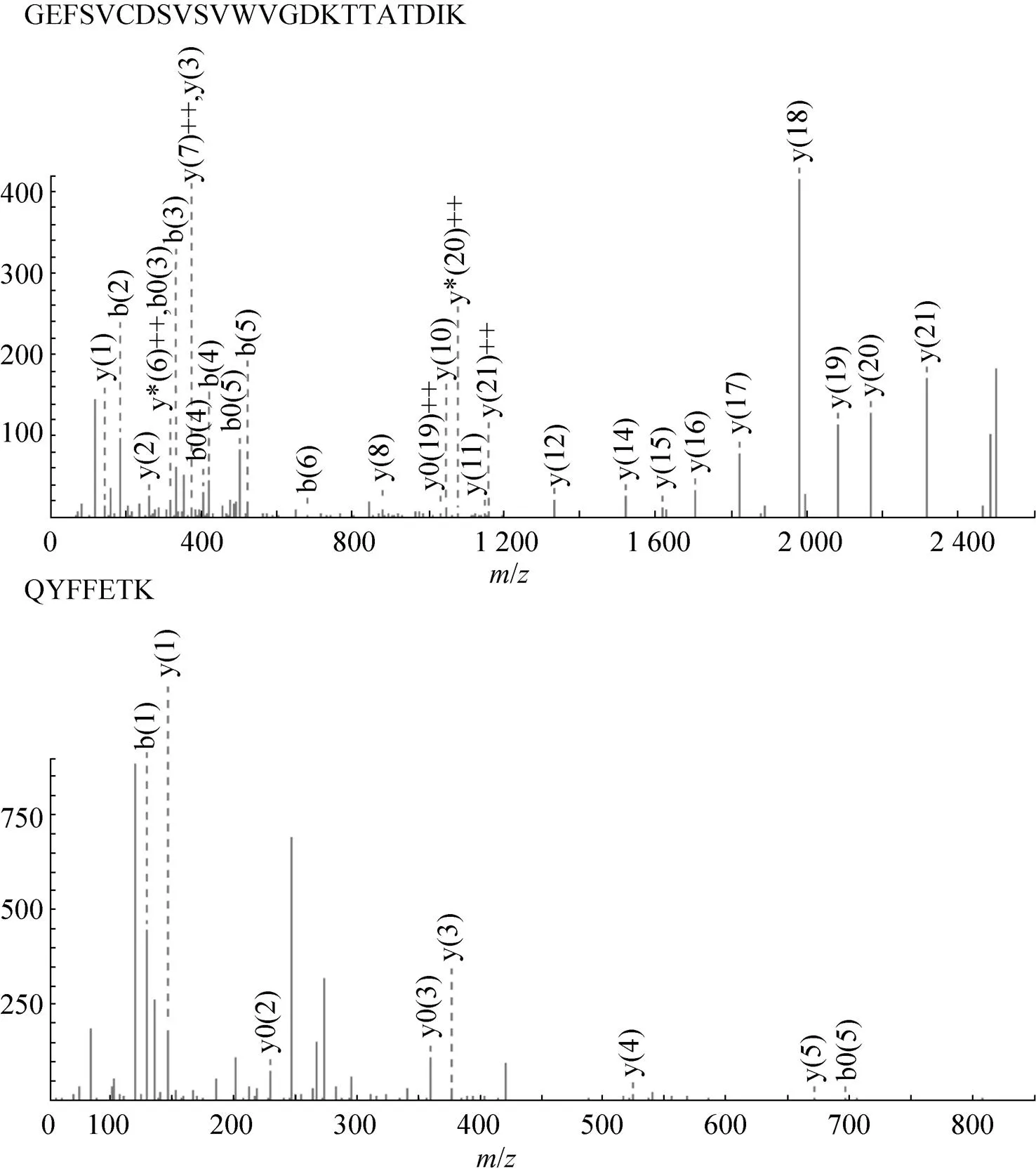
图4 重组细胞株所分泌rh-β-NGF的部分质谱图
2.3.2 纯化产物的鉴定结果
纯化的rh-β-NGF经SDS-PAGE分析,大约13 kDa的位置处有明显条带,经Quantity One软件分析,纯度在95%以上,与HPLC测纯度结果>91.7%相符 (图5)。另外,HPLC测蛋白浓度结果为0.163 mg/mL,与Bradford法测蛋白浓度结果0.159 mg/mL相符。
2.4 PC12细胞经rh-β-NGF诱导得到分化
PC12细胞经诱导后成簇生长,细胞有纤维状突起的细胞簇为阳性细胞簇,所诱导阳性细胞簇的比例反映了β-NGF的活性。与注射用鼠神经生长因子 (苏肽生) 组相似,重组细胞株分泌的rh-β-NGF组可见阳性细胞簇,而阴性对照组则无阳性细胞簇 (图6);说明重组细胞株所分泌的β-NGF具有诱导PC12细胞分化的活性。
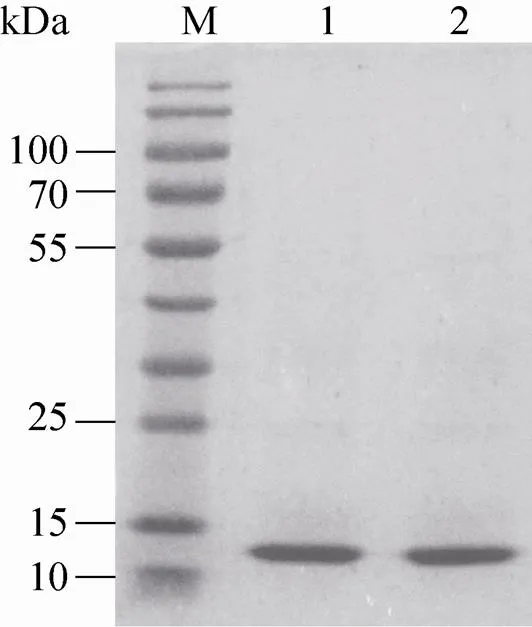
图5 纯化rh-β-NGF的SDS-PAGE分析
统计不同浓度rh-β-NGF组以及注射用鼠神经生长因子 (苏肽生) 组所诱导的PC12阳性细胞簇数占总细胞簇数的百分比,以阳性细胞簇百分比为纵坐标,以β-NGF浓度为横坐标绘制剂量-反应曲线。相同浓度下,重组细胞株所分泌的rh-β-NGF活性与现有注射用鼠神经生长因子 (苏肽生) 的活性相当或更强 (图7)。
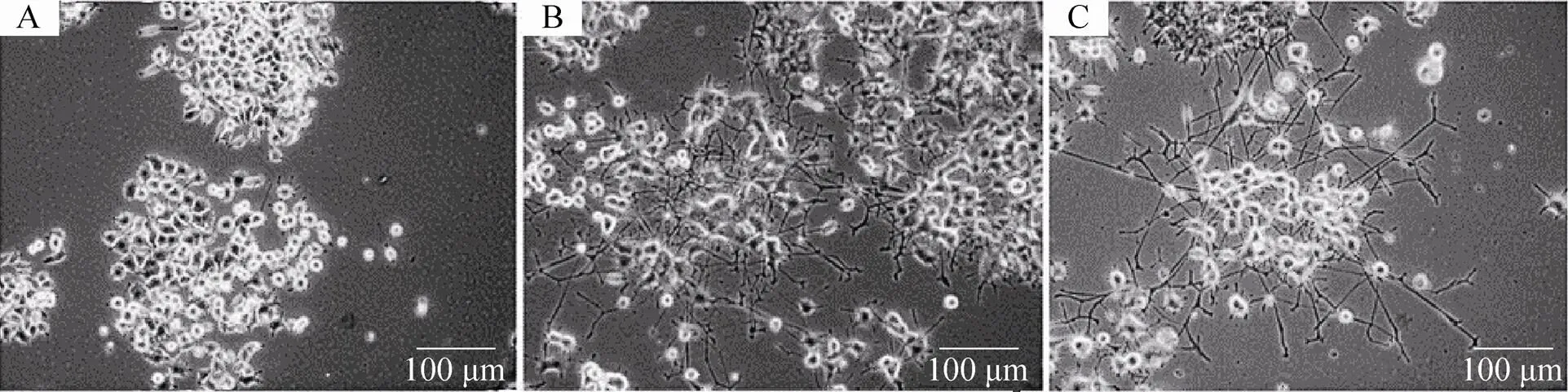
图6 NGF诱导PC12细胞分化
2.5 重组细胞株高效分泌rh-β-NGF
用Quantity One软件进行密度扫描检测13 kDa位置处的条带光密度,参照BSA标准品的光密度,计算出β-NGF的含量 (图8)。经检测,6株重组细胞株培养基中的rh-β-NGF含量为50−100 mg/L培养基,计算其表达效率约为20−50 pg/(cell·d)。
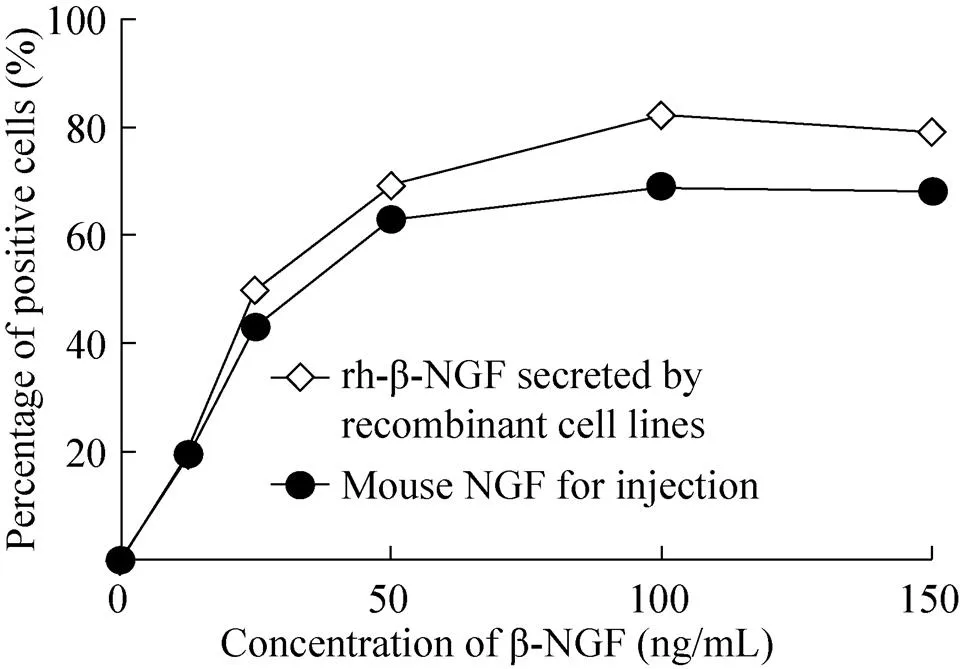
图7 不同浓度rh-β-NGF组和注射用鼠神经生长因子 (苏肽生) 组诱导PC12阳性细胞簇数的百分比
2.6 重组细胞系经多次传代仍稳定表达rh-β-NGF
细胞系经历30、40、50和60次传代后仍能表达rh-β-NGF (图9),且表达效率稳定,培养基中β-NGF含量约100 mg/L。
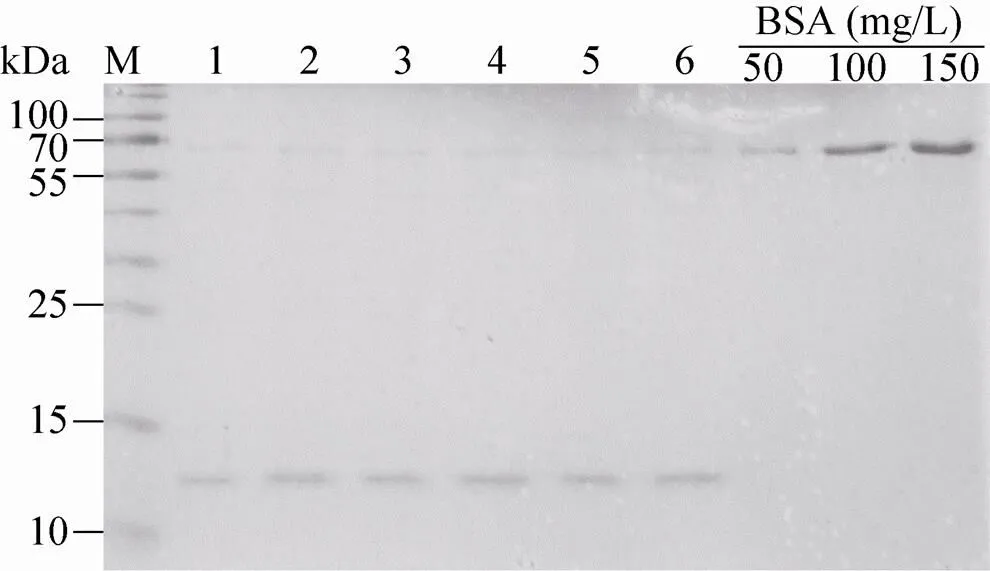
图8 重组细胞株分泌rh-β-NGF的效率检测
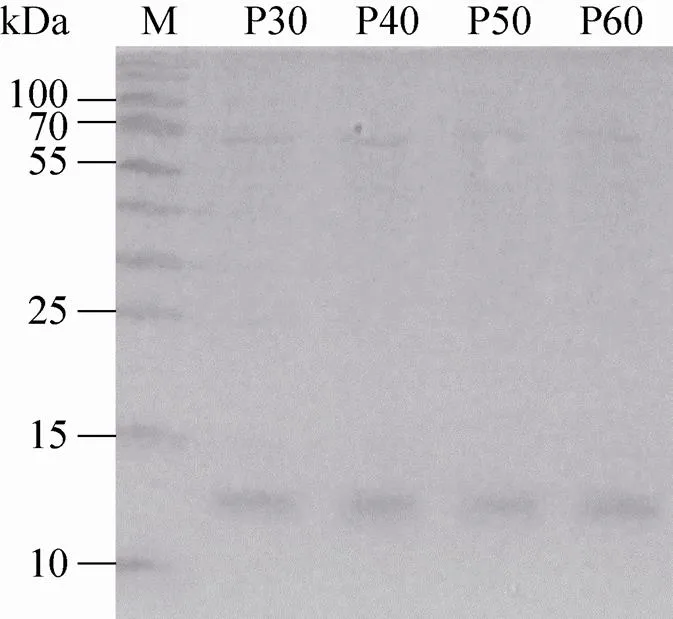
图9 重组细胞株分泌rh-β-NGF的稳定性检测
3 讨论
NGF包含α、β、γ 3个亚基,活性区是β亚基,它具有完整的NGF生物学活性,是与BDNF、NT-3和NT-4结构相关的神经营养因子,为含有半胱氨酸结 (Cysteine knot) 的稳定二聚体结构家族,由两个118个氨基酸组成的单链通过非共价键结合而成[10]。β-NGF初始翻译产物由信号肽、前导肽及成熟肽3部分组成,即pre-pro-NGF[11],其中,信号肽负责新生肽链的细胞内转运,前导肽能帮助成熟肽形成具有生物学活性的正确构象,而成熟肽才是具有生物学活性的肽段[8,12-13]。目前,已经有多种采用基因工程方法制备人的NGF,选择的表达系统主要有大肠杆菌、酵母、哺乳动物细胞及腺病毒等,其中大肠杆菌不具备蛋白质翻译后加工修饰系统[14],酵母细胞的蛋白质翻译后加工修饰方式与高等真核生物差别较大,很难获得具有较高生物活性的产物[15-16],而其他表达系统也都有多种明显的缺陷。
本实验选择哺乳动物细胞表达系统,利用基因重组技术可将表达人NGF的基因片段插入动物细胞系的基因组里,使这些细胞持续稳定高表达人NGF蛋白。真核细胞系统具有高等真核生物完整的蛋白质翻译后加工修饰系统,具备有利于外源基因表达产物二硫键形成的细胞环境,拥有完备的转录后加工过程, 包括糖基化、羧基化,使表达的外源真核基因产物能够保持其天然结构及活性[17],使得基因重组人NGF和人体自身NGF蛋白序列完全一致。此外,本实验构建的重组细胞株是分泌型细胞株,可以高效表达并分泌NGF蛋白到培养基中,此特点将大大降低下游蛋白纯化的工艺难度和成本,避免了如细胞破碎等会增加大量宿主细胞杂质蛋白和宿主杂质DNA等工艺。在无血清培养条件下可以进一步减少外源杂质和潜在污染源,简化纯化工艺,提高回收率,并且大大降低纯化成本。
本实验中,我们优选地构建出的重组表达载体主要由5部分组成:启动子 (CMV)、β球蛋白基因内含子[18-19](简称BGI,可增强人基因的转录效率,还可促进mRNA从细胞核转移到内质网)、人基因、内部核糖体进入位点序列[20-21](简称,可招募核糖体对mRNA进行翻译,以此可调控其下游筛选标记基因的表达) 和筛选标记基因 ()。重组表达载体采用一个启动子同时诱导基因和筛选标记基因转录、并使用启动后者翻译的方式,使得细胞耐药性和表达量高度统一[22]。因此,当使用该重组表达载体转染宿主细胞时,筛选出阳性表达细胞株的概率较大,所得重组表达细胞株在筛选条件下可持续、稳定表达β-NGF蛋白,细胞系经多次传代后,仍能高效表达β-NGF蛋白,其分泌效率大于 20 pg/(cell·d),为大量制备β-NGF提供了实验基础,并为进一步可能的临床应用作出了贡献。
[1] Deppmann CD, Mihalas S, Sharma N, et al. A model for neuronal competition during development. Science, 2008, 320(5874): 369–373.
[2] Bernabei R, Landi F, Bonini S, et al. Effect of topical application of nerve-growth factor on pressure ulcers. Lancet, 1999, 354(9175): 307.
[3] Lambiase A, Sacchetti M, Bonini S, et al. Nerve growth factor therapy for corneal disease. Curr Opin Ophthalmol, 2012, 23(4): 296–302.
[4] Lambiase A, Mantelli F, Bonini S, et al. Nerve growth factor eye drops to treat glaucoma. Drug News Perspect, 2010, 23(6): 361–367.
[5] Manni L, Rocco ML, Bianchi P, et al. Nerve growth factor: basic studies and possible therapeutic applications. Growth Factors, 2013, 31(4): 115–122.
[6] Colangelo AM, Finotti N, Ceriani M, et al. Recombinant human nerve growth factor with a marked activityand. Proc Natl Acad Sci USA, 2005, 102(51): 18658–18663.
[7] Bradshaw RA. Nerve growth factor. Annu Rev Biochem, 1978, 47(1): 191–216.
[8] Rattenholl A, Lilie H, Grossmann A, et al. The pro-sequence facilitates folding of human nerve growth factor frominclusion bodies. Eur J Biochem, 2001, 268(11): 3296–3303.
[9] Kozak M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Res, 1987, 15(20): 8125–8148.
[10] Barde YA. Neurotrophins: a family of proteins supporting the survival of neurons. Prog Clin Biol Res, 1994, 390: 45–56.
[11] Shinde U, Inouye M. Intramolecular chaperones: polypeptide extensions that modulate protein folding. Semin Cell Dev Biol, 2000, 11(1): 35–44.
[12] Fahnestock M, Yu G, Michalski B, et al. The nerve growth factor precursor proNGF exhibits neurotrophic activity but is less active than mature nerve growth factor. J Neurochem, 2004, 89(3): 581–592.
[13] Teng KK, Felice S, Kim T, et al. Understanding proneurotrophin actions: recent advances and challenges. Dev Neurobiol, 2010, 70(5): 350–359.
[14] Jiang HM, Chai XJ, He B, et al. Expression, purification and renaturation of proNGF in. Chin J Biotech, 2008, 24(3): 509–514 (in Chinese).江汉民, 柴新君, 何冰, 等. ProNGF在大肠杆菌中的表达、纯化和复性. 生物工程学报, 2008, 24(3): 509–514.
[15] Soderstrom S, Hallbook F, Ibanez CF, et al. Recombinant human beta-nerve growth factor (NGF): biological activity and properties in an enzyme immunoassay. J Neurosci Res, 1990, 27(4): 665–677.
[16] Vigentini I, Merico A, Tutino ML, et al. Optimization of recombinant human nerve growth factor production in the psychrophilic. J Biotechnol, 2006, 127(1): 141–150.
[17] Holzman TF, Chung CC, Edalji R, et al. Recombinant human prorenin from CHO cells: expression and purification. J Protein Chem, 1990, 9(6): 663–672.
[18] Hausladen A, Privalle CT, Keng T, et al. Nitrosative stress: activation of the transcription factor OxyR. Cell, 1996, 86(5): 719–729.
[19] Haridas V, Kim SO, Nishimura G, et al. Avicinylation (thioesterification): a protein modification that can regulate the response to oxidative and nitrosative stress. Proc Natl Acad Sci USA, 2005, 102(29): 10088–10093.
[20] Sachs AB, Sarnow P, Hentze MW, et al. Starting at the beginning, middle, and end: translation initiation in eukaryotes. Cell, 1997, 89(6): 831–838.
[21] Wilkie GS, Dickson KS, Gray NK, et al. Regulation of mRNA translation by 5′- and 3′-UTR-binding factors. Trends Biochem Sci, 2003, 28(4): 182–188.
[22] Lucas BK, Giere LM, DeMarco RA, et al. High-level production of recombinant proteins in CHO cells using a dicistronic DHFR intron expression vector. Nucleic Acids Res, 1996, 24(9): 1774–1779.
(本文责编 陈宏宇)
Construction of recombinant human nerve growth factor (rh-β-NGF) eukaryotic vector and its expression in HEK293 cells
Jingchuan Li1, Bofu Xue2, Yuan Yuan1, Mo Ma2, Lin Zhu2, Rebecca Milburn2, Le Li1, Peizhen Hu1, and Jing Ye1
1,,,’710032,,2,,518067,,
Human nerve growth factor (NGF) is a nerve cell growth regulation factor, which can provide nutrition for the neurons and promote the neurites outgrowth. In order to produce large-scale recombinant human nerve growth factor (rh-beta-NGF), we constructed a plasmid vector, which can stably express the rh-beta-NGF in the HEK293 cell lines. First, the plasmid of pCMV-beta-NGF-IRES-dhfr was constructed and transformed into HEK293 cells. Then MTX pressurized filter and limiting dilution methods were used to obtain monoclonal HEK293 cell lines. After stepwise reducing serum in culture media, the cells eventually adapted to serum-free medium and secreted rh-beta-NGF. SDS-PAGE analysis revealed that the expression product owned a molecular weight of about 13 kDa and a purity of more than 50%. The peptide mapping sequencing analysis demonstrated the sequences of rh-beta-NGF matched with the theoretical ones. Later we purified this protein by ion exchange and molecular sieve chromatograph. Finally, our experimental results exhibited that the recombinant cell lines can stably express rh-beta-NGF with a high efficiency of more than 20 pg/cell·day. In addition, this protein could successfully induce differentiation of PC12 cells. In summary, our recombinant HEK293 cells can express bio-active rh-beta-NGF with great efficiency and stability, which supply a valid basis to large-scale production of rh-beta-NGF.
recombinant, nerve growth factor (NGF), eukaryotic vectors, HEK293 cells, biological activities identification
May 13, 2014; Accepted:August 11, 2014
Jing Ye. Tel: +86-29-84772257; E-mail: yejing1219@gmail.com
Supported by:National Natural Science Foundation of China (Nos. 81101711, 81101752), National Major Special Program of New Drug Research and Development (No. 2009ZX09102-226).
国家自然科学基金 (Nos. 81101711,81101752),重大新药创制科技重大专项 (No. 2009ZX09102-226) 资助。

