一株还原制备纳米银的细菌菌株zxw01 的分离鉴定
张杰,熊文,张映,王娇,杨洪一*,王滨松
(1.东北林业大学生命科学学院,黑龙江 哈尔滨150040;2.黑龙江大学化学化工与材料学院,黑龙江 哈尔滨150080)
纳米银具有催化、抗菌、非线性光学及导热、导电等特性,在无机催化材料、抗菌剂、导电浆料等领域有着广阔的应用前景[1–4]。目前,纳米银制备多采用物理和化学方法,寻找简单环保的适合大规模制备的均一性好、稳定性好的纳米银制备方法,仍然是广大纳米材料研究者面临的富有挑战性的课题。相对于化学方法,生物方法合成具有条件温和、操作简单、环境友好等特点。藻类[5]、细菌[6–8]、真菌[9–11]等许多微生物与硝酸银作用都能制备纳米银粒子。细菌生长繁殖快,生长周期短,可大规模制备纳米银,是一种极具潜力的微生物材料。目前,关于制备纳米银优良菌株筛选的报道较少。笔者拟筛选出纳米银高产率化制备的优良菌株,现将研究结果报道如下。
1 材料与方法
1.1 土壤样品来源
于东北林业大学林场取土壤样品,共设6个样点,于距地面深20 cm处取样。将样品混合后组成代表样,装入无菌封口塑料袋内,于4℃冰箱保存,备用。
1.2 培养基
Luria–Bertani(LB)培养基的制备:将胰蛋白胨10g、酵母提取物 5g、NaCl 10g 混合,加蒸馏水定容至1 000mL,pH 调至7.4。
改良Luria–Bertani(LB)培养基(不加NaCl,防止生成氯化银沉淀)的制备:将胰蛋白胨 10g 和酵母提取物 5g 混合,加蒸馏水定容至1 000mL,调pH 至7.4。
1.3 主要仪器与试剂
主要仪器:HZQ–F160A 型高低温恒温振荡培养箱(上海一恒科技有限公司);GeneAmp9700 型PCR 扩增仪(美国应用生物系统中国公司);himacCF16RX 型高速冷冻离心机(日本HITACHI 公司);TECNAI G2 型透射电子显微镜(荷兰Philips– FEI 公司);Bruker D8 型X–射线衍射仪(德国Bruker 公司);热重分析仪(TGA/ DSC2)。
主要试剂:DNA 提取试剂盒和凝胶回收试剂盒(北京庄盟国际生物基因科技有限公司);E.coli JM109 感受态细胞(BioDev 公司);pMD18–T Vector、PCR 反应用的试剂(大连TaKaRa 公司);Tryptone、Yeast Extract 和NaCl(Oxied 公司);细菌微量生化反应管(杭州天和微生物试剂有限公司);氨苄青霉素(哈尔滨制药总厂);其他常规试剂均为分析纯。
1.4 菌种的筛选
称取土壤样品5g,加入到装有5mL 蒸馏水的三角瓶中,制成土壤悬浮液。取1mL 悬浮液接种于改良的LB 液体培养基中,150 r/min 振荡,富集培养18 h 后,向富集培养液中加入硝酸银溶液,使硝酸银终浓度为0.1 mmol/L,避光驯化48 h,分别逐级提高硝酸银的浓度至0.2、0.3、0.5、0.7、1.0 mmol/L。进行多次富集与驯化后,取1.0 mmol/L的菌液,在LB 固体培养基上进行浓度梯度稀释划线分离,得到能在含1 mmol/L 硝酸银的改良LB 培养基上存活的菌株,于4℃冰箱中保存,备用。
1.5 菌株的鉴定
1.5.1 常规鉴定
用透射电子显微镜观察所获得菌株的形态和大小,进行革兰氏染色、芽孢染色和鞭毛染色[12]。采用细菌微量生化反应管对细菌的伏普(V–P)反应、硝酸盐培养基生长、糖发酵产酸、淀粉水解、明胶液化、柠檬酸盐利用、硝酸盐还原和酪素分解[13–18]等生理生化试验进行鉴定。
1.5.2 16SrDNA 序列分析
菌株基因组采用细菌DNA 提取试剂盒提取,以细菌总DNA 为模板,利用细菌通用引物(27 F(5'–AGAGTTTGATCCTGGCTCAG–3')和1492 R (5'–GGTTACCTGTTACGT–3')进行PCR 扩增。
PCR 反应体系:将10×PCR Buffer 5 μL、10 mmol/L 的dNTPs 1 μL、2.5 μmol/L 的上游和下游引物各4 μL、5 U/μLTaq 酶0.5 μL,DNA1 μL 模板混合,加去离子水至总体积50 μL。
PCR 反应条件:94℃预变性3min;94℃变性30 s,56℃退火30 s,72℃延伸2min,30个循环;72℃保温10min。4℃保存。
用1%琼脂糖凝胶电泳检测扩增产物的大小和特异性。PCR 产物纯化后,用胶回收试剂盒回收目的片段,并与PMD18–T 连接,转化E.coli JM109,然后在含有氨苄霉素(AMP)的培养基中挑取白色单菌落(阳性转化子)进行PCR 扩增。将阳性克隆子送至上海生物工程公司进行测序,测序所获序列信息提交GenBank 核酸数据库,用BLAST 程序进行比对,搜索同源性较高的相关序列,采用MEGA5.2软件进行系统发育分析,并构建系统进化树。进化树分支稳定性用 Bootstrap 分析,重复1 000次。
1.6 纳米银的合成及表征方法
刮取固体平板菌种一环,接入LB 液体培养基中,于37℃恒温摇床上150 r/min 培养18 h,进行菌种活化。取5mL 活化好的菌株接入300mL 改良的LB 液体培养基中,于37℃恒温摇床150 r/min 振荡培养24 h。取198mL 细菌培养液,加入2mL 0.1 mol/L 的AgNO3溶液,使其Ag+终浓度为1 mmol/L,避光培养3 d。将培养液于14 000 r/min 离心10min,用蒸馏水洗沉淀3次,自然风干,得到纳米银颗粒。纳米银颗粒用X–射线衍射仪(XRD)进行表征,工作电压40 kV,扫描速度为10o/min;利用透射电子显微镜(TEM)在80 kV 电压下观察纳米银的形貌及纳米银的大小;采用热重分析仪(TGA)对离心得到的纳米银颗粒沉淀物进行分析。
2 结果与分析
2.1 菌株筛选结果
通过逐级提高硝酸银的浓度,富集和驯化,筛选出了1 株能在含1 mmol/L 硝酸银改良液体LB 培养基中存活的菌株,将其命名为zxw01。加入AgNO3避光培养后,图1–c 中菌株的颜色由土黄色变为红棕色,而图1–a 和图1–b 中菌株的颜色无变化。这种明显的颜色变化与金属粒子的表面等离子体共振效应(SPR 效应)有关,据此,可初步判定菌株zxw01 有合成纳米银的能力。

图1 添加硝酸银前后菌株zxw01 的颜色变化 Fig.1 Color change of the zxw01 bacteria before and after AgNO3 added
2.2 菌株鉴定结果
2.2.1 菌落的形态及其生理、生化特征
由图2 可以看出,菌体呈杆状,大小为(1.23~1.78) μm ×(0.36~0.85) μm。

图2 菌株zxw01 的电镜照片 Fig.2 TEM image of zxw01
菌株zxw01 在LB 固体培养基上生长的菌落为圆形,表面光滑,边缘整齐,呈黄色,细菌革兰氏染色为阳性,芽孢染色可见卵圆形芽孢,孢囊膨大,中生或近中生,鞭毛染色可观察到菌株的鞭毛,光学显微镜暗视野中可观察到该细菌能运动。
从表1 可知,该菌株不能利用D–木糖、乳糖、L–阿拉伯糖、蜜二糖、山醇、甘糖、肌醇、甘露醇、鼠李糖、山梨醇和乳糖,可以利用柠檬酸、葡萄糖、果糖、尿素、马尿酸、麦芽糖和蔗糖,明胶液化、淀粉水解、过氧化氢酶、伏普(V–P )和硝酸盐还原试验结果均呈阳性,苯丙氨酸脱氨酶试验结果呈阴性。参照《伯杰细菌手册》和《常见细菌系统鉴定手册》,可初步鉴定该菌为解淀粉酶芽孢杆菌。

表1 菌株zxw01 的生理生化试验结果 Table 1 Physiological and biochemical characteristics of strain zxw01
2.2.2 zxw01 的分子生物学鉴定结果
以菌株基因组DNA 为模板,以细菌16 SrDNA的通用引物进行RCR 扩增,对菌株的16 SrDNA 进行测序,得到1 514 bp 序列。将测序结果提交到GenBank,登录号为KF 700242。用BLAST 程序将获得的16 SrDNA 序列与GenBank 中的所有序列进行核苷酸同源性对比,采用MEGA5.2 软件构建系统发育树,用自展法(Bootstrap)检验系统发育树的可靠性,自展1 000次得到菌株zxw01 的系统进化树(图3)。由图3 可见,菌株zxw01 与解淀粉酶芽孢杆菌属形成一个族群,且同源性达99%以上。结合形态学、生理生化特征以及16 SrDNA 分析,最终将zxw01 鉴定为芽孢杆菌属的解淀粉芽孢杆菌(Bacillus amyloliquefaciens )。

图3 基于16SrDNA 序列同源性构建的系统发育树 Fig.3 Phylogenetic tree of the bacteria strain based on 16 SrDNA sequenceshomology
2.3 纳米银的XRD 分析结果
由图4 可以看出,在2θ 斜角为38.23°、44.56°、64.87°和77.48°处出现了明显的特征性衍射峰,与JCPDS 卡 04–0783 上的数据(2θ 为 38.096°、44.257°、64.406°和77.452°)吻合,分别对应于立方晶系银的(111)、(200)、(220)和(311),说明该细菌在添加硝酸银后合成了面心立方结构的纳米银颗粒,并且纳米银是无杂质的。
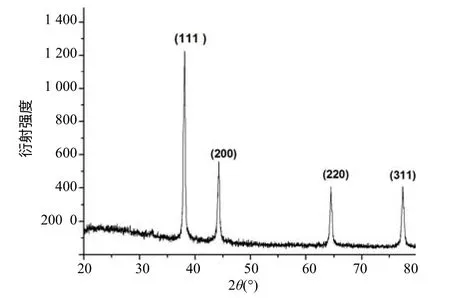
图4 利用zxw01 培养液合成的纳米银XRD 衍射图谱 Fig.4 XRD pattern of AgNPs synthesized by the bacteria strain of zxw01
2.4 纳米银的TEM 分析结果
由图5 可清楚地观察到银纳米粒子的形态和粒径大小,大部分为球形或近球形,粒径大小为2~18 nm,平均粒径为12.6 nm,粒径分布窄且较均匀,具有较好的分散性,几乎没有团聚现象。

图5 zxw01 培养液合成纳米银的TEM 图谱 Fig.5 TEM image of AgNPs synthesized by the bacteria strain of zxw01
2.5 纳米银颗粒的热重分析结果
Ag+终浓度为1 mmol/L 的培养液200mL 制备纳米银,最终离心后可获得0.03g 的纳米银颗粒沉淀物。对沉淀物进行热重分析的结果(图6)表明,随着加热温度的升高,纳米银颗粒的质量逐渐减少,当温度上升到580℃时达到热稳定状态,不再有质量损失。其原因在于离心后得到的纳米银颗粒沉淀中含有的水和有机物,这些水和有机物在加热过程中不断释放,最后达到稳定。热稳定状态时得到的纳米银质量为纳米银颗粒沉淀物质量的58%,由此可知,纳米银的实际产量为0.017 4g(0.03×58%),又知纳米银的理论产量为0.021 6g(0.2 (L)×1×10-3(mol/L)×108(g/mol)),因此,纳米银产率为80.6%(实际产量/理论产量)。

图6 纳米银的热重分析 Fig.6 Thermogravimetric analysis of silver nanoparticles
3 结论与讨论
逐渐加大硝酸银浓度进行富集与驯化,筛选得到1 株能还原制备纳米银的菌株zxw01。该菌株能在含1 mmol/L 硝酸银的改良LB 液体培养基中存活,并且能使得添加硝酸银的菌株培养液由土黄色变为棕红色,合成的纳米银是分散的,呈球形或近球形,粒径为2~18 nm,纳米银产率为80.6%。经个体形态特征鉴定、生理生化特征鉴定和16 SrDNA 序列分析,将该菌鉴定为解淀粉酶芽孢杆菌(Bacillus amyqueciens)。
目前,在同类研究中,用细菌制备纳米银比用真菌更具优势。细菌繁殖快,生长周期短,且关于细菌的发酵和遗传改造经验比关于真菌的更为丰富,这有利于基因工程操作,可以利用基因工程技术,使特定的具有还原作用的酶以及起稳定作用的蛋白大量表达,从而实现纳米粒子的大规模制备,所以,细菌在纳米银合成领域具有发展潜力,有待进一步研究。
[1] Lu Juan,Gu Wenliang,Sun Jianbo,et al. Isolation identification of Bacillus amyloliquefaciens LX1 strain againsts Fusarium oxysporum f.sp. cubense and cloning of its antifungal proteingene[J].Chinese Journal of Tropical Crops,2013,34(1):117–124.
[2] Mohammad Oves,Mohammad Saghir Khan,Almas Zaidi,et al. Antibacterial and cytotoxic efficacy of extracellular silver nanoparticles biofabricated from chromium reducing novel OS4 strain of Stenotropho- monas maltophilia[J]. Plos One,2013,8(3):1–14.
[3] Abilash Gangula.Ramakrishna Podila.Ramakrishna M,et al.Catalytic reduction of 4–Nitrophenol using biogenicgold and silver nanoparticles derived from breynia rhamnoides[J].Langmuir,2011,27(24):15268–15274.
[4] Castro-Longoria E,Alfredo R,Vilchis-Nestor M,et al. Biosynthesis of silver,gold and bimetallic nanoparticles using the filamentous fungus Neurospora crassa[J]. Colloids and Surfaces B:Biointerfaces,2011,83 (1): 42–48.
[5] Indu Barwal,Peeyush Ranjan,Suneel Kateriya,et al. Cellular oxido-reductive proteins of Chlamydomonas reinhardtii control the biosynthesis of silver nanoparticles [J].Journal of Nanobiotechnology,2011,9:56–68.
[6] Nalenthiran P,Sambandam A,Govindarajan K,et al. Microbial synthesis of silver nanoparticles by Bacillus sp. [J].Nanopart Res,2009,11(7):1811–1815.
[7] Sahar Zaki,El Kady M F,Desouky Abd–El–Haleem,et al.Biosynthesis and structural characterization of silver nanoparticles from bacterial isolates[J]. Materials Research Bulletin,2011,46(10):1571–1576.
[8] Seenivasan B,Selvaraj G,Thangavelu B,et al. Characterization and antimicrobial properties of silver and silver oxide nanoparticles synthesized by cell–free extract of a mangrove associated Pseudomonas aeruginosa M6 using two different thermal treatments [J].Ind Eng Chem Res,2012,51(17):5976 –5985.
[9] Navin Jain,Arpit Bhargava,Sonali Majumdar,et al. Extracellular biosynthesis and charact Erization of silver nanoparticles using Aspergillus flavus NJP08 : A mechanism perspective[J].Nanoscale,2011,3(2):635–641.
[10] 李广泉,王丽.土曲霉介导的纳米材料生物还原制备及其应用研究[D].长春:吉林大学,2012.
[11] 杨素玲,孟佑婷,刘桂君,等.利用产黄青霉培养液的上清液生物合成纳米银影响因素的研究[J].安徽农业科学,2013,41(2):503–504,506.
[12] 汪春蕾.具细菌漆酶活性的芽孢外壁蛋白CotA 基因克隆及异源表达研究[D].哈尔滨:东北林业大学,2010.
[13] 朱小宁,余兴龙,李润成,等.副猪嗜血杆菌的分离与鉴定及其16S rRNA 生物信息学分析[J] .湖南农业大学学报:自然科学版,2009,36(5):517–520.
[14] 布坎南 R E,吉布斯 E N.伯杰氏细菌鉴定手册(第八版)[K].颜子颖,王海林,译.北京:科学出版社,1999:498–501.
[15] Buchanan R E,Gibbons N E.伯杰氏细菌鉴定手册[K].北京:科学出版社,1984:482–484.
[16] 李新新,高新新,陈星,等.一株高效解钾菌的筛选、鉴定及发酵条件的优化[J].土壤学报,2014,51(2):381–388.
[17] 王一光,林羽,陈方永,等.杨梅枝条枯萎病病原菌分离鉴定及防治药剂的室内筛选[J].湖南农业大学学报:自然科学版,2014,40(1):53–55.
[18] 王同,孔令雅,焦加国,等.红壤溶磷菌的筛选及溶磷机制[J].土壤学报,2014(2):373–380.

