辣椒轻斑驳病毒的分子杂交检测
刘崇,高颖,杨洪一
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
感染辣椒轻斑驳病毒(pepper mild mottle virus,PMMoV)后,辣椒植株陆续出现叶片变黄、褶皱、青斑等症状,结果期会出现萎缩、斑驳等症状[1–4]。PMMoV 最早在美国被发现,其后在丹麦、日本、西班牙、加拿大、澳大利亚等国均有发现[1]。1994年,向本春首次在中国新疆辣椒上发现PMMoV[2],后来有人相继在青岛、保定、宁夏等地区发现了该病毒[3–4]。PMMoV 现已成为一种世界性病害。PMMoV 为正单链RNA 病毒,病毒粒子为杆状[5]。因为PMMoV 侵染辣椒植株的早期症状多不明显,且该病毒可以通过种子、花粉、汁液摩擦等进行传播[6],所以,建立病毒的快速检测体系具有重要应用价值。PMMoV 的常规检测主要是采用血清学方法,国外目前已有商业化的试剂盒销售,但试剂盒灵敏度较低,检测结果易受叶片幼嫩程度、感病时期等因素影响[4,7–9]。利用 RT–PCR 技术检测PMMoV 是近年来发展较迅速的方法。因为该方法需要高质量的辣椒总核酸,所以,整个检测体系的技术含量较高[10]。分子杂交技术作为一种高灵敏度及高稳定性的检测技术曾受到广泛关注,但放射性探针的安全性、非放射性探针的成本问题极大限制了该方法的普及。近年来,随非放射性标记物成本的降低,该技术已具备被大规模应用的潜力。笔者探索PMMoV 的分子杂交技术检测方法,以期获得有效、快速检测PMMoV 的技术体系。
1 材料和方法
1.1 植物材料
已感染PMMoV 的辣椒植株(表现为叶片黄化、果实畸形)取自吉林九台。试验中的PMMoV 阴性、阳性植株分别利用DAS–ELISA、RT–PCR 进行鉴定[10–11];前期研究中,已获得了阳性对照中病毒分离物的基因组全序列[10]。
1.2 RT–PCR 扩增及扩增产物鉴定
RT–PCR 正向引物序列为ATTACTACCGCCG ATGCTGAG(5'→3');反向引物序列为TGGAGGA AAAACACTACGAG(5'→3')。引物位于PMMoV 基因组的运动蛋白及非编码区[5]。引物由TaKaRa 公司合成。
以0.05g 辣椒叶片为试材,利用改进的CTAB法分离辣椒叶片总核酸[11]。提取的总核酸最后溶于 50 μL DEPC 中。以总核酸为模板,利用RT–PCR技术扩增PMMoV 基因组3′末端部分区域(包括部分运动蛋白基因、外壳蛋白基因及部分非编码区),退火温度55℃,具体操作参见文献[11]。对PCR产物进行切胶回收,与pMD18–T 载体(TaKaRa)连接,然后转化大肠杆菌感受态细胞。经蓝白斑筛选,挑取白色菌落培养,提取质粒,通过PCR 鉴定阳性克隆之后进行测序[12]。采用 BLAST 工具,在GenBank 中进行相似性分析。
1.3 分子杂交体系的建立
利用DIG DNA 标记试剂盒(深圳莱伯克生物技术公司),采用PCR 技术制备cDNA 探针。反应体系共20 μL,包括正义引物(5 μmol/L)、反义引物(5 μmol/L)各1 μL,质粒DNA 模板200~800 ng,10×PCR Buffer 2 μL,Dig–dUTP 标记混合物2 μL,Taq DNA 聚合酶2 U。将各组分混匀后进行PCR 反应,PCR 反应退火温度为55℃。
利用PMMoV 地高辛标记探针,以辣椒叶片为试材,对辣椒叶片中的PMMoV 进行分子杂交检测。杂交检测包括总核酸提取、预杂交、杂交、洗膜、信号检测等步骤,按照深圳莱伯克生物技术公司的杂交试剂盒说明书进行操作。
1.4 分子杂交体系的优化
1.4.1 叶片干燥处理及其对杂交结果的影响
将新鲜叶片摘下后于烘箱中37℃处理24 h,之后用塑料自封袋封口存放。短期存放的(少于9 d)置于室温下,长期存放的(超过9 d)置于4℃冰箱保存。利用改进的CTAB 法提取干燥叶片总核酸。分别稀释提取新鲜叶片与干燥叶片的总核酸,之后进行点杂交试验。稀释液为体积比5∶3∶2 的去离子水、20×SSC 和甲醛。RNA 稀释倍数分别为10、20、40、80、160、320、640、1 000。
1.4.2 总核酸的提取及其对杂交结果影响的试验
取约0.05g 新鲜辣椒叶片,加入0.1 mol/L 的PBS 约1~2mL,研磨,6 000 r/min 离心10min,取上清液,加入体积比 24∶1 的氯仿、异戊醇抽提,之后用乙醇沉淀,50 μL DEPC 水溶解。
稀释提取的总核酸后进行点杂交试验。
1.4.3 探针特异性分析试验
以草莓(受草莓轻型黄边病毒(strawberry mild yellow edge virus, SMYEV)感染)、烟草(种子繁殖,未发现明显病毒侵染症状)和苹果(受苹果茎痘病毒(apple stem spitting virus, ASPV)感染)为试验材料,进行点杂交试验,分析探针的特异性。
2 结果与分析
2.1 PMMoV 侵染辣椒的症状
辣椒植株被PMMoV 侵染后,感病的辣椒叶片表面出现凹凸不平症状,并出现大小不一的青斑,叶片有褶皱,边缘变黄;辣椒果实较小,后期出现萎缩(图1),进而造成减产。

图1 感染PMMoV的辣椒果实 Fig.1 Pepper fruit infected by PMMoV
2.2 PMMoV 特异片段的RT–PCR 扩增及克隆测序结果
分别以经DAS–ELISA 鉴定[10]的PMMoV 阳性、阴性对照样品为试材,利用RT–PCR 技术在阳性对照样品中扩增出了预期的PMMoV 特异片段(图2);对此特异片段进行克隆测序的结果表明,RT–PCR 扩增产物为PMMoV 特异片段,大小为955 bp。BLAST 结果显示,该特异片段序列与GenBank中PMMoV 不同分离物核苷酸序列的同源性为94%~99%。
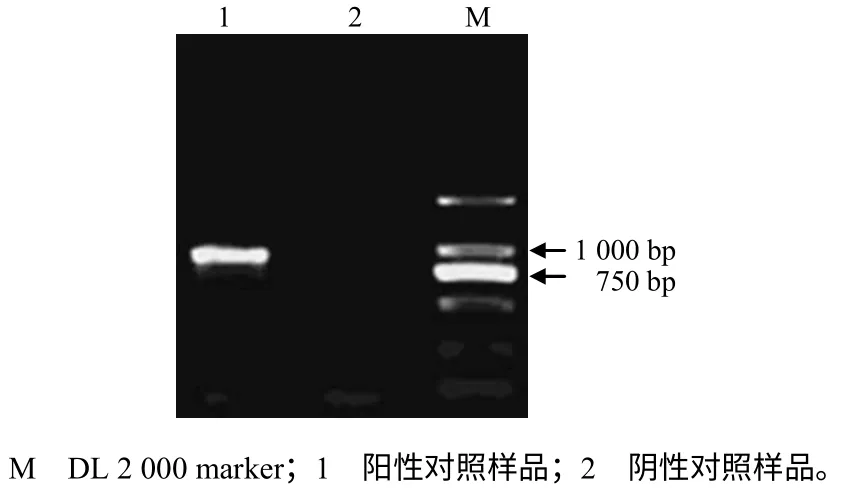
图2 PMMoV 特异片段RT–PCR 扩增结果的电泳图谱 Fig.2 Electrophoretogram from the amplified specific fragment of PMMoV
2.3 利用PCR 技术制备的地高辛标记探针
利用PCR 技术制备地高辛标记PMMoV cDNA探针的琼脂糖凝胶电泳结果显示,探针电泳条带清晰,整齐,大小与预期一致(图3)。
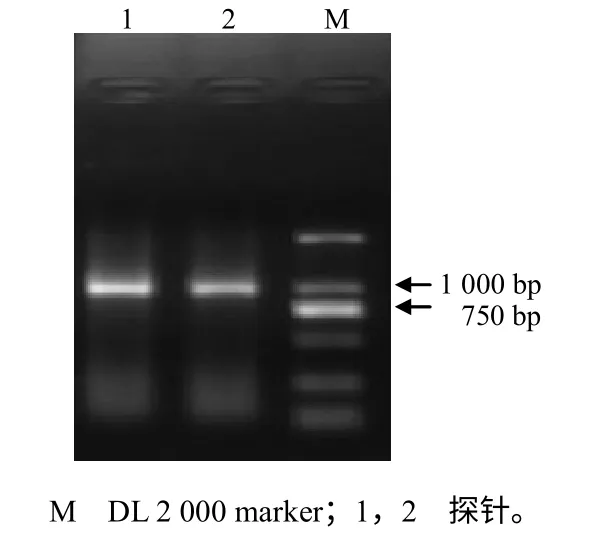
图3 地高辛标记探针的琼脂糖凝胶电泳图谱 Fig.3 Electrophoretogram from the probe labeled with digoxigenin
2.4 分子杂交体系及其优化结果
分别以经DAS–ELISA、RT–PCR 鉴定[10]的PMMoV 阳性、阴性对照样品为试材,利用地高辛标记PMMoV cDNA 探针对辣椒样品中的PMMoV进行分子杂交检测。对杂交体系进行优化后,最终PMMoV 阳性对照样品可在杂交膜上显示蓝紫色斑点,而阴性对照样品无杂交信号。
比较以新鲜和干燥叶片为试验材料的检测灵敏度,结果显示,运用改进CTAB 法从干燥叶片中提取的总核酸稀释80 倍仍可检测到PMMoV,而从新鲜叶片中提取的总核酸稀释640 倍后仍可有效检测到PMMoV(图4),检测灵敏度下限分别为12.5、1.6μg。

图4 干燥和新鲜辣椒叶片总核酸不同稀释倍数下的斑点杂交结果 Fig.4 Result of dot-hybridization from different dilution of total nucleic acid for dry and fresh leaves of pepper
采用快速提取法提取叶片总核酸,利用分子杂交技术可检测到稀释80 倍(约12.5μg 叶片)的总核酸样品(图5),说明利用快速提取法提取的总核酸可以作为分子杂交的核酸样品。尽管检测灵敏度略低,但其操作较简单,提取速度较快,实用性更高,其检测灵敏度可基本满足常规检测试验的需要。

图 5 快速提取法提取总核酸不同稀释倍数的斑点杂交结果 Fig.5 Result of dot-hybridization from different dilution of total nucleic acid via rapid extraction method
对探针的特异性进行初步分析,该探针未与测试的3 种植物病毒产生阳性杂交信号,说明制备的探针特异性较好。
3 结论与讨论
在本研究的检测体系中,新鲜叶片的检测灵敏度下限约为1.6μg,与王亚南等[13]的结果相近。本研究检测体系的检测灵敏度总体上比血清学方法的高,比常规RT–PCR 检测方法[13]的低,但分子杂交技术的稳定性高于RT–PCR,操作简单,适合大规模样本检测。
Sipahioglu 等[14]首次报道了高酚含量植物干燥叶片作为病毒RT–PCR 检测材料保存的技术体系(65℃干燥2 d 后保存于4℃,可常温运输),近来也有关于通过干燥后分离茶树、甘蔗叶片核酸的报道[15–16]。此外,在大豆花叶病毒(soybean mosaic virus, SMV)保存过程中,叶片干燥后可常温保存5~9 d[17]。Sipahioglu 等[14]的试材主要为木本植物,叶片较厚,而本研究中的辣椒为草本,叶片较薄,水分容易挥发,因而设定为37℃干燥1 d。干燥后的短期存放采取直接室温存放,结果显示该方法提取的核酸可有效应用于分子杂交。推测干燥过程可能降低了叶片中一些次级代谢产物的量,而次级代谢产物严重干扰核酸提取。干燥后的叶片中没有水分,保存过程中核酸相对不容易受到核酸酶的破坏,因而利于保存。尽管以干燥叶片为试材杂交检测的灵敏度略低,但仍可作为常规检测的试验材料,其优越性在于试验材料的保存、处理更为方便,可长距离运送至外地实验室进行病毒检测。
[1] Antignus Y,Lachman O,Pearlsman M,et al.A new pathotype of pepper mild mottle virus (PMMoV) overcomes the L4resistancegenotype of pepper cultivars[J].Plant Disease,2008,92:1033–1037.
[2] 向本春,谢浩,崔星明,等.新疆辣椒轻微斑驳病毒的分离鉴定[J].病毒学报,1994,10(3):240–245.
[3] Wang X,Liu F,Zhou G,et al.Detection and molecular characterization of pepper mild mottle virus in China[J]. Journal of Phytopathology,2005,154(11/12):755–757.
[4] 王亚南,赵绪生,袁文龙,等.辣椒轻斑驳病毒研究现状[J].安徽农业科学,2010,38(14):7401–7402.
[5] Velasco L,Janssen D,Ruiz-Garcia L,et al.The complete nucleotide sequence and development of a differential detection assay for a pepper mild mottle virus (PMMoV) isolate that overcomes L3resistance in pepper[J].J Virol Methods,2002,106:135–140.
[6] Colson P,Richet H,Desnues C,et al.Pepper mild mottle virus,a plant virus associated with specific immune responses,fever,abdominal pains,and pruritus in humans[J].Plos One,2010,5(4):e10041.doi:10.1371 /journal.pone.0010041.
[7] 郭京泽,刘鹏,崔铁军,等.辣椒种子中辣椒轻斑驳病毒的检测[J].检验检疫科学,2007 (6):32–33.
[8] Ikegashira Y,Ohki T,Ichiki U T,et a1.An immunological system for the detection of pepper mild mottle virus in soil fromgreen pepper fields[J].Plant Disease,2004,88(6):650–656.
[9] 陈青,余芳平,林石明,等.进境辣椒种子中检测出辣椒轻斑驳病毒[J].植物检疫,2005,19(5):295–296.
[10] 郑敏.辣椒轻斑驳病毒的鉴定及基因组分析[D].哈尔滨:东北林业大学,2013.
[11] 郑敏,郭世辉,张娜娜,等.利用RT–PCR 技术检测辣椒轻斑驳病毒的研究[J].北方园艺,2012(24):127–129.
[12] 李丽丽,杨洪一.草莓斑驳病毒的分子杂交检测[J].湖南农业大学学报:自然科学版,2014,40(3):273–276.
[13] 王亚南,王锡锋.辣椒轻斑驳病毒检测方法的比较[J].中国植保导刊,2008(4):5–7.
[14] Sipahioglu H M,Usta M,Ocak M.Use of dried high-phenolic laden host leaves for virus and viroid preservation and detection by PCR methods[J].J Virol Methods,2006,137(1):120–124.
[15] Wongwarat T,Sakuanrungsirikul S,Theerakulpisut P. Effective methods of preserving SCWL-diseased sugarcane leaves forgenomic DNA extraction and molecular detection of phytoplasma[J].African Journal of Biotechnology,2011,53 (10):10871–10876.
[16] Jaiprakash M R,Pillai B,Venkatesh P,et al.RNA isolation from high-phenolic freeze-dried tea (Camellia sinensis) leaves[J].Plant Molecular Biology Reporter, 2003,21(4):465–466.
[17] 李华伟.大豆花叶病毒保存方法及安徽省大豆主产区SMV 株系动态变化的研究[D].南京:南京农业大学,2010.

