马铃薯光响应StR2R3–MYB1 基因的克隆与表达分析
秦玉芝,邢铮,潘妃,熊兴耀,2*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.中国农业科学院蔬菜花卉研究所,北京 100081)
植物MYB 类转录因子以含有MYB 结构域为共同特征[1]。每个MYB 结构域以螺旋–转角–螺旋(helix–tum–helix,HTH)的形式结合于目标DNA 大沟处,调控目的基因的转录[2]。第1个植物myb 基因ZmMYBc1 是Paz–Ares 于1987年在玉米中发现的,ZmMYBc1 与动物myb 基因的同源性达40%[3]。不同作物中myb 基因的数量各异,在玉米中表达的myb 基因约有80个以上[4],拟南芥中MYB 类转录因子有129个[5],马铃薯中MYB 类转录因子有117个。MYB 类转录因子中以R2R3–MYB 的数量最多,其功能涉及植物次生代谢调控、细胞形态发生、激素刺激和环境胁迫应答、分生组织形成及细胞周期控制等过程[6]。关于马铃薯MYB 类基因克隆和功能分析的报道尚少。在前期研究中,笔者发现了1个受光影响,并且对马铃薯花青素合成关键酶StCHS 基因表达具有明显正向作用的MYB 转录因子(GenBank: DQ917781.1)[7],本研究中通过同源克隆,在马铃薯原始栽培种Yan 中获得了该转录因子(StR2R3– MYB1)的完整CDS 序列,并运用现代生物信息学技术对马铃薯StR2R3–MYB1 基因序列和蛋白质序列特征进行了比对、分析和预测,对基因表达的亚细胞定位、组织表达特异性及光照应答模式进行了分析,现将结果报道如下。
1 材料与方法
1.1 材料
马铃薯原始栽培种 Yan(S. tuberosum subsp. andigena var. yanacochense)由湖南农业大学马铃薯工程技术中心种质资源库提供。拟南芥原生质体由湖南大学生命科学与技术研究院刘选明先生惠赠。表达载体pEGAD、pEGAD–MYC、PA7–YFP、大肠杆菌DH5α、农杆菌菌种Agl–0 均由湖南大学生命科学与技术研究院刘选明先生惠赠;T 载体pGM–T 购自天根生化公司。
1.2 方法
1.2.1 基因的克隆
根据表1 设计的引物,以由RNA 逆转录所得cDNA 为模板进行RT–PCR 。

表1 StR2R3–MYB1 克隆引物 Table 1 Primer sequences for StR2R3–MYB1 cloning
1.2.2 序列生物信息学分析的相关网站和软件
马铃薯基因组数据库网站:http://www. potatogenome.net/index.php/Main_Page。
蛋白结构域分析网站:http://www.Ncbi.nlm.nih.gov/。
转录调控区域元件分析网站:PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。
蛋白一级结构预测网站:ProtParam(http://web. expasy.org/protparam/)。
卷曲螺旋结构预测网站:COILSServer(http: //embnet.vital–it.ch/software/COILS_form.html)。
三级结构预测网站:SWISS–MODEL(http:// swissmodel.expasy.org/)。
跨膜区域分析网站:TMHMM(http://www.cbs. dtu.dk/services/TMHMM/)。
信号肽分析工具网站:SignalIP3.0(http://www. cbs.dtu.dk/services/SignalP/)。
亲疏水性分析网站:http://www.expasy.ch/cgi– bin/protscale.pl。
同源性分析采用GeneDoc 软件。进化树构建采用MEGA5.0 软件。
1.2.3 实时荧光定量PCR
定量PCR 反应程序:95℃预变性10min,95℃变性30 s,58℃退火30 s,72℃延伸20 s, 45个循环。
内参为ActinB。所有检测样品均设置3次重复。定量引物见表2。

表2 StR2R3–MYB1 实时荧光定量PCR 引物 Table 2 qPCR primer sequences for StR2R3–MYB1
1.2.4 拟南芥原生质体转化
取20μg 重组质粒,加入100 μL 拟南芥原生质体和110 μL PEG 溶液,混匀,放置30min。加入440 µL W5 溶液,23℃、750 r/min 离心1min。
1.2.5 光处理
新继代的组培苗置于黑暗、22℃培养箱中生长12 d,形成白化苗。将白化苗分别置于白光、蓝光、红光、远红光培养箱中,于放置后0、0.5、1、2、4、8、12、24 h 取样,–80℃保存。蓝光、红光、远红光和白光光源分别为LED–蓝光(波长为 470 nm),LED–红光(波长为 660 nm),LED–远红光(波长为740 nm)和白色荧光灯。
2 结果与分析
2.1 马铃薯StR2R3–MYB1 基因的克隆与同源性分析
经RT–PCR 扩增,获得1 条800 bp 的特异性片段。该片段包含1个全长798 bp 的CDS 序列,编码265个氨基酸长度的蛋白质,命名为StR2R3– MYB1。马铃薯StR2R3–MYB1 蛋白序列与番茄、茄子的同源性高达99%,与拟南芥MYB113 的同源性也在70%以上(图1~3)。
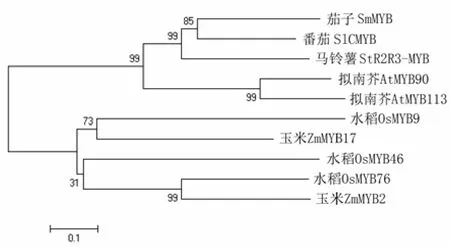
图1 StR2R3–MYB1 氨基酸序列系统进化分析结果 Fig. 1 Homology analysis for amino acid sequence of StR2R3 – MYB1

图2 StR2R3–MYB1 cDNA 序列与其氨基酸序列预测结果 Fig. 2 Prediction for cDNA and amino acid sequence of StR2R3–MYB1
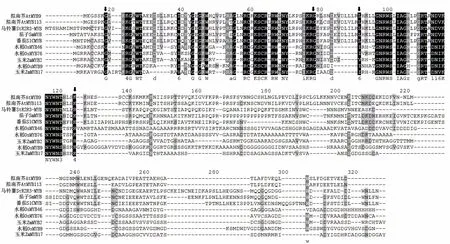
图3 StR2R3–MYB1 氨基酸序列同源性分析的结果 Fig.3 Homology analysis for amino acid sequence of StR2R3–MYB1
2.2 StR2R3–MYB1 蛋白序列结构的分析
StR2R3–MYB1 蛋白全长265 aa,主要氨基酸为天冬氨酸(9.8%)、亮氨酸(9.4%)、甘氨酸(7.5%)和谷氨酸(6.8%),正/负电荷残基数分别为32 和32,相对分子质量为30.23,分子式为C1316H2072N386O399S17,等电点为6.95,不稳定系数为47.52(>40),稳定性弱,没有跨膜信号,蛋白氨基酸序列不存在卷曲螺旋。StR2R3–MYB1 蛋白的疏水区域分布比较均衡,疏水性氨基酸多于亲水性氨基酸,但其N 端具有明显的亲水区域(图4)。
2.3 StR2R3–MYB1 核酸序列的结构
StR2R3–MYB1 基因位于马铃薯10 号染色体的51 749 197~51 750 359 bp,基因全长1 163 bp,由3个外显子和2个内含子构成。CDS 序列中含有2个DNA–结合结构域,分别位于第21~71 aa 和第74~122 aa,属于R2R3 类MYB 转录因子,将该基因命名为StR2R3– MYB1。对启动子顺式作用元件[8]进行分析的结果表明,StR2R3–MYB1 基因的调控区域存在大量与光相关的元件,如G–Box、Box4、BoxⅡ、I–Box、MNF1 等,还存在脱落酸诱导相关元件ABRE、生物钟相关元件Circadian 和茉莉酸甲酯相关元件CGTCA– motif (图5)。

图4 StR2R3-MYB1 蛋白疏水性/亲水性预测结果 Fig. 4 StR2R3-MYB1 protein hydrophobic/hydrophilic prediction
2.4 StR2R3–MYB1 蛋白的亚细胞定位分析
将构建好的StR2R3–MYB1 与YFP 融合蛋白表达载体转化拟南芥原生质体,在激光共聚焦扫描显微镜下观察基因的亚细胞定位情况,可见StR2R3–MYB1∷YFP 融合蛋白定位在细胞核内 (图6)。
2.5 StR2R3–MYB1 基因表达模式的分析
实时荧光定量PCR 分析结果显示,StR2R3– MYB1 在根、茎、叶的相对表达量依次升高(表3)。

表3 StR2R3–MYB1 基因在不同组织部位的相对表达量 Table 3 Gene expression pattern analysis for StR2R3–MYB1
2.6 光调节StR2R3–MYB1 基因的表达
黑暗培养12 d 的马铃薯白化苗转移至白光下生长0、0.5、2、4、8、12、24 h 的StR2R3–MYB1基因表达量随光处理时间的延长呈上升趋势(图7), StR2R3–MYB1 的表达受到了白光的诱导。分别用红、蓝和远红光处理白化苗后,3 种单色光都能诱导StR2R3–MYB1 的表达,其中远红光、蓝光诱导4 h 时,StR2R3–MYB1 的表达量出现第1个峰值,随后下降,在12 h 后回升。红光对StR2R3–MYB1 的诱导作用在8 h 后开始显现(图7)。

图7 光调节StR2R3–MYB1 基因的表达 Fig. 7 Expression of light regulationgene of StR2R3–MYB1
3 结论与讨论
在植物响应逆境胁迫的信号传导系统中,转录因子起着重要的作用。序列分析结果表明,马铃薯StR2R3–MYB1 与其他MYB家族转录因子在DNA 结合域具有高度保守性,属于典型的R2R3 类型MYB 转录因子。核苷酸序列和氨基酸序列分析结果表明,StR2R3–MYB1 的调控区域存在大量与光相关的元件,如G–Box、Box4、BoxⅡ、I–Box、MNF1等,还存在脱落酸诱导相关元件ABRE、生物钟相关元件Circadian、茉莉酸甲酯相关元件CGTCA。StR2R3–MYB1 的转录很可能受光信号及环境胁迫的诱导。StR2R3–MYB1 氨基酸序列上没有跨膜信号,不存在卷曲螺旋,具有明显的亲水区域,氨基酸残基与水分子的相互作用较强,表明该蛋白的稳定性较低。亚细胞定位分析发现StR2R3–MYB1 蛋白在细胞核中表达,这正符合转录因子的亚细胞定位特征。系统进化分析结果表明,StR2R3–MYB1 与拟南芥AtMTB113、AtMTB90 和茄子SmMYB 及番茄SlCMYB1 同属于1个亚族。该亚族MYB 转录因子的功能多数与花青素合成相关,如AtMTB113 与花青素积累有关[8–9],而AtMTB90 与色素合成相关[10],SmMYB 与花青素合成相关[11],SlCMYB1 则与冷诱导、低温胁迫相关[12]。笔者的前期研究[7]中运用多因子及其互作逐步回归法建立光照度、温度和处理时间影响基因表达的模式,发现环境温度与StR2R3–MYB1 和StPAL、StDFR 基因的表达量呈负相关,环境光照度与StR2R3–MYB1 和StCHS、StDFR的表达呈正相关。马铃薯StR2R3–MYB1 转录调节因子对StCHS 基因的表达具有明显正向影响。本研究中StR2R3–MYB1 蛋白结构分析、蛋白功能预测、基因组织表达特性分析及光处理后基因表达特性分析等研究结果,使前期研究中的推断StR2R3–MYB1 与受光和低温调节的马铃薯花青素合成相关[7]得到了进一步的印证。
[1] Thompson M A,Ramsay R G.Myb:An old onco protein with new roles[J].Bioessays,1995:17(4):341–350.
[2] Ogata K,Hojo H,Aimoto S,et al.Solution structure of a DNA–binding unit of Myb:A helix-turn-helix-related motif with conserved tryptophans forming a hydrophobic core[J].Proc Natl Acad Sci USA,1992,89(14):6428– 6432.
[3] Paz-Ares J,Ghosal D,Wienand U,et al.The regulatory c1 locus of zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators[J].EMBO J,1987,6(12):3553–3558.
[4] Rabinowicz P D,Braun E L,Wolfe A D,et al.Maize R2R3-Myb genes : Sequence analysis reveals amplification in the higher plants[J].Genetics,1999,153(1):427–444.
[5] Yanhui C,Xiaoyuan Y,Kun H,et al.The MYB transcription factor superfamily of Arabidopsis :Expression analysis and phylogenetic comparison with the rice MYB family[J].Plant Mol Biol,2006,60(1):107–124.
[6] Knight H,Trewavas A J,Knight M R.Calcium signalling in Arabidopsis thaliana responding to drought and salinity[J].Plant J,1997,12(5):1067–1078.
[7] Qin Y Z,Tai G,Xie K Y,et al.Ambient light atersgene expression pattern of enzymes and transcription factor involved in phenylpropanoid metabolic pathway in potato under chilling stress[J] . Agricultural Science & Technology,2014,15(11):1899–1904.
[8] Schwob E,Bohm T,Mendenhall M D,et al.The B–type cyclin kinase inhibitor p40SIC1 controls the G1 to S transition in S.cerevisiae [J].Cell,1994,79(2):233–244.
[9] Luo Q J,Mittal A,Jia F,et al.An autoregulatory feedback loop involving PAP1 and TAS4 in response to sugars in Arabidopsis[J].Plant Mol Biol,2012,80(1):117–129.
[10] Velten J,Cakir C,Cazzonelli C I.A spontaneous dominant-negative mutation within a 35S:AtMYB90 transgene inhibits flower pigment production in tobacco[J].PLoS One,2010,5(3):e9917.
[11] 邵文婷,刘杨,韩洪强,等.茄子花青素合成相关基因SmMYB 的克隆与表达分析[J].园艺学报,2013,40(3):467–478.
[12] 张欣,程治军,林启冰,等.番茄冷诱导基因SlCMYB1的克隆及其在水稻中异源表达研究[J].作物学报,2011(4):587–594.

