不同植物生长调节剂对猕猴桃单果重及营养成分的影响
张慧,刘世彪 ,唐元桂,刘万云
(1.吉首大学 a. 植物资源保护与利用湖南省高校重点实验室 b. 武陵山猕猴桃研究中心,湖南 吉首416000;2.永顺县鸿丰猕猴桃专业合作社,湖南 永顺 416700)
猕猴桃果实营养丰富,素有“水果之王”之称,虽然其盛果期的产量可达3 000~5 000 kg/(667 m2),但果农仍试图通过植物生长调节剂的刺激,增大果实,提高产量。CPPU[N–(2–氯–4–吡啶基)–N–苯基脲],中文名氯吡脲,俗称“大果灵”或“膨大剂”,属细胞分裂素类物质,它可以通过增加果肉细胞的数量和体积来增加果重,提高产量[1–3],已被果农普遍应用于生产。但是,CPPU的滥用已给猕猴桃产业带来了一系列的负面影响,除降低果实甜度和风味,增加畸形果比率和树体早衰外,还会加快果实的软化和腐烂速度,导致烂果率上升[4],诱发冬芽提前萌发而影响来年结果[5]等问题。2002—2003年,陕西省的果农在生产中广泛使用包括苄基腺嘌呤、赤霉素和2,4–D等成分在内的果实膨大剂,给猕猴桃的贮藏和销售带来了灾难性后果[6]。6–BA(6–苄基腺嘌呤)是人工合成的细胞分裂素,NAA(萘乙酸)是人工合成的生长素,都具有促进细胞分裂、防止落花、落果等生理功能。GA3(赤霉酸)是赤霉素类物质,除具有促进细胞分裂和生长、打破休眠的功能外,还能促单性结实。目前,有关CPPU对猕猴桃作用的研究较多,而对于6–BA、NAA、GA3与猕猴桃生长关系的报道极少。笔者就猕猴桃花后幼果期施加CPPU及不同浓度的6–BA、NAA和GA3对成熟果实营养成分的影响进行了研究,以期为氯吡脲、6–苄基腺嘌呤、萘乙酸和赤霉酸在猕猴桃生产中的合理使用提供依据。
1 材料与方法
1.1 材料与试剂
以吉首市马颈坳镇振武营村猕猴桃种植园中的‘米良一号’为研究材料。
氯吡脲(成都施特优化工有限公司,粉剂,纯度>99%);6–苄基腺嘌呤、萘乙酸和赤霉酸(天津市光复精细化工研究所,粉剂,纯度>99%);氢氧化钠、酚酞、蒽酮、浓硫酸、浓硝酸、牛血清蛋白、考马斯亮蓝G–250、无水乙醇、85%磷酸、草酸、抗坏血酸、NaHCO3、2,6–二氯酚靛酚、30%双氧水等均为分析纯。
1.2 仪器与设备
PAL–1数显手持便携式折光仪(日本爱宕公司);7230G型可见光分光光度计(上海舜宇恒平科学仪器有限公司);LD5–2A型离心机(无锡市龙泰化工机械设备有限公司);KQ–250E型超声波清洗器(昆山市超声仪器有限公司);ATN–300型全自动凯氏定氮仪(上海洪纪仪器设备有限公司);EXCEL2010型智能微波消解仪(上海屹尧仪器科技发展有限公司);Thermo scientific iCAP 6000 电感耦合等离子体光谱仪(美国赛默飞世尔科技公司)。
1.3 方法
于2013年5月中旬,在吉首市马颈坳镇振武营村猕猴桃种植园中选取4年生、健康、长势均匀的猕猴桃果树,用清水作对照(CK),CPPU质量浓度为12.50mg/L,6–BA、NAA和GA3(各设3个质量浓度50,100,200mg/L),每种植物生长调节剂的每个浓度为1个处理,共计11个处理。于猕猴桃花后2周,每个处理浸泡一棵树上的所有幼果。每个幼果浸泡2 s。于果实成熟期(2013年10月初)采摘后储存于0.5~1℃冰箱中,2014年2月取出,自然软熟后供作测试。用于猕猴桃单果重和果形指数检测的样本为每处理组随机选取的90个果实;用于营养成分分析和矿质元素测定的样本为每处理组随机选取的3个果实,去皮后切碎混匀进行试验。试验重复3次,结果取平均值。
1.4 项目测定与方法
用电子天平称量猕猴桃单果鲜重;用数码游标卡尺测量鲜果的纵径和横径。果形指数=纵径/横径。采用数显手持便携式折光仪测定可溶性固形物;按GB/T5009.3—2003《食品中水分的测定》检测水分;按GB/T 6195—1986《水果、蔬菜V–C 含量测定法》中的2,6–二氯酚靛酚滴定法检测V–C;按GB/T 12456—2008《食品中总酸的测定方法》检测可滴定酸,以柠檬酸计;按GB/T5009.5—2010《食品中蛋白质的测定》中的微量凯氏定氮法检测蛋白质;采用蒽酮比色法测定可溶性总糖;采用电感偶合等离子体质谱法测定矿质元素。除矿质元素检测使用80℃烘干恒重后的样品外,其余项目均为鲜样。
1.5 数据处理
所有数据用SPSS Statistics 17.0 统计软件进行差异显著性分析。
2 结果与分析
2.1 植物生长调节剂对猕猴桃单果重和果形指数的影响
表1 表明,与对照(CK)、6–BA 和NAA 相比,12.5mg/L 的 CPPU 处理能显著地增加单果重,比对照增产66.51%。与GA3比较,CPPU 处理比200mg/L GA3处理的单果重显著增加,比50、100mg/L GA3处理的单果重有所增加,但差异没有统计学意义。随6–BA 处理浓度增加,单果重增加,200mg/L时比对照增产18.10%,但未达显著水平。NAA 浓度与单果重具有正相关关系,各浓度下的单果重都显著高于对照,200mg/L 时比对照增产40.83%。GA3处理的增重效果比6–BA 和NAA 更明显,100mg/L 时比对照增产45.16%,但200mg/L 相对下降,表现出高浓度抑制现象。总体来看,12.5mg/L 的 CPPU 处理的增重效果最好,GA3和NAA 的增重效果强于6–BA。
‘米良一号’猕猴桃果实为长圆柱形,与对照相比,果形指数不因CPPU 处理而变化,但随着6–BA处理浓度的升高而降低,果实变短。50mg /L 的NAA 处理对果形指数的影响没有统计学意义,而中、高浓度的NAA 使果形指数显著增加,果实变长。中、低浓度的GA3对果形指数的影响没有统计学意义,200mg/L 时果形指数显著增加。总体来看,CPPU 不影响果实的外形,低浓度的6–BA 以及高浓度的NAA 和GA3会使果形指数增加,果实变长。
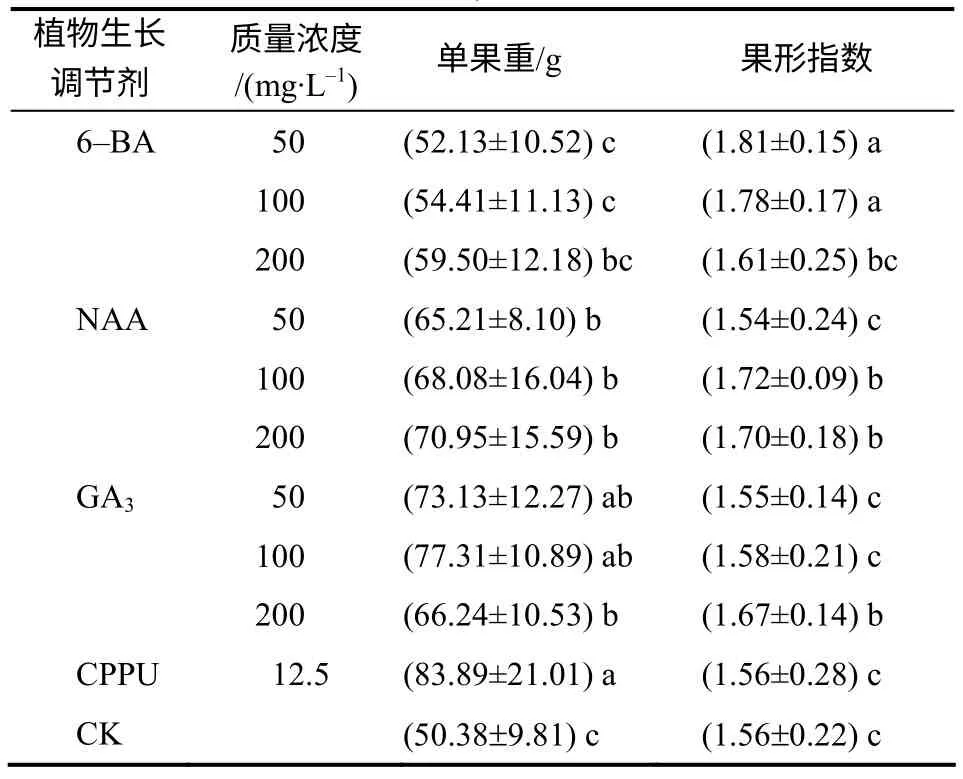
表1 植物生长调节剂处理下猕猴桃的单果重和果形指数 Table 1 Fruit weight and fruit shape index of kiwifruit by application of CPPU, 6–BA, NAA and GA3
2.2 不同植物生长调节剂对猕猴桃果实营养成分的影响
表2显示,与对照相比,CPPU处理对猕猴桃果实水分含量没有显著影响。随着6–BA质量浓度的递增,果实含水量有递增的趋势,但各浓度间及与对照间的差异没有统计学意义。随NAA浓度的提高,果实含水量逐渐下降,但各浓度间及与对照间的差异没有统计学意义。GA3的各浓度处理间及与对照间的差异没有统计学意义。综合认为,生长调节剂处理对猕猴桃果实含水量没有显著影响。
各处理都可使猕猴桃可溶性固形物不同程度地增加,其中,CPPU、100mg/L 6–BA和100mg/L GA3处理、3个浓度的NAA处理都能显著提高可溶性固形物含量。
12.5 mg/L CPPU处理的可溶性糖含量比对照有所增加,但不显著。可溶性糖含量随6–BA处理浓度增加而增加,200mg/L时达显著水平。NAA的处理也有相似变化趋势,100mg/L和200mg/L NAA处理的可溶性糖含量显著高于对照。50.0mg/L GA3处理能显著提高可溶性糖含量,但100mg/L和200mg/L GA3处理的可溶性糖含量逐渐下降。以上数据表明,CPPU、6–BA和GA3的增糖效果不显著,NAA的增糖效果显著。
12.5mg/L CPPU处理果实的可滴定酸含量显著低于对照。6–BA处理也能显著降低可滴定酸含量,且可滴定酸含量与6–BA浓度呈正相关关系。NAA处理果实的可滴定酸含量与对照无显著差异,但均高于其他处理组。GA3处理的可滴定酸含量显著低于对照,且有随浓度增加而增加的趋势。综合来看,除NAA外的处理组都能显著降低果实的可滴定酸含量。由于4种生长调节剂能够普遍提高糖的含量而降低酸的含量,因此其糖酸比普遍提高。
12.5 mg/L CPPU处理能显著地提高蛋白质含量。6–BA处理也能显著地提高蛋白质含量,200mg/L时达最高值。NAA和GA3处理的蛋白质含量在200mg/L时最高。综合认为,施用生长调节剂能够促进猕猴桃蛋白质含量的显著提高。
与对照相比,12.5mg/L CPPU处理使果实V–C含量显著减少。V–C含量与6–BA和GA3浓度呈正相关关系,中、高浓度时显著高于对照,而与NAA浓度呈负相关关系,50mg/L和100mg/L浓度处理时显著高于对照。综合来看,CPPU处理会降低果实的V–C含量,其他处理可增加V–C含量,其中50mg/L NAA处理的V–C含量最高。
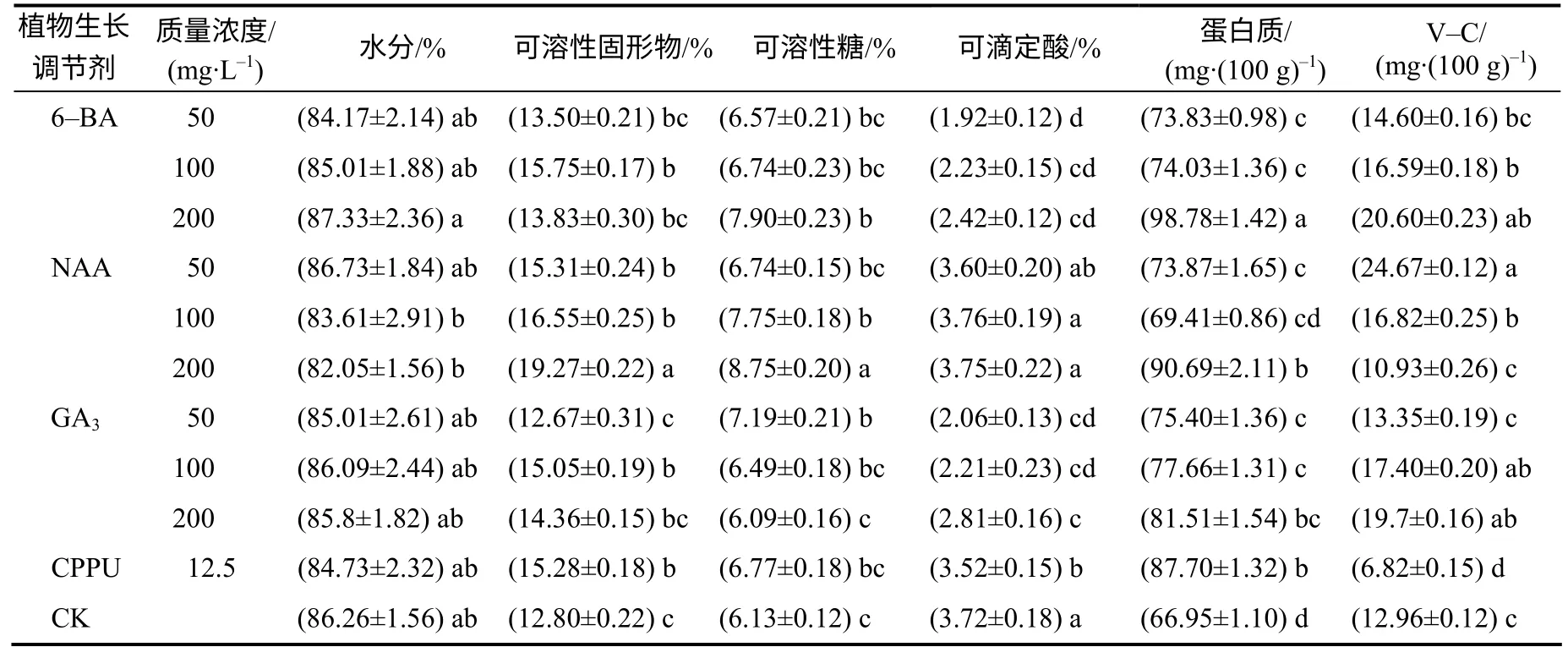
表2 植物生长调节剂处理下猕猴桃果实的营养成分含量 Table 2 Nutritional components and contents of kiwifruit by application of CPPU, 6–BA, NAA and GA3
2.3 植物生长调节剂对猕猴桃果实矿质元素含量的影响
从表3可看出,与对照相比,12.5mg/L CPPU处理果实中的Ca、P和Mg的含量显著提高,B的含量显著下降,其他元素上升或下降的数值不显著。3种浓度的6–BA处理,使果实的K含量显著下降,Ca和Mg含量显著上升,B含量有上升的趋势,Fe含量变化不明显,而其他元素含量变化没有稳定的相关关系。3种浓度的NAA处理,使果实的K含量显著下降,Ca和Mg含量显著上升,100mg/L和200mg/L NAA处理使B含量具有上升的趋势,使Mn含量具有下降的趋势,NAA处理与其他元素含量变化的关系不明确。3种浓度的GA3处理使果实的K含量显著下降,Ca、P和Mg的含量上升,除低、中浓度GA3对Mg的影响不显著外,其余浓度GA3处理的K、Ca、P和Mg的含量均显著高于对照,且Ca和Mg的含量随施加浓度上升而上升,P的含量随施加浓度上升而下降。GA3对Cu有促进积累的趋势,对Zn和B没有显著影响。

表3 植物生长调节剂处理下猕猴桃果实的矿质元素含量 Table 3 Contents ofmineral elements of kiwifruit by application of CPPU, 6–BA, NAA and GA3
3 结论与讨论
CPPU作为植物生长调节剂被广泛应用于各类果树生产中,在欧盟、美国、新西兰等地的猕猴桃栽培中均有使用。Iwahori 等[7]报道施用CPPU能促进猕猴桃果实的增大,且花后3周比花后立即施用效果更好。Antognozzi等[2]用20mg/L CPPU喷施猕猴桃,可比对照增产25%。有人用5mg/L CPPU处理花后3周的幼果,发现浸果组可增产43%,喷果组增产33%[3]。方金豹等[8]用5~40mg/L的CPPU各级浓度处理可使猕猴桃果实增产20%~190%。本试验中CPPU处理能使果重增加66.51%,效果显著。关于CPPU促进果实增大的原因,Cruz–Castillo等[1]认为这是由于果实外果皮的细胞数量增多造成的。Patterson等[3]则认为主要是由于外果皮中的等径小薄壁细胞的体积增大引起的,而其中的卵形大薄壁细胞体积不受影响。郭洋洋等[9]认为猕猴桃果实的中介体复合物亚基25基因(AcMED25)可能抑制果实生长,如在果实快速生长期其表达水平高,则果实生长慢,而CPPU处理的AcMED25的表达水平极低,因而果实生长加快,这就暗示CPPU可能是通过抑制AcMED25的表达而发挥增产功能。值得注意的是,虽然CPPU可促使果实增大,但其中的水分含量并无显著变化,这表明果实的增大也包括了干物质的积累,即干物质比重不受影响。
本试验中CPPU对果实外形没有影响。CPPU通过增加淀粉的积累,提高ADP–葡萄糖焦磷酸化酶的活性,进而增加可溶性糖含量[2],合适浓度的CPPU处理可以得到较多的可溶性固形物和较少的可滴定酸[7,10]。有报道称,在5~20mg/L范围内CPPU处理的果实V–C含量显著高于对照,但进一步增加CPPU的浓度,V–C含量逐渐下降[11–12]。本研究中CPPU处理可显著增加Ca、P和Mg的含量,显著降低B的含量。其余3种生长调节剂处理均能增加果实的单果重,但增重效果存在差异。6–BA处理能显著增加果形指数、可溶性固形物、蛋白质、V–C、Ca和Mg的含量,显著降低可滴定酸和K含量,对可溶性糖有促进积累趋势。有研究[13]表明,50、100mg/L的NAA处理不会对猕猴桃造成明显的落花落果,但200mg/L处理时会对树体产生高度毒害作用,造成落叶和7.35%的落果。
本试验结果显示,NAA处理不同程度地增加了果形指数、可溶性固形物、可溶性糖、蛋白质和V–C含量,但对可滴定酸含量的影响不明显。NAA还可增加Ca和Mg的含量,降低K含量。有报道,盛花前6~8周对萌芽和嫩梢涂刷100mg/L的GA3,会增大果形指数,并使果梗增长[14]。本试验中、低浓度GA3处理对果形指数无明显影响,高浓度(200mg/L)时果型指数显著增大。GA3能提高果实可溶性固形物、总糖和有机酸含量,降低V–C含量[15]。本试验中,GA3可增加可溶性固形物、蛋白质和V–C含量,降低可滴定酸含量,但对可溶性糖的增加效果不明显。GA3能使果实中的Ca、P和Mg的含量增加,K的含量下降。马蜂旺等[16]研究认为,在花期和幼果期喷施0.5%CaCl2可以提高猕猴桃果实的Ca含量,增加果实贮藏性。在采后用5%CaCl2与10mg/L的NAA混合液处理果实,也能延长贮藏期[17]。本试验中的4种生长调节剂均能显著提高猕猴桃的Ca含量,也意味着它们具有增强果实贮藏性能的潜力。目前,有关施用植物生长调节剂与猕猴桃果实中矿质和微量元素的积累关系还不清楚,还有待进一步研究。
综合来看,适宜浓度的植物生长调节剂能够提高猕猴桃单果重、糖分和蛋白质以及Ca等营养指标的含量,降低酸值,如果其残留量符合国家标准,在生产上是可以施行的。
[1] Cruz-Castillo J G,Woolley D J,Lawes G S.Kiwifruit size and CPPU response are influenced by the time of anthesis[J].Scientia Horticulturae,2002,95(1/2):23–30.
[2] Antognozzi E,Battistelli A,Famiani F, et al.Influence of CPPU on carbohydrate accumulation and metabolism in fruits of Actinidia deliciosa (A.Chev.)[J].Scientia Horticulturae,1996,65(1):37–47.
[3] Patterson K J,Mason K A,Gould K S.Effects of CPPU (N–(2–chloro–4–pyridyl)–N’–phenylurea) on fruitgrowth,maturity,and storage quality of kiwifruit[J]. New Zealand Journal of Crop and Horticultural Science,1993,21(3):253–261.
[4] 蔡金术,王中炎.低浓度CPPU 对猕猴桃果实重量及品质的影响[J].湖南农业科学,2009(9):146–148.
[5] 易春,王中炎,袁飞荣,等.大果灵在翠玉猕猴桃上应用效果的评价[J].湖南农业科学,2007(3):100–102.
[6] 刘兴华,郭井泉,罗安伟,等.果实膨大剂对陕西省猕猴桃产业负效应的调查分析[J].保鲜与加工,2004,4(1):30–31.
[7] Iwahor S,Tominaga S,Yamasaki T.Stimulation of fruitgrowth of kiwifruit(Actinidia chinensis Planch) by N–(2–chloro–4–pyridyl)–N'–phenylurea,a diphenylurea– derivative cytokinin[J].Scientia Horticulturae,1988,35(1/2):109–115.
[8] 方金豹,黄海,周润生,等.CPPU 对促进猕猴桃果实增大的研究I.CPPU 的使用尝试和方法[J].果树科学,1996,13(增刊):37– 41.
[9] 郭洋涛,林苗苗,齐秀娟,等.猕猴桃AcMED25 克隆、表达分析及其与果实生长和大小的关系[J].果树学报,2014,31(4):558–565.
[10] Kumar J,Thakur D.Effect of different concentration of CPPU and fruit thinning on yield and quality of kiwifruit cv. Allison and Hayward[J].Asian Journal of Horticulture,2013,8(2):701–705.
[11] 陈敏.生长调节剂和叶果比对红阳猕猴桃果实生长发育和品质影响的研究[D].雅安:四川农业大学,2009:26–31.
[12] 方金豹,黄海,周润生,等.CPPU 对促进猕猴桃果实增大的研究 II.CPPU对果实品质的影响和连年使用对果实增大的效果[J].果树科学,1996,13(增刊):42–45.
[13] Thakur A,Chandel J S.Effect of thinning on fruit yield,size and quality of kiwifruit cv. Allison[J].Acta Horticulturae,2004,662:359–364.
[14] Burge G K,Spence C B,Broadbent N D.Effects ofgibberellic acid and paclobutrazol on fruit size,shape,locule number and pedicel length of kiwifruit[J].Scientia Horticulturae,1990,42(3):243–249.
[15] 尹翠波,周庆阳.GA3和CPPU 对猕猴桃果实发育及品质的影响[J].福建果树,2007(4):5–9.
[16] 马锋旺,李嘉瑞,王飞,等.猕猴桃果实矿质元素含量及其与贮藏性的关系[J].西北农业学报,1996,5(4):63–65.
[17] 高丽萍,陶汉之,程素贞,等.钙和萘乙酸对猕猴桃果实贮藏的影响[J].果树科学,1996,13(2):115–116.

