薇甘菊对鬼针草种子萌发和幼苗生长的化感影响
张英,吴爱平
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
薇甘菊(Mikania micrantha H.B.K.)是菊科假泽兰属(Mikania Willd)攀缘藤本植物[1],原产于中南美洲,是世界10大恶性杂草之一[2]。薇甘菊能攀爬到周围植物的树冠上,稠密的遮蓬使得生长于其下的植物不能进行光合作用而致死,因而被冠以“植物杀手”的称号[3]。20世纪80年代末至90年代初,薇甘菊传入中国广东沿海,现已蔓延至广东、海南和云南3省[4],对当地的森林、农田和果园造成了巨大的破坏,导致本地植物群落或生态系统物种多样性下降或丧失,影响了微生物群落和食物链的稳定性,甚至改变生态系统的营养循环[5]。研究表明,薇甘菊具有很强的化感作用[6–8]。笔者在野外观察到,薇甘菊的入侵地能见到另外一种入侵植物鬼针草(Bidens pilosa L.)植株,但并没有鬼针草新生幼苗的出现,因而比较了薇甘菊对入侵地和非入侵地鬼针草种子萌发和幼苗生长的化感影响,现将结果报道如下。
1 材料和方法
1.1 材料
2013年7月,从深圳大学校园(114° 04′ E, 22° 37′ N, 海拔62 m)收集约1.5 kg薇甘菊叶片,风干后研磨成粉。称取50g粉末放入装有1 L 蒸馏水的3 L烧杯中,在室温(25±3)℃下提取24 h后,用4层纱布过滤,得到质量分数为5%的提取液,调节提取液的pH值至7.0,密封放入4 °C冰箱中保存,备用。入侵地鬼针草种子采自薇甘菊入侵地(半径为50 m的范围以内),非入侵地鬼针草种子采自薇甘菊入侵地周边20 m的地带。
1.2 方法
参照文献[9–11],测定薇甘菊对鬼针草种子和幼苗生长的影响。
1.2.1 鬼针草种子萌发试验
设入侵地对照组(CK1–In)、入侵地处理组(TR1–In)、非入侵地对照组(CK1)和非入侵地处理组(TR1)。每个培养皿(直径9 cm)内预先铺垫2层滤纸,加入50粒经消毒的鬼针草种子,再加入5mL薇甘菊提取液(对照加蒸馏水),加盖密封后,置于光照14 h,白天温度为28 °C,晚上温度为20 °C,相对湿度>75%的培养箱中,进行萌发试验,5个重复。鬼针草种子胚根突破种皮2 mm判定为种子萌发,每天记录萌发数。每个培养皿第1粒种子萌发的时间记为初始萌发时间(IGT)。种子的萌发速率(GR)参照文献 [12]方法计算。至连续3 d都没有种子再萌发时,即萌发15 d后终止。每个处理选取最具代表性的24株幼苗,测量株高(SL)和幼根的长度(RL)。所有的数据都转换成与对照的百分比。
1.2.2 鬼针草幼苗生长试验
从入侵地和非入侵地对照组中分别选取24株鬼针草健壮幼苗,每株幼苗植入表面积为120 cm2、装有0.8 kg石英砂的塑料培养钵内。设4个处理,分别为入侵地对照组(CK2–In)、入侵地处理组(TR2–In)、非入侵地对照组(CK2)和非入侵地处理组(TR2),每个处理重复12次,共48个重复。4 d后,每个培养钵加入10mL标准霍格兰氏(Hoagland)营养液以补充幼苗生长所需营养,以后每隔1周补充同样体积的营养液,共补充4次。在每次补充营养液后的第3天,加入15mL薇甘菊提取液(对照加蒸馏水)进行化感处理。第5周收获鬼针草幼苗。用荧光仪(PAM–101, Walz, Effeltrich,德国)测定叶绿素荧光。暗适应30min后,测定每株幼苗第一片真叶的最小荧光(F0),同时打开饱和脉冲光照射以测定叶片的最大荧光(Fm)。光系统Ⅱ(PSⅡ)的最大量子产额即Fv/Fm参照文献[13]计算得来。每株幼苗的总叶面积用扫描仪(Epson Perfection 4870 Photo)扫描后,再用分析软件(WinFOLIA 2004a, Regent Instruments Inc., Qúebec, Canadamachine)计算其总面积。将植株的地下部和地上部分别置于80 °C烘箱中72 h连续烘干后称重。总叶面积(LA)、Fv/Fm、根重(RW)和冠重(SW)都转换成与对照的百分比。
1.3 数据处理
用简单方差分析(ANOVA)比较薇甘菊提取液对鬼针草种子萌发和幼苗生长的影响差异(SPSS 13.0),用显著极差法在95%置信度水平上进行检验。
2 结果与分析
2.1 薇甘菊对鬼针草种子萌发的影响
薇甘菊提取液对鬼针草种子的萌发率、初始萌发时间、萌发速率、根长和株高都有抑制作用(图1,图2)。方差分析显示,薇甘菊提取液对非入侵地鬼针草种子萌发的的抑制作用大于对入侵地的(图2,F=5.42, P=0.043);非入侵地对照与处理间鬼针草种子的萌发率、初始萌发时间有差异,入侵地对照与处理间鬼针草种子的初始萌发时间有差异,萌发率、萌发速率、根长和株高差异没有统计学意义。
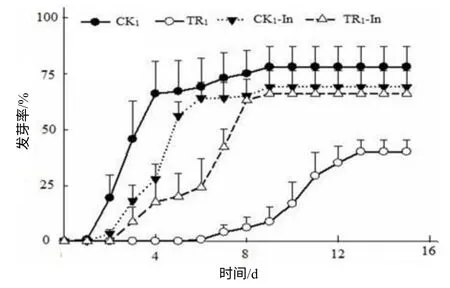
图1 薇甘菊提取液处理鬼针草种子的萌发率 Fig.1 Seedgermination percentage of B. pilosa treated with extracted fluid from M. micrantha
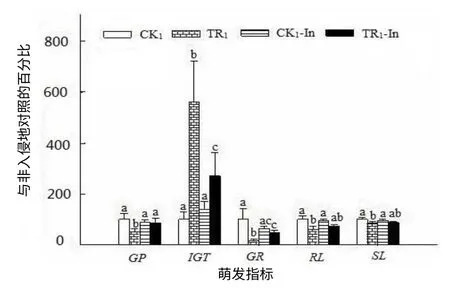
图2 薇甘菊提取液处理的鬼针草种子的萌发指标 Fig.2 Seedgermination indices of B. pilosa treated with extracted fluid from M. micrantha
2.2 薇甘菊对鬼针草幼苗生长的影响
薇甘菊提取液对鬼针草幼苗总叶面积、Fv/Fm和冠重都没有明显的抑制作用,仅对非入侵地鬼针草幼苗的根重有抑制作用,入侵地处理与对照间鬼针草幼苗的根重没有差别,非入侵地鬼针草幼苗的根重在处理与对照间存在差别(图3,F=1.915,P=0.216)。
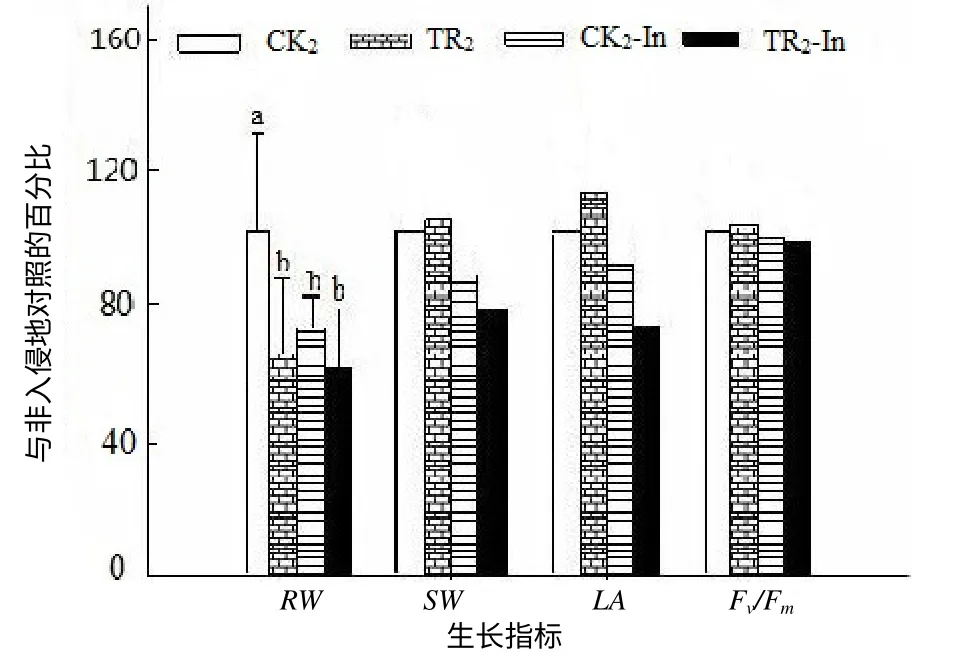
图 3 薇甘菊提取液处理的鬼针草幼苗的生长指标 Fig.3 Seedlinggrowth indices of B. pilosa treated with extracted fluid from M. micrantha
3 小结与讨论
本试验结果表明,薇甘菊提取液处理非入侵地鬼针草种子的萌发率为52%,入侵地鬼针草种子的萌发率为60%,说明薇甘菊对非入侵地鬼针草种子萌发的化感影响大于对入侵地的;薇甘菊对鬼针草幼苗总叶面积、Fv/Fm和冠重都没有抑制作用,非入侵地处理与对照的鬼针草幼苗的根重分别为23.50g和36.92g,入侵地鬼针草幼苗的根重分别是22.19g和16.53g,表明薇甘菊对非入侵地鬼针草幼苗的根重的影响大于对入侵地的,入侵地鬼针草种子及其幼苗都对薇甘菊具有一定的化感抗性。在入侵地存活下来的鬼针草,不仅能忍受薇甘菊的化感作用,而且其种子也对薇甘菊有一定的抗性,说明鬼针草是在抵制薇甘菊入侵过程中选择性胜出的物种之一。
薇甘菊提取液对鬼针草幼苗生长的影响不明显,这与 Callway等[14]得到的结果不一致。笔者发现,非入侵地处理和对照鬼针草幼苗的根重存在较大的差异,而入侵地处理和对照鬼针草幼苗的根重差异没有统计学意义,这说明入侵地鬼针草的幼苗对薇甘菊的水浸液有一定的抗性。本试验的结果在一定程度上受到不同来源的母体种子的影响,薇甘菊提取液对入侵地和非入侵地鬼针草种子萌发和幼苗生长的抑制作用模式是相似的。根据试验结果,可以预见在薇甘菊化感作用及其竞争作用的长期选择下,一些本地物种能够在薇甘菊入侵地重新生存并与薇甘菊共存甚至达到某种生态平衡。
[1] 孔国辉,吴七根,胡启明.外来杂草薇甘菊(Mikania micrantha H.B.K.)在我国的出现[J].热带亚热带植物学报,2000,8(1):27–28.
[2] Holm L G,Plucknett D L,Pancho J V,et al.The World’s Worst Weeds:Distribution and Biology[M].Honolulu,USA:University Press of Hawaii,1977.
[3] Huang H,Ye W,Wu P,et al.New sesquiterpene dilactones from Mikania micrantha[J].Journal of Natural Product,2004,67:734–736.
[4] 杜凡,杨宇明,李俊清,等.云南假泽兰属植物及薇甘菊的危害[J].云南植物研究,2006,28(5):505–508.
[5] Zhang L Y,Ye W H,Cao H L,et al.Mikania micrantha H.B.K.in China:An overview [J].Weed Research,2004,44:42–49.
[6] Ismial B S,Mah L S.Effects of Mikania micrantha H. B. K.ongermination andgrowth of weed species[J].Plant and Soil,1993,157:107–113.
[7] Ni G Y,Song L Y,Zhang J L,et al.Effects of root extracts of Mikania micrantha H.B.K.on soil microbial community[J].Allelopathy Journal,2006,17:247–254.
[8] Wu A P,Yu H,Gao S Q,et al.Differential belowground allelopathic effects of leaf and root of Mikania micrantha[J].Trees-Structure and Function,2009,23:11–17.
[9] Ahn J K,Chung I M.Allelopathic Potential of rice hulls ongermination and seedlinggrowth of barnyardgrass[J]. Agronomy Journal,2000,92:1162–1167.
[10] Bousquet-Mélou A,Louis S,Robles C,et al.Allelopathic potential of Medicago arborea,A mediterranean invasive shrub[J].Chemoecology,2005,15:193–198.
[11] Oueslati O,Ben-Hammouda M,Ghorbal M H,et al. Barley autotoxicity as influenced by varietal and seasonal variation[J].Journal of Agronomy and Crop Science,2005,191:249–254.
[12] Saxena A,Singh D V,Joshi N L.Autotoxic effects of pearl millet aqueous extracts on seedgermination and seedlinggrowth[J].Journal of Arid Environments,1996,33:255–260.
[13] Demmigadams B,Adams W W,Barker D H,et al.Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J].Physiologia Plantrarum,1996,98:253– 264.
[14] Callaway R M,Ridenour W M,Laboski T,et al.Natural selection for resistance to the allelopathic effects of invasive plants[J].Journal of Ecology,2005,93:576–583.
[15] Turk M A,Shatnawi M K,Tawaha A M.Inhibitory effects of aqueous extracts of black mustard ongermination andgrowth of alfalfa[J].Weed Biology and Management,2003,3:37–40.
[16] Perry L G,Johnson C,Alford E R,et al.Screening ofgrassland plants for restoration after spotted knapweed invasion[J].Restoration Ecology,2005,13:725–735.

