异樟叶精油及其主成分含量的动态变化研究
胡文杰,江香梅,杨海宽
(1.江西省林业科学院国家林业局樟树工程技术研究中心,江西 南昌 330032;2.井冈山大学生命科学学院,江西 吉安 343009)
樟树(Cinnamum camphora (L.)Presl.)为樟科(Lauraceae)樟属植物,是常绿高大乔木,集药用、用材和观赏等多种价值于一身。樟树精油是樟树的一种主要次生代谢物。樟树精油所含的化学物质主要有芳樟醇、樟脑、1,8–桉叶油素、柠檬醛、龙脑、异橙花叔醇和黄樟油素等[1]。据文献[2–3]记载,植物精油所含的化学成分大多数是化工、食品、医药和香料等工业的重要原料,具有重要的开发利用价值。按照叶精油中所含主成分的不同,可将樟树划分成脑樟(主含樟脑)、芳樟(主含芳樟醇)、油樟(主含桉叶油)、异樟(主含异橙花叔醇)和龙脑樟(主含右旋龙脑)5 种化学型[4]。目前,国内外有关异樟的研究文献非常少,仅见于异樟精油的抑菌活性[5]及其化学成分[5–7]的报道。笔者对异樟叶精油及其主要成分含量进行研究,探索异樟生长期叶精油及其主要成分含量的动态变化规律,以期为异樟的资源开发利用提供理论依据。
1 材料与方法
1.1 供试异樟
采用闻香法,在异樟自由授粉群体中,按叶精油中主要化学成分的含量,对3 000余个单株进行初步化学分类,作好分类记录。再从异樟中随机选择100个单株进行标记和编号,作为固定取样株,绘出位置图,同时建立取样档案。
1.2 样品的采集
每个单株分别于1、3、5、7、9、11月(即不同生长期)的中旬,分别在同部位的东、西、南、北、中不同方位采集叶片,并充分混合,每棵树每次采样不少于500g。叶样采集后做到随采随蒸馏,以免叶精油挥发。
1.3 叶精油的提取
准确称取异樟新鲜叶200g,采用水蒸气蒸馏法提取叶精油。提取按照优化出的条件(预试验结果,提取时间为65min,水料比为 2 500mL︰200g,加热功率1 200 W 时提取率最大)进行,收集精油,并计算精油含量(以质量分数计)。
1.4 叶精油主成分含量的检测
采用Perkin Elmer Clarus 680 型气相色谱仪和Perkin Elmer Clarus 600C 型质谱仪对提取的叶精油进行主成分含量检测。色谱柱为Elite–5 MS,石英毛细管柱 30 m × 0.25 mm,0.25 μm。色谱升温程序为:进样口温度 280℃,柱温 50℃保持 2min,以3 ℃/ min升至 140℃,保持 2min,再以 15℃/ min 升至 280℃,保持 10min,共运行 53min,载气为He, 流速 1.0mL/min,进样量 0.5 μL,分流比 10∶1。质谱条件为:EI–MS,EI 离子源温度 180℃,接口温度260℃,扫描范围(m/z) 50~600。
1.5 质谱检索及数据处理
采用Nist 谱库、文献检索和人工解析等方法,鉴定精油中的各种成分;利用峰面积归一法计算出各成分的相对含量;采用SPSS 软件进行方差分析,得油率(%)作arcsin变换。
2 结果与分析
2.1 异樟叶平均含油量的动态变化
由表1 可以看出,异樟叶平均含油量年变化分为2个阶段:一是3—9月呈逐渐增加的趋势;二是9月后至下一个生长期到来之前的1月,呈逐渐下降的趋势。9月叶平均含油量最高(0.51%),是最低月份(1月)的1.89 倍,为最佳采集时期。不同月份异樟叶含油量方差分析结果(表2)显示,异樟叶不同月份平均含油量差异极显著(P=0.000 1),说明以叶含油量为指标进行最佳采收期的筛选,可以获得显著选择效果。
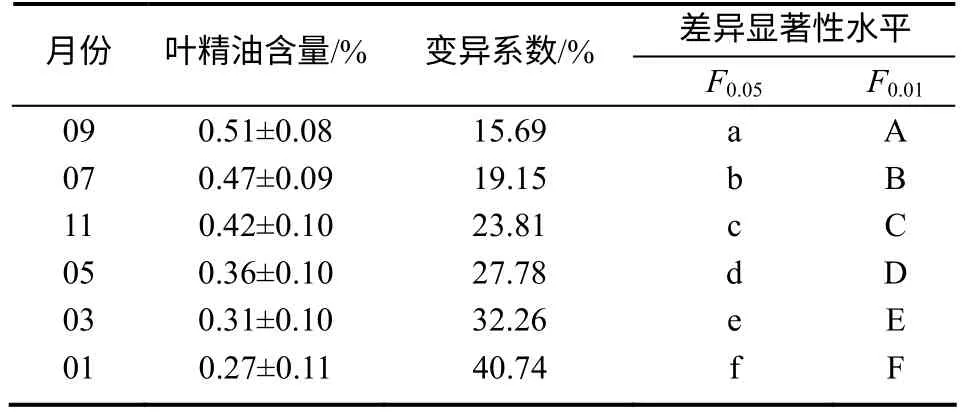
表1 异樟叶不同月份的含油量 Table 1 The oil content from isonerolidol type leaves in different months
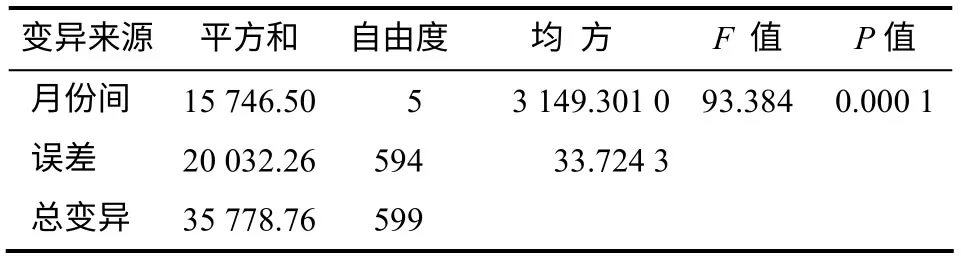
表2 异樟不同月份叶含油量的方差分析结果 Table 2 Result of variance analysis of oil content from isonerolidol type leaves in different months
2.2 异樟叶精油主成分相对含量的动态变化
通过 GC–MS 检测,异樟叶精油中有9 种成分在6个批次样品中都检测为主成分(相对含量大于1%),即异–橙花叔醇、三甲基–2–丁烯酸环丁酯、1,8–桉叶油醇、异丁香酚甲醚、α–松油醇、甲基丁香酚、桧烯、匙叶桉油烯醇和石竹烯氧化物。这9种固定主成分相对含量的月变化趋势存在较大差异,且相对复杂,但呈现一定规律性(表3)。由表3可知,异–橙花叔醇相对含量从3月开始逐渐升高,至7月达到最大值(41.13%),7月后开始逐渐下降;三甲基–2–丁烯酸环丁酯相对含量从5月开始逐渐升高,11月达最大值(24.39%),之后开始降低,并在1—3月保持较稳定水平的变化趋势;1,8–桉叶油醇相对含量5—11月维持在相对稳定的水平,在1月升到最大值(14.93%)后,又开始急速下降;异丁香酚甲醚的相对含量总体上相对稳定,仅7月和11月相对较低,但变化幅度很小;α–松油醇相对含量从1月至5月呈逐渐升高趋势,5月达到最大值(2.09%),5月后又开始逐渐下降;甲基丁香酚相对含量从1—5月呈逐渐下降趋势,5月后又开始升高,9月达到最高点(1.54%),9月后相对含量变化趋势相对平缓;桧烯相对含量从1月至3月呈逐渐升高趋势,3月至5月呈急剧下降,5月后下降趋势较平缓;匙叶桉油烯醇相对含量从1月至5月呈下降趋势,5月至7月呈上升趋势,7月后呈下降趋势,各月份的差异没有统计学意义;石竹烯氧化物相对含量的变化趋势与匙叶桉油烯醇刚好相反,各月份的差异没有统计学意义。
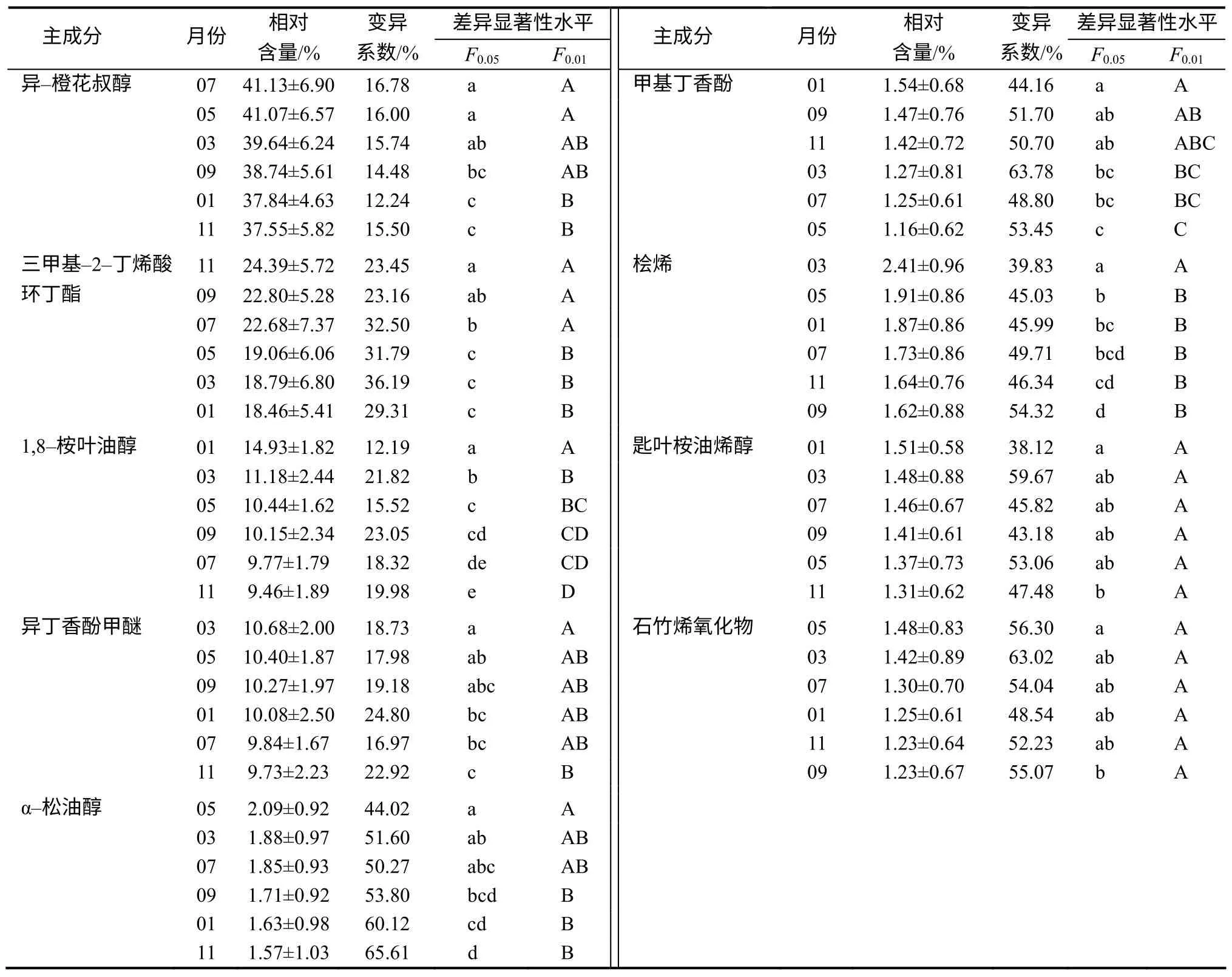
表3 异樟叶精油主成分含量不同生长期差异显著性分析 Table 3 Significant analysis of main components contents of isonerolidol type leaves oil during thegrowing periods
进一步对异樟叶精油中方差分析差异显著的7个固定主成分进行不同生长期差异显著性检验,结果(表4)表明,第一主成分异–橙花叔醇相对含量最高的月份为7月(41.13%),其次为5月(41.07%),这2个月的异–橙花叔醇相对含量之间的差异不显著,而与其他月份之间的差异达到显著或极显著水平。由此认为,异–橙花叔醇的最佳采收期为5—7月。第二主成分是三甲基–2–丁烯酸环丁酯,其相对含量最高的月份为11月(24.39%),其次为9月(22.80%),两者之间的差异不显著,与其他月份之间的差异则达到显著或极显著水平,说明三甲基–2–丁烯酸环丁酯的适宜采收期为11月。第三大主成分是1,8–桉叶油醇,其相对含量最高的月份为1月(14.93%),与其他月份之间的差异均达到极显著水平,认为1,8–桉叶油醇的最佳采收期为1月。第四大主成分是异丁香酚甲醚,其相对含量最高的月份为3月(10.68%),与其他月份之间的差异达到显著或极显著水平,因此,认为异丁香酚甲醚的最佳采收期为3月。α–松油醇、甲基丁香酚和桧烯3 种主成分在异樟叶精油中的相对含量均低于5%,但其相对含量在不同生长期有着显著差异,其中α–松油醇相对含量最高的月份为5月(2.09%),与其他月份之间的差异达到显著或极显著水平;甲基丁香酚相对含量最高的月份为1月(1.54%),与其他月份之间的差异达到显著或极显著水平;桧烯相对含量最高的月份为3月(2.41%),与其他月份之间的差异达到极显著水平,因此,α–松油醇、甲基丁香酚和桧烯3 种主成份的最佳采收期分别为5月、1月和3月。
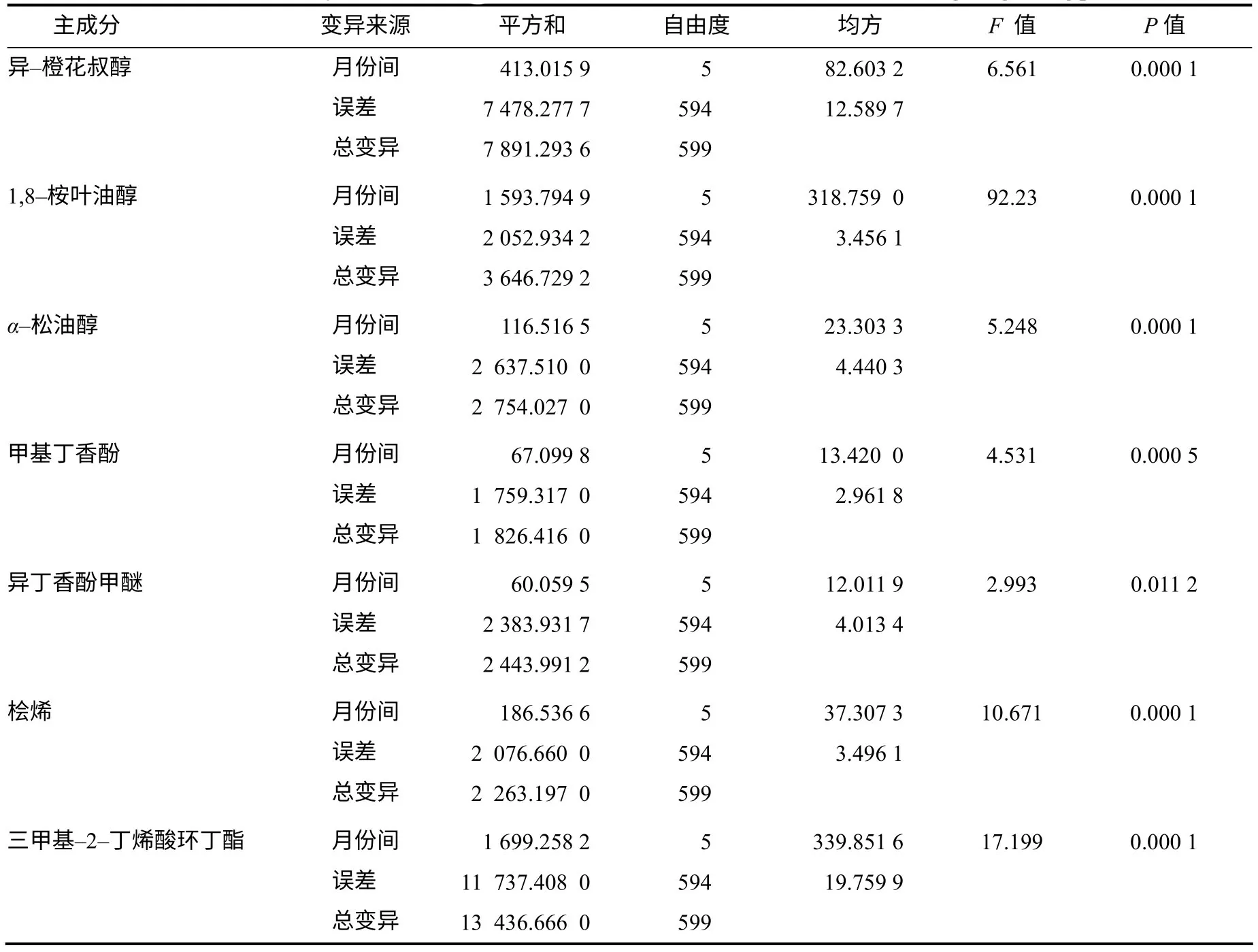
表 4 异樟叶精油主成分相对含量生长期方差分析 Table 4 Variance analysis of main components contents of isonerolidol type leaves oil during thegrowing periods
3 结论与讨论
本研究结果表明,全年中不同生长期的异樟叶平均含油量存在一定的差异,呈现一定的规律性,即最高值出现在生长季节,最低值出现在非生长季节或休眠期。异樟叶平均含油量3—9月呈逐渐增加的趋势,9月叶平均含油量达到最高峰(0.51%),随后至下一个生长期到来之前的1月,呈逐渐下降的趋势,这与张国防[3]对化学型芳樟叶片含油率季节变化的研究得出的结果相似,而与张国防[3]、胡文杰[8]分别对不同化学型脑樟、油樟不同生长期叶片含油率的变化趋势有所不同。这可能与樟树不同化学型、气候、栽种地域等不同有关。在芳香植物中,精油是次生代谢的产物,也是光合作用的最终产物[9],在7—8月高温时,光合作用受到抑制,影响了精油的合成。分析原因主要有3个:一是受环境胁迫,导致精油分解加快[10];二是在高温季节光合作用不理想,直接导致精油的合成下降[11];三是幼叶所占的比例较低[12],幼叶的量较少,而成长的老叶较多。由于9月平均含油量较高,因此,较适宜在这个时期采收。
异樟叶精油中9 种固定主成分相对含量的月变化趋势存在较大差异,且相对复杂,但呈现一定规律性。异樟叶精油的主成分相对含量也受到环境温度变化的影响。有学者认为,在环境胁迫下,植物次生代谢往往生成更多的稳定的化合物[13–15]。笔者在研究中发现,在 5月和7月,有更多的异–橙花叔醇、石竹烯氧化物和α–松油醇,说明异樟叶精油的主成分相对含量与月平均气温有一定关系。
樟树异樟叶精油的形成、转化和积累是一个动态的复杂的过程,受植物所处的生长条件、土壤的理化性质和气候等诸多因素的影响。气候因子决定植物的生长发育过程,一年中不同季节气候表现出节律性的变化,各种植物的生长发育也表现出规律性的生长节律,其体内的次生代谢产物的含量、主成分及其含量也必然会发生相应的变化[3],因此,了解和掌握异樟叶精油的主成分及其含量的变化规律,对异樟的产业化经营和管理具有重要的意义。
[1] Pino J A,Fuentes V.Leaf oil of Cinnamomum camphora (L.)J.Presl from Cuba[J].Journal of Essent oil Research,1998,10(5):531–532.
[2] 段博莉.樟树叶片精油及其主要成分的遗传变异规律研究[D].北京:中国林业科学研究院,2006.
[3] 张国防.樟树精油主成分变异与选择的研究[D].福州:福建农林大学,2006.
[4] 石皖阳,何伟,文光裕,等.樟精油成分和类型划分[J].植物学报,1989,31(3):209–214.
[5] 胡文杰,李冠喜,曹裕松,等.异樟叶精油的抑菌活性及其化学成分[J].林业科技开发,2014,28(6):69–71.
[6] 胡文杰,高捍东,江香梅,等.樟树油樟、脑樟和异樟化学型的叶精油成分及含量分析[J].中南林业科技大学学报,2012,32(11):186–194.
[7] 刘星星,张茜,郭夏丽,等.不同化学型樟树叶挥发性成分组成的多变量分析[J].植物学报,2014,49(2):161–166.
[8] 胡文杰.樟树不同化学型精油主成分时空变异规律及优良单株选择[D].南京:南京林业大学,2013.
[9] Croteaur.Biosynthesis and catabolism of monoterpenoids [J].Chemical Reviews,1987,87:929–954.
[10] Banthorpe D V,Ekundayo O,Mann J,et al.Biosynthesis of monoterpenes from14C–labelled acetate and CO2[J]. Pytochemistry,1975,14:707–715.
[11] Salisbury F B,Ross C.Plant Pysiology[M].Delhi:Prentice-Hall of India Private Limited,1974.
[12] Rajeswara Rao B R,Bhattacharya A K,Kaul P N,et al. Changes in profiles of essential oils of rose-seentedgeranium(Pelargonium sp.) during leaf ontogeny[J]. Journal of Essential Oil Research,1993(5):301–304.
[13] Yamaura T,Tanaka X,tabata M.Lighat dependent formation ofglanular trichomes and monoterpenes in thyme seedling[J].Phytochemistry,1989,28:741–744.
[14] Voirin B,brun N,Bayet C.Effests of day length on the monoterpene composition of leaves of Menthaхpiperta[J]. Phytochemistry,1990,29:749–755.
[15] 李大红,姚 雷,梁建生.不同月份香叶天竺葵精油的含有率与成分变化分析[J].上海交通大学学报:农业科学版,2006,24(4):354–357.

