甘蔗成熟期蔗叶POD 活性与自然脱叶率的相关性分析
方志存,李如丹,刘少春*,高欣欣,樊仙,刀静梅,邓军,张跃彬,郭家文
(1.云南省农业科学院甘蔗研究所,云南 开远 661699;2.云南省甘蔗遗传改良重点实验室,云南 开远 661699)
甘蔗(Saccharum officinarum L.)是全球种植面积和产量最大的糖料作物。中国甘蔗种植面积约1.55×106hm2,居全球第3 位[1–2]。目前,中国制糖甘蔗原料的收获主要依靠手工作业,而收获用工占整个甘蔗原料生产用工量的55%,其中剥叶用工占整个收获用工量的65%[3]。甘蔗叶鞘剥离的难易程度不仅是影响收获甘蔗效率的一个重要因素,而且叶鞘剥离的干净率直接影响到制糖甘蔗原料的含杂率[4]。选育自然脱叶性状好的品种不仅可以节省大量的劳动力投入,还可减少制糖甘蔗原料的含杂率,提高制糖甘蔗原料的质量。植物叶片脱落是植物细胞结构、代谢调控和基因表达等多种变化协同作用的结果[5]。有研究[6–9]表明,与植物器官脱落相关的酶类主要有纤维素酶(EG)、果胶(甲)酯酶(PME)、过氧化物酶(POD)等。POD 作为一种重要的多功能代谢酶,参与植物生长发育、细胞分裂与分化、器官脱落调节等多种生理活动[10–11]。POD 与禾本科作物、叶类蔬菜植物的器官衰老脱落密切相关[12–13]。有研究表明,POD 的主要作用机制为通过氧化吲哚乙酸(IAA)来促进细胞的脱落分化,加速离区细胞衰老,促进离层细胞的脱落[14]。甘蔗叶片自然脱落与蔗叶POD 活性的相关性少见报道。本研究中选择自然脱叶性状不同的甘蔗栽培品种为材料,测定成熟期各个阶段蔗叶、叶鞘和叶痕的POD 活性,探讨自然脱叶率的动态变化,分析蔗叶POD 活性和甘蔗自然脱叶的相关性,以期明确影响甘蔗自然脱叶性状的关键酶类,为选育自然脱叶性良好的甘蔗品种提供理论依据。
1 试验地概况
试验地位于云南省开远市北郊云南省农业科学院甘蔗研究所试验基地(103°15′E,23°42′N),海拔1 055 m,年均降水740 mm,年均气温19.8℃。试验地土壤有机质含量为20.5g/kg,全氮含量1.64g/kg,全磷含量0.67g/kg,全钾含量13.7g/kg,碱解氮含量80.79mg/kg,速效磷含量9.81mg/kg,速效钾含量112.78mg/kg,pH 6.0。
2 材料与方法
2.1 材料
供试甘蔗品种有自然易脱叶型品种云蔗03–194、云蔗01–1413;自然难脱叶型品种桂糖02–467、云蔗99–91。上述材料均由云南省农业科学院甘蔗研究所提供。
2.2 试验设计
采用随机区组设计,每1个不同脱叶性状的甘蔗品种为1个处理,每个小区面积36 m2,3次重复,材料播种时间2013年3月15日。田间管理按大田生产管理进行,保持正常生长。
2.3 测定指标及方法
2.3.1 蔗叶POD 活性的测定
从甘蔗生长进入成熟期早期(2013年11月15日)开始第1次采样,依次设成熟前期、成熟中期、成熟中后期、成熟后期共4个成熟阶段,每个成熟阶段间隔20 d 采样1次。每个小区每次采样选择生长正常的甘蔗植株5 株,形态学上完全展开叶为+1叶,往下整取+2 叶的叶片、叶鞘、叶痕(叶痕基线上下各1 cm 的蔗茎组织)各部位的样品。样品取后迅速用液氮速冻,带回实验室,保存于-80℃超低温冰箱,用于POD 活性测定。
分别取不同叶位叶痕、叶鞘、叶片样品各1.000g,0~4℃冰浴,用0.05 mol/L 磷酸缓冲液(pH 5.5)研磨提取,提取液完全转移到15mL 离心管中,用缓冲液定容至10mL,摇匀,采用Eppendorf 5417R台式高速冷冻离心机离心(5 000 r/min,4℃离心8min),取上清液,4℃保存,作为过氧化物酶粗提液。重复3次。过氧化物酶活性测定参照刘萍等[16]的方法:取具塞管2 支,1 支作为对照(混合液中的1mL 酶液用缓冲液代替),1 支加入4mL 混合液(2mL 浓度0.05 mol/L 缓冲液、1mL 浓度0.05 mol/L愈创木酚、1mL 过氧化物酶粗提液)和2% H2O21mL,摇匀(计时),在波长470 nm 下每0.5min 记录光密度值,以每0.5min光密度值变化表示活性大小。
2.3.2 甘蔗脱叶率调查
分别在甘蔗成熟前期、成熟中期、成熟中后期、成熟后期共4个阶段调查植株的自然展开总叶位数和自然脱叶数,计算脱叶率。脱叶率=自然脱叶数/总叶数×100%。
2.4 数据分析
采用 Microsoft Excel 2003 整理数据,用SPSS18.0 统计软件进行方差分析(ANOVA)和处理间的显著性检验(Duncan)。
3 结果与分析
3.1 甘蔗成熟期叶片、叶鞘和叶痕的POD 活性
3.1.1 叶片的POD 活性
从图1 可以看出,云蔗03–194 叶片的POD 活性最高,极显著高于云蔗01–1413 桂糖02–467 和云蔗99–91。在成熟前期、成熟中期、成熟中后期,云蔗 01–1413 叶片 POD 活性极显著高于桂糖02–467 和云蔗99–91,其中,在成熟前期,云蔗03–194 POD 活性最高,达3 527.47 U/(g·min),比云蔗99–91 叶片POD 活性432.07 U/(g·min)高8.2倍。与中后期比,成熟后期4个品种叶片POD 活性迅速升高。

图1 不同成熟时期供试品种叶片的POD 活性 Fig. 1 Changes of POD activity of leaf among experimental sugarcane cultivars in various stages of maturity
3.1.2 叶鞘的POD 活性
由图2 可见,在不同的成熟阶段,云蔗03–194叶鞘的POD 活性最高,极显著高于云蔗01–1413、桂糖02–467 和云蔗99–91。在成熟前期、成熟中期、

图2 不同成熟时期供试品种叶鞘的POD 活性 Fig.2 Changes of POD activity of leaf sheath among experimental sugarcane cultivars in various stages of maturity
成熟后期,云蔗01–1413 叶鞘的POD 活性极显著高于桂糖02–467 和云蔗99–91,其中,在成熟前期云蔗03–194 叶鞘POD 活性最高,达755.87 U/(g·min);在成熟中后期云蔗99–91 的POD 活性最低达,为40.00 U/(g·min)。与中后期比较,成熟后期4个品种叶鞘POD 活性大幅度升高。
3.1.3 叶痕的POD 活性
从图3 可见,在不同的成熟阶段,易脱叶型品种云蔗03–194 叶痕的POD 活性极显著高于难脱叶型品种云蔗99–91 和桂糖02–467(P<0.01)。4个甘蔗品种在成熟后期叶痕的POD 活性均高于成熟中后期,云蔗03–194 叶痕的POD 活性最高,为428 U/(g·min)。成熟后期云蔗99–91 叶痕的POD 活性为成熟中后期的34.2 倍。
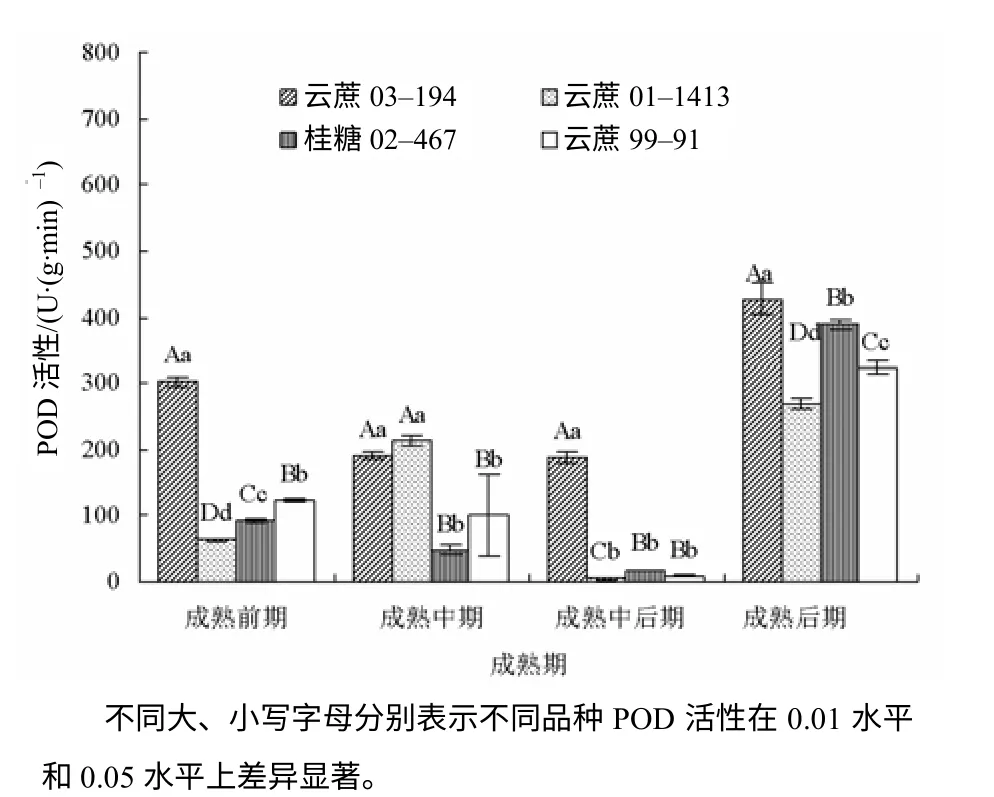
图3 不同成熟时期供试品种叶痕的POD 活性 Fig.3 Changes of POD activity of leaf scar among experimental sugarcane cultivars in various stages of maturity
3.2 甘蔗成熟期不同品种的自然脱叶率
由表1 可以看出,在不同成熟阶段,自然脱叶率从高到低的品种依次为云蔗 03–194、云蔗01–1413、桂糖02–467、云蔗99–91,自然易脱叶型品种云蔗03–194 和云蔗01–1413 的脱叶率极显著高于自然难脱叶型品种云蔗 99–91 和桂糖02–467。在成熟后期,云蔗03–194 脱叶率高达52.12%,而云蔗99–91 的脱叶率仅为12.70%。

表1 不同品种的自然脱叶率 Table 1 Defoliation rate of different sugarcane varieties
3.3 蔗叶POD 活性与自然脱叶率的相关性分析
相关分析结果(表2)显示,在甘蔗整个成熟时期,叶鞘、叶片、叶痕的POD 活性与蔗叶脱叶率的相关性呈逐渐递减的趋势。在甘蔗成熟后期,叶片、叶鞘和叶痕POD 活性与自然脱叶率相关性均达显著或极显著正相关。在整个成熟过程,叶鞘的POD 活性与甘蔗的自然脱叶率呈显著正相关或极显著正相关。

表2 蔗叶的POD 活性与自然脱叶率的相关分析结果 Table 2 Correlation analysis between abscission rate of sugarcane leaf and POD activity
4 结论与讨论
POD是一种广谱性酶,由细胞核内对应的DNA转录生成mRNA,之后以mRNA 为模板在细胞质内合成,并转运到细胞壁、液泡内,可在质外体间运输,参与植物生长发育、细胞分裂与分化,促使植物器官脱落[10–11,16]。Marja 等[17]研究了欧洲赤松松针脱落过程中POD 活性的变化表明,POD 活性的增加能够促进松针的脱落。棉花棉幼铃、柑橘幼果脱落过程中,POD 活性随之上升[18–19]。本研究结果表明,在不同成熟阶段,易脱叶型品种云蔗03–194 的叶片、叶鞘、叶痕的POD 活性均极显著高于难脱叶型品种桂糖02–467 和云蔗99–91,在成熟前期、成熟中期和成熟后期,易脱叶型品种云蔗01–1413 叶片、叶鞘的POD 活性也极显著高于难脱叶型品种桂糖 02–467 和云蔗 99–91,而云蔗03–194、云蔗01–1413、桂糖02–467、云蔗99–91的自然脱叶率呈逐渐递减的趋势,易脱叶型品种叶片、叶鞘、叶痕较高的POD 活性与其较高的自然脱叶率相对应。在整个成熟过程,叶鞘POD 活性与甘蔗自然脱叶率呈显著或极显著正相关,这表明叶鞘POD 活性的高低更能真实反映甘蔗自然脱叶的难易程度。
植物不同器官的POD活性存在较大差异,一般来说植物幼嫩组织的POD活性高于衰老部位。对黄花菜花序POD酶活性的研究表明,花梗上的POD 活性高于外花瓣的POD 活性[20]。马建萍等[21]对粟根、茎、叶、鞘和穗的POD活性研究表明,穗的酶活性最强,叶鞘的酶活性最弱,菊花嫩叶的POD酶同工酶带最多,其次为老叶,再次为嫩茎,而木质化茎的酶带最少[22]。本研究结果表明,在不同成熟阶段,相同叶位叶片、叶鞘和叶痕的POD活性存在极显著差异,叶片的POD活性极显著高于叶鞘和叶痕。在4个成熟时期,云蔗03–194、云蔗01–1413、云蔗03–194的叶片、叶鞘、叶痕的POD活性呈递减趋势,桂糖02–467在成熟后期叶片、叶痕、叶鞘的POD活性也呈递减趋势,这表明甘蔗叶片可能是POD酶合成的主要部位,POD由叶片细胞合成后,通过质外体运输到叶鞘、叶痕等部位,但甘蔗叶片POD转运机理尚不清楚。
前人对多种作物的研究[23–26]表明,在低温胁迫的条件下,草莓、落葵、西瓜、黄瓜等POD 活性也相应升高。本研究结果表明,与甘蔗成熟中后期比,在甘蔗成熟后期,4个供试甘蔗品种叶片、叶鞘和叶痕POD 的活性呈规律性大幅度升高,这可能与这一时期试验田间出现了低温霜冻(–2 )℃天气胁迫有关。
有研究[3]报道甘蔗叶鞘内源纤维素酶对脱叶发生有调控作用。本研究结果表明,甘蔗叶鞘的POD活性与甘蔗自然脱叶率呈显著正相关。下一步将探索内源乙烯、脱落酸(ABA)、果胶酶等激素和酶对甘蔗脱叶的影响,进一步从生理水平上明确调控甘蔗脱叶的关键酶类和激素。
[1] 黄杏,陈明辉,杨丽涛,等.低温胁迫下外源ABA 对甘蔗幼苗抗寒性及内源激素的影响[J].华中农业大学学报,2013,32(4):6–11.
[2] 刘海清.我国甘蔗产业现状与发展趋势[J].中国热带农业,2009(1):8–9.
[3] 樊仙,刘少春,高欣欣,等.甘蔗成熟期叶鞘纤维素酶活性对自然脱落的影响[J].植物生理学报,2013,49(11): 1228–1232.
[4] 牟向伟,区颖刚,吴昊,等.甘蔗叶鞘在弹性剥叶元件作用下破坏高速摄影分析[J].农业机械学报,2012,43(2):85–89.
[5] Taylor J E,Whitelaw C A.Signals in abscission[J].New Phytologist,2001,151(2):323–339.
[6] 李晓红,齐明芳,李天来,等.同温度处理对番茄离体花柄脱落及其相关酶活性的影响[J].沈阳农业大学学报,2007,38(6):780–783.
[7] 宋莉萍,刘金辉,郑殿峰,等.不同时期叶喷植物生长调节剂对大豆花荚脱落率及多聚半乳糖醛酸酶活性的影响[J].植物生理学报,2011,47(4):356–362.
[8] 董黎梨,汪永保,李映志,等.菠萝蜜果实糖苷酶和多聚半乳糖醛酸酶的活性变化[J].南方农业学报,2013,4(6):924–929.
[9] 齐明芳,许涛,郭泳,等.园艺植物器官脱落研究进展[J].沈阳农业大学学报,2010,41(6):643–648.
[10] 丁薪源,周娜娜,赵玉梅,等.冬枣果实过氧化物酶酶学特性分析[J].食品科技,2012,37(4):31–34.
[11] 李刚.铝对不同耐铝性的小麦基因型根尖过氧化氢含量和细胞壁过氧化物酶活性的影响[D].杭州:浙江大学,2006.
[12] Kahk P,Rad M.Pyrophosphatase,peroxidase and polyphenboloxidase activities during leaf development and senescence[J].Plant Physiology,1979(63):318–323.
[13] 张丽欣,宗汝静.乙烯对叶菜衰老的影响及光对乙烯作用的增效作用[J].华北农学报,1987,2(4):121–125.
[14] 刘喜明.巨尾桉脱落树皮形成过程及机理的研究[D].福州:福建农林大学,2013.
[15] 刘萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007.
[16] Zipor G,Oren-shamir M.Do vacuolar peroxidases act as plant caretakers? [J/OL][2012–11–09].Plant Science,http://dx.doi.org/10.1016/j.plantsci.2012.09.018.
[17] Marja R,Annamari M,Riitta J T,et al. Defoliation- induced responses in peroxidases,phenolics,and polyamines in scots pine (Pinus sylvestris L.) needles[J]. Journal of Chemical Ecology,2003,29(8):1905–1918.
[18] 李伶俐,杨青华,李文.棉花幼铃脱落过程中IAA、ABA、MDA 含量及SOD、POD 活性的变化[J].植物生理学报,2001,27(3):215–220.
[19] 管彦良,胡安生,蒋斌芳.柑桔果实脱落的激素调控[J].浙江农业学报,1995,7(4):297–300.
[20] 杨大伟,夏延斌,谭兴和,等.黄花菜中过氧化物酶活性的测定及褐变控制[J].湖南农业大学学报:自然科学版,2003,29(3):258–261.
[21] 马建萍,古世禄,独俊娥,等.谷子(粟)生育过程中POX 同工酶的分析[J].作物学报,2002,28(3):406–410.
[22] 丁玲,陈发棣,滕年军,等.菊花不同生长阶段不同器官POD 和EST 同工酶比较[J].西北植物学报,2007,27(10):2029–2034.
[23] Gülen H,Çetinkaya C,Kadıoğlu M,et al.Peroxidase activity and lipid peroxidation in strawberry (Fragaria× ananassa) plants under low temperature[J].Journal of Biological and Environmental Sciences,2008,2(6):95–100.
[24] Haque M S,Islam M M,Rakib M A,et al.A regulatory approach on low temperature induced enzymatic and antioxidative status in leaf of Pui vegetable(Basella alba)[J].Saudi Journal of Biological Sciences,2014(21):366–373.
[25] 刘文革,王鸣,阎志红,等.冷锻炼对不同倍性西瓜幼苗SOD、POD 活性及MDA 含量的影响[J].西北植物学报,2004,24(4):578–582.
[26] 逯明辉,宋慧,李晓明,等.冷害过程中黄瓜叶片SOD、CAT 和POD 活性的变化[J].西北植物学报,2005,25(8):1570–1573.

