肝素钠杂质总己糖胺中半乳糖胺的方法学研究
杨方秀,汪玉馨,刘霞飞,陆益红,樊夏雷Δ
(1.徐州医学院江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2.江苏省食品药品监督检验研究院,江苏 南京 210008)
肝素钠杂质总己糖胺中半乳糖胺的方法学研究
杨方秀1,2,汪玉馨2,刘霞飞1,2,陆益红2,樊夏雷1,2Δ
(1.徐州医学院江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2.江苏省食品药品监督检验研究院,江苏 南京 210008)
目的 建立离子色谱法测定肝素钠样品水解后的半乳糖胺含量。方法 通过计算半乳糖胺和葡萄糖胺的响应值的比值从而得到半乳糖胺含量。采用戴安离子色谱仪,色谱柱为氨基酸捕获柱 (30 mm×3 mm),串联保护柱(30 mm × 3 mm)和CarboPac PA20分析柱(150 mm × 3 mm)进行分析,脉冲安培检测器检测。流动相为14 mM氢氧化钾溶液,流速为0.4 mL/min,柱温30 ℃,进样体积10 μL。结果 盐酸葡萄糖胺在1.013~16.211 μg/mL范围内,葡萄糖胺色谱峰面积与其浓度成良好线性关系(Y=2.303 4X+0.824 2,r=0.998 3),回收率为92.7%,RSD为3.2%(n=9),最低检测限为0.1013 μg/mL,定量限为0.3377 μg/mL。盐酸半乳糖胺在0.0102~0.1625 μg/mL范围内,半乳糖胺色谱峰面积与其浓度成良好线性关系(Y=31.157X-0.114 4,r=0.999 3),回收率为102.1%,RSD为2.4%(n=9),最低检测限为0.001 0 μg/mL,定量限为0.003 4 μg/mL。3批肝素钠原料中半乳糖胺检测结果分别为未检出,(0.02±2.1)%,(0.03±1.5)%,均小于美国药典规定的限值1%。结论 经方法学验证,本文所建立的离子色谱法可用于肝素钠中半乳糖胺含量测定,可为肝素钠质量标准的提高提供参考。
肝素钠;离子色谱法;方法学;总己糖胺;半乳糖胺
肝素钠是临床上常用的糖胺聚糖类抗凝血药物,临床上常用于治疗心脑血管疾病及血栓栓塞性疾病[1-3]。杂质对肝素钠制剂的有效性和安全性具有重要的影响,肝素钠生产过程中可能会产生多种杂质,比如硫酸软骨素、硫酸皮肤素、多硫酸软骨素等肝素类似物,且已有文献对这几种杂质均进行了质量控制研究[4-8],肝素钠水解后可能会产生半乳糖胺,半乳糖胺是肝细胞中磷酸尿嘧啶核苷的干扰剂,进入体内后结合磷酸尿苷形成磷酸尿苷-半乳糖胺,使得磷酸尿苷耗竭,导致一系列细胞器受损,蛋白合成紊乱从而造成肝细胞损伤[9]。通过文献调研,半乳糖胺可诱导肝细胞损伤[10],导致大鼠肝纤维化[11]和小鼠急性肝损伤[12],严重时可导致大鼠急性肝衰竭[13-14]。因此检测半乳糖胺的含量对提高肝素钠原料的质量具有十分重要的意义。通过国内外文献检索,其方法学研究并未有相应的文献报道,现有国内质量标准也未对半乳糖胺进行质量控制。为灵敏准确地分析肝素钠及相关化合物中可能存在的半乳糖胺杂质,本实验建立高效灵敏、高分离效能的离子色谱法对本品水解后的半乳糖胺含量进行检查,为进一步完善肝素钠质量标准提供参考。由于实验中通过测定半乳糖胺和葡萄糖胺的响应值,计算其比值从而计算半乳糖胺百分比,故研究中需对半乳糖胺和葡萄糖胺均进行方法学研究。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器:Dionex ICS 3000 离子色谱仪,脉冲安培检测器(美国Dionex公司)。
1.1.2 试剂:盐酸葡萄糖胺对照品(批号:GOM183,USP);盐酸半乳糖胺(批号:GOL378,USP)。供试品:肝素钠原料3批(批号:1405001、1405002、1405003)均由某厂家提供。
1.2 方法
1.2.1 色谱条件:采用Dionex ICS 3000离子色谱仪,色谱柱为氨基酸捕获柱 (30 mm × 3 mm),串联保护柱(30 mm × 3 mm)和CarboPac PA20分析柱(150 mm × 3 mm)进行分析,脉冲安培检测器,波长设置见表1。流动相为14 mM氢氧化钾溶液,流速为0.4 mL/min,柱温:30 ℃,进样量:10 μL。
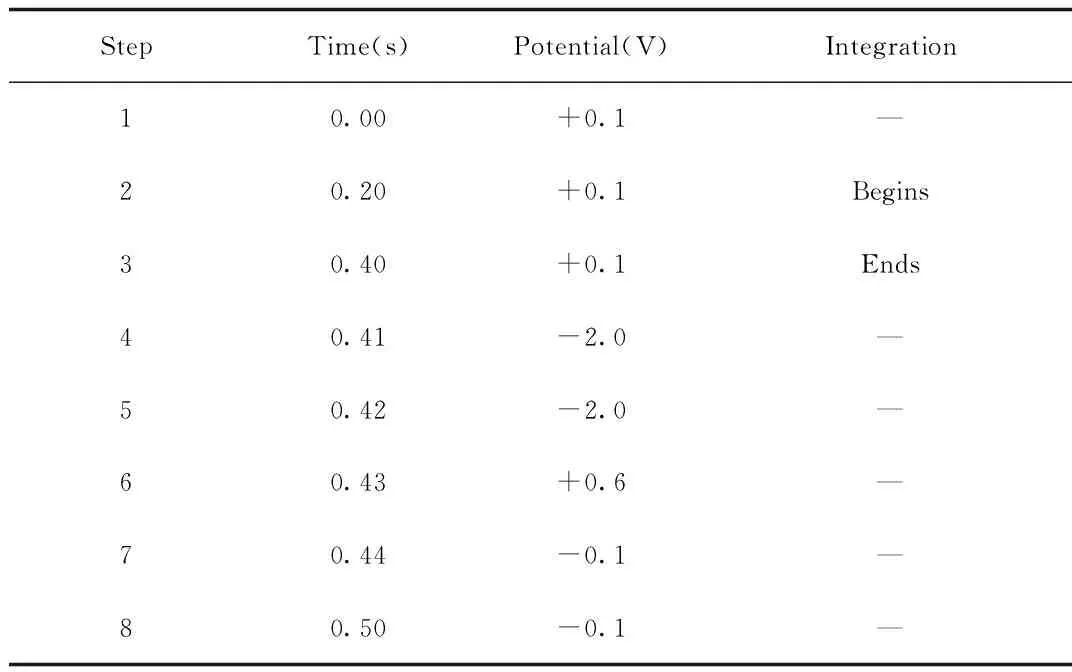
表1 脉冲安培检测器波长设置
1.2.2 专属性:取线性项下100 ℃加热6 h后的水解标准溶液,用水稀释制成每1 ml含盐酸葡萄糖胺为8.106 μg,含盐酸半乳糖胺为0.0813 μg的溶液,取样品测定项下100 ℃加热6 h后的肝素钠样品(批号:1405001)水解溶液适量,用水稀释制备成含肝素钠24 μg/mL,注入离子色谱分析。
1.2.3 线性及范围 精密称取盐酸葡萄糖胺标准品适量,用5 N盐酸溶液稀释制成1.6 mg/mL,精密称取盐酸半乳糖胺标准品适量,用5 N盐酸溶液稀释制成16 μg/mL,将等体积的葡萄糖胺和半乳糖胺标准溶液混合,转移5 mL标准溶液置顶空瓶中,加盖,100 ℃加热6 h。取水解标准溶液,用水稀释制成每1 mL含盐酸葡萄糖胺浓度分别为1.013、2.026、4.053、8.106、16.211 μg,含盐酸半乳糖胺浓度分别为0.0102、0.0203、0.0406、0.0813、0.1625 μg的溶液,注入离子色谱仪,记录色谱图,分别以葡萄糖胺的峰面积(A)对其浓度(C)进行线性回归,以半乳糖胺的峰面积(A)对其浓度(C)进行线性回归。
1.2.4 检测限及定量限:取“线性及范围”项下混合标准溶液稀释若干倍,进样10 μL,分别记录半乳糖胺和葡萄糖胺为噪音的3倍时的色谱图。
1.2.5 准确度(回收率):精密称取肝素钠样品(批号:1405001)适量,用5 N盐酸溶液稀释,加入葡萄糖胺和半乳糖胺混合标准溶液,置顶空瓶中,加盖,100 ℃加热6 h。用水稀释制备成含肝素钠24 μg/mL,盐酸葡萄糖胺添加浓度分别为6.485、8.106和9.727 μg/mL,盐酸半乳糖胺添加浓度分别为0.0650、0.0813和0.0976 μg/mL的模拟样品各3份进行测定,确定葡萄糖胺及半乳糖胺离子色谱测定的准确度。
1.2.6 进样精密度:取线性项下含盐酸葡萄糖胺8.106 μg/mL,含盐酸半乳糖胺0.0813 μg/mL的混合标准溶液连续进样6次,记录色谱图,考察峰面积的变化。
1.2.7 重复性:精密称取肝素钠样品(批号:1405001)适量,用5 N盐酸溶液稀释,加入葡萄糖胺和半乳糖胺混合标准溶液,置顶空瓶中,加盖,100 ℃加热6 h。用水稀释制备成含肝素钠24 μg/mL,盐酸葡萄糖胺添加浓度为8.106 μg/mL,盐酸半乳糖胺添加浓度分别为0.0813 μg/mL的模拟样品各6份进行测定。
1.2.8 稳定性:取含盐酸葡萄糖胺8.106 μg/mL,含盐酸半乳糖胺0.0813 μg/mL的混合标准溶液于0、2、4、6、12、24 h分别进样,以峰面积考察溶液稳定性。
1.2.9 供试品中总己糖胺中半乳糖胺测定:取含盐酸葡萄糖胺8.106 μg/mL,含盐酸半乳糖胺0.0813 μg/mL的混合标准溶液,注入离子色谱仪,记录色谱图,计算标准溶液水解液中半乳糖胺和葡萄糖胺响应值的比值。取3批肝素钠样品(批号:1405001、1405002、1405003),各称取12 mg置顶空瓶中,加5 N盐酸溶液5 mL溶解,加盖,100 ℃加热6 h。用水稀释100倍,注入离子色谱仪,记录色谱图。平行测定3次。计算公式如下:
水解标准溶液中半乳糖胺与葡萄糖胺的响应值比值:f=(As1/ As2)×(ms2/ms1)
As1:标准溶液中半乳糖胺峰面积;As2:标准溶液中葡萄糖胺峰面积;ms1:标准溶液中半乳糖胺质量;ms2:标准溶液中葡萄糖胺质量;
水解供试品中半乳糖胺的峰面积比%= (A1/f)/[(A1/f)+A2]×100
A1:水解供试品中半乳糖胺的峰面积;A2:水解供试品中葡萄糖胺的峰面积
2 结果
2.1 专属性 专属性结果表明,肝素钠不会对葡萄糖胺及半乳糖胺的测定存在干扰。见图1。

图1 葡萄糖胺及半乳糖胺离子色谱分析专属性A:葡萄糖胺半乳糖胺混合标准溶液;B:肝素钠原料Fig.1 The specialization of the ion chromatography analysis of glucosamine and galactosamineA: the mix standard solution of glucosamine and galactosamine;B: the raw material of heparin sodium
2.2 线性及范围 在1.013~16.211 μg/mL范围内,葡萄糖胺色谱峰面积与其浓度成良好线性关系,Y=2.3034X+0.8242,r=0.998 3(见表2)。在0.0102~0.1625 μg/mL范围内,葡萄糖胺色谱峰面积与其浓度成良好线性关系,Y=31.157X-0.1144,r=0.999 3(见表3)。

表2 葡萄糖胺离子色谱分析线性及范围

表3 半乳糖胺离子色谱分析线性及范围
2.3 检测限及定量限 盐酸葡萄糖胺方法检测限为0.1013 μg/mL,定量限为0.3377 μg/mL,盐酸半乳糖胺方法检测限为0.0010 μg/mL,定量限为0.0034 μg/mL。见图2。

图2 葡萄糖胺及半乳糖胺离子色谱分析检测限(A)及定量限(B)Fig.2 The LOD(A)and LOQ(B)of the ion chromatography analysis of glucosamine and galactosamine
2.4 准确度(回收率) 葡萄糖胺离子色谱测定的准确度平均值为92.7%,RSD为3.2%(见表4)。半乳糖胺离子色谱测定的准确度平均值为102.1%,RSD为2.4%(见表5),结果表明测定准确度均良好。

表4 葡萄糖胺离子色谱分析准确度

表5 半乳糖胺离子色谱分析准确度
2.5 进样精密度 进样精密度的结果表明葡萄糖胺及半乳糖胺进样精密度均良好。见表6、7。
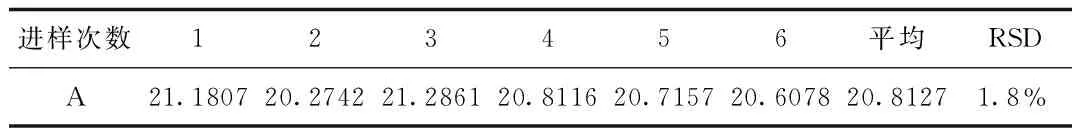
表6 葡萄糖胺离子色谱分析进样精密度Tab.6 The precision of ion chromatography analysis of glucosamine
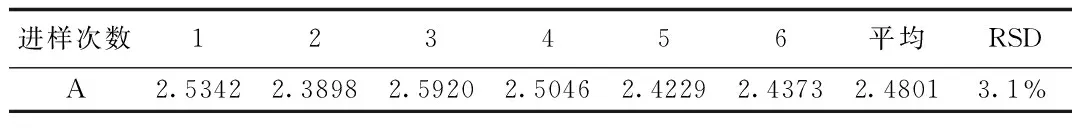
表7 半乳糖胺离子色谱分析进样精密度Tab. 7 The precision of ion chromatography analysis of galactosamine
2.6 重复性 重复性结果表明葡萄糖胺和半乳糖胺重复性均良好。见表8、9。

表8 葡萄糖胺离子色谱分析重复性Tab.8 The repeatability of ion chromatography analysis of glucosamine
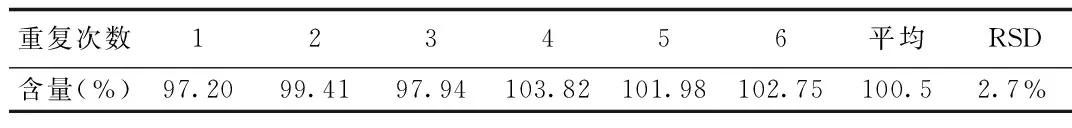
表9 半乳糖胺离子色谱分析重复性Tab.9 The repeatability of ion chromatography analysis of galactosamine
2.7 稳定性 以峰面积考察溶液稳定性,结果发现主峰面积未见显著下降,表明葡萄糖胺及半乳糖胺均在测定时间内稳定。见表 10、11。

表10 葡萄糖胺离子色谱分析稳定性Tab.10 The stability of ion chromatography analysis of glucosamine

表11 半乳糖胺离子色谱分析稳定性Tab.11 The stability of ion chromatography analysis of galactosamine
2.8 样品测定 分别对3批肝素钠原料中半乳糖胺进行检测,每批样品平行测定3次,其检测结果分别为未检出,(0.02±2.1)%,(0.03±1.5)%,均小于美国药典规定的限值1%。
3 讨论
本实验建立了离子色谱法测定半乳糖胺及葡萄糖胺的方法学,并对3批肝素钠原料药样品中半乳糖胺的含量进行测定,均获得良好的结果。与比色法[15]相比,采用离子色谱仪检测葡萄糖胺及半乳糖胺的方法的专属性强、重现性好、稳定性和灵敏度高。前者主要通过氨基糖与乙酰丙酮产生生色物质通过分光光度计进行检测,由于其对操作要求很高,其准确度和稳定性因此受到一定限制,而离子色谱法运用离子交换的原理配备脉冲安培检测器,通过优化分离方式和分离柱提高被分析物的选择性和检测灵敏度。因此,本实验所研究的离子色谱法检测肝素钠总己糖胺中半乳糖胺的方法可以为肝素钠质量控制提供一定的参考。
[1] 张青.欧洲药典肝素钠质量标准浅析[J].食品与药品,2013 (2):147-149.
[2] 张青.日本药局方肝素钠质量标准浅析[J].食品与药品,2013,15(5):373-376.
[3] 张青.美国药典肝素钠质量标准浅析[J].食品与药品,2013,15(3):228-228.
[4] 韩春霞.牛胎球蛋白和肝素钠质量分析[D].北京:中国药品生物制品检定所,2008:61-62.
[5] 方井晋.肝素钠有关物质检测方法学研究及效价的快速测定[D].杭州:浙江大学,2012:49-51.
[6] 高照明,张玉冰,于永良.核磁共振内标法定量分析肝素钠中多硫酸软骨素[J].分析化学,2011,39(4):601-602.
[7] 王皓,于广利,赵峡.污染肝素中多硫酸化硫酸软骨素的分步醋酸纤维素薄膜电泳分析[J].分析化学,2009,9(8):1147-1151.
[8] 王悦,李京,廖海明.毛细管电泳法对肝素钠注射液中杂质的测定[J].药物分析杂志,2011,31(6):1119-1120.
[9] 张金良,任懂平.D-半乳糖胺/脂多糖诱导急性肝衰竭机制的研究进展[J].武警医学院学报,2011,20(9):761-762.
[10] 王红,胡晓明,冯艳青.牛磺酸对半乳糖胺及硫酸亚铁-抗坏血酸所致大鼠肝细胞损伤的保护作用[J].中国药理学与毒理学杂志,1993(4):282-285.
[11] 杨文卓,曾民德,范竹.氧化苦参碱防治半乳糖胺诱导大鼠肝纤维化的实验研究[J].中华肝脏病杂志,2002,10(3):193-194.
[12] 赵丽娟,李红,杨世杰.黄芪注射液对D—半乳糖胺所致小鼠急性肝损伤的保护作用[J].吉林大学学报:医学版,2003,29(3):280-282.
[13] 姚志强,杨为松.肝再生刺激因子对 D—半乳糖胺所致大鼠急性肝功能衰竭..[J].中华传染病杂志,1990,8(2):88-91.
[14] 刘亮明,罗杰,张吉翔,等.内毒素诱导 D-半乳糖胺致敏大鼠急性肝衰竭的研究[J].中华医学杂志,2006,86(30):2122-2126.
[15] Rondle CJM,Morgan WTJ.葡糖胺和半乳糖胺的测定[J].食品与药品,2012,12(11):1.
(编校:王俨俨)
A methodological study of limit test of galactosamine for total hexosamine in heparin sodium
YANG Fang-xiu1,2, WANG Yu-xin2, LIU Xia-fei1,2, LU Yi-hong2, FAN Xia-lei1,2Δ
(1. Jiangsu key laboratory of new drug research and clinical pharmacy, Xuzhou 221004, China; 2. Jiangsu Province Food and Drug Supervision and Inspection Institute, Nanjing 210008, China)
ObjectiveTo establish an ion chromatography method to determine the content of galactosamine in heparin sodium sample.MethodsThe content of galactosamine was determined by the ratio of response value of galactosamine and glucosamine. The determination was performed on an Dionex ICS, and the separation was carried out on a Amino acids capture column (30 mm × 3 mm), Series protect column (30 mm × 3 mm)and analytical column CarboPac PA20 (150 mm × 3 mm). The mobile phase was 14 mM potassium hydroxide solution at a flow rate of 0.4 mL/min; the column tempertature was at 30 ℃; the injection volume was 10 μL.ResultsGlucosamine hydrochloride had good linearity within the range of 1.013 - 16.211 μg/mL(Y= 2.303 4X+0.824 2,r=0.998 3), the average accuracy was 92.7%, and RSD was 3.2%(n=9), the limit of detection was 0.101 3 μg/mL, and the limit of quantitation was 0.337 7 μg/mL. D-Galactosamine hydrochloride had good linearity within the range of 0.010 2 - 0.162 5 g/mL, (Y= 31.157X-0.114 4,r=0.999 3). The accuracy was 102.1%, RSD was 2.4%(n=9). The limit of detection was 0.001 0 μg/mL, and the limit of quantitation was 0.003 4 μg/mL. The determination of galactosamine in 3 batches of heparin sodium raw material was not detected, (0.02±2.1)%, (0.03±1.5)%, respectively, which were all lower than the limit value (1%) of United States Pharmacopeia regulation.ConclusionThe method for the determination of galactosamine in total hexose amine is successfully developed, which could be used as reference for improvement of the quality standard of heparin sodium.
heparin sodium; ion chromatography; methodology; total hexosamine; galactosamine
杨方秀,女,硕士,研究方向:体内药物分析学及药品安全性研究,E-mail:yfx1409@163.com;樊夏雷,通信作者,男,博士,硕士生导师,主任药师,研究方向:色谱分析及药品安全性研究,E-mail:fanxialei@sohu.com。
R973+.2
A
1005-1678(2015)11-0165-04

