新型乐陵金丝小枣原汁中的生物活性成分分析
杨梅,王莹,赵忠熙Δ
(1.山东大学 药学院,山东 济南 250100;2.山东省红枣食药工程技术研究中心,山东 济南 250012)
新型乐陵金丝小枣原汁中的生物活性成分分析
杨梅1,2,王莹1,2,赵忠熙1,2Δ
(1.山东大学 药学院,山东 济南 250100;2.山东省红枣食药工程技术研究中心,山东 济南 250012)
目的 对新型乐陵金丝小枣原汁中所含主要生物活性成分进行检测。方法 原汁中游离单糖和水溶性多糖的分析,分别采用了高效液相色谱-示差折光检测法(HPLC-RID)法以及苯酚-硫酸法衍生化后紫外分光光度法来测定,氨基酸和矿物质的含量分别使用氨基酸自动分析仪法和原子吸收光谱法来分析,总酚和总黄酮的定量首先分别通过与福林酚和硝酸铝形成络合物后经紫外分光光度法来检测,芦丁和环核苷酸的分析利用了HPLC法。结果 乐陵金丝小枣原汁中蔗糖、葡萄糖、果糖和多糖平均含量分别为3.9、32.5、27.3和3.6 mg/mL;氨基酸总量平均值为269.7 μg/mL;矿物质Ca、Fe、Mg、Zn、Mn、Cr、Cu的平均含量分别为35.1、0.85、55.8、0.85、0.44、0.41、0.21 μg/mL;总酚(以没食子酸计)、总黄酮(以芦丁计)、芦丁、环磷酸腺苷(cAMP)和环磷酸鸟苷(cGMP)平均含量分别为1.34、157.3、7.15、19.2和8.11 μg/mL。结论 该新型乐陵金丝小枣原汁中含有丰富的营养成分,值得进一步开发推广。
金丝小枣原汁;游离糖;多糖;氨基酸;矿物质;黄酮;多酚;环核苷酸
枣(ZiziphusjujubaMill.)隶属于鼠李科枣属,主要分布于亚洲和北美洲的亚热带和热带地区。枣果中营养成分丰富,主要包含碳水化合物、氨基酸、矿物质、多酚、黄酮、环核苷酸、维生素、三萜类等活性物质,是传统的药食兼用佳品[1]。
红枣有效成分药理实验研究证实,枣果在抗肿瘤、降血压、降血脂、保护肝脏、健脾养胃等方面有显著的疗效。另外,还具有补血养颜、增强免疫力、抗衰老、补脑养神等多种功效[2],所以其高端功能食品和药品开发利用近几年受到了国内外的广泛关注。
山东省德州地区是乐陵金丝小枣的发祥地,乐陵金丝小枣栽培历史悠久,风味甘美,营养丰富,曾作为封建王朝的贡品,现畅销国内和东南亚、日本、美国等地,与肥城佛桃、莱阳茌梨并称为山东省的三大名果[3]。为了深入挖掘乐陵金丝小枣的食用和药用价值,本研究选用了产于乐陵市的新型金德润牌乐陵金丝小枣原汁作为分析对象,对其进行了主要生物活性成分的评价,以期为金丝小枣中高端产品的开发提供生物成分物质基础方面的实验数据。
1 材料与方法
1.1 材料
1.1.1 试材:金德润牌乐陵金丝小枣原汁购自乐陵市德润健康食品有限公司。
1.1.2 试剂与仪器:环磷酸腺苷(cAMP),环磷酸鸟苷(cGMP),芦丁,没食子酸,葡蔗糖,蔗糖,果糖,以上均为色谱纯标准品;亚硝酸钠,九水合硝酸铝,氢氧化钠,无水碳酸钠,二水合柠檬酸钠,苯酚,福林-酚试剂,浓硫酸,磷酸,无水乙醇均为分析纯;浓盐酸,硝酸,高氯酸均为优级纯;磷酸二氢钾,甲醇为色谱纯。
Agilent 1260高校液相色谱仪,日立L-2000高效液相色谱仪,日立-835型氨基酸自动分析仪,M-3100型原子吸收分光光度计(美国PE公司),DK-420S三用恒温水箱(精宏实验设备有限公司),DH07-9076A型恒温箱(上海精宏实验设备有限公司),MZH300T1型恒温加热真空干燥器(北京绿野创能机电设备有限公司),SHB-Ⅲ 循环水式多用真空泵(郑州长城科工贸有限公司),MDF-U53V型医用低温箱(三洋电机株式会社),TU-1900双光束紫外可见分光光度计(北京普析),Master-Q plus超纯水机(上海和泰仪器有限公司),RE-52AA型旋转蒸发仪(菏泽市鑫源仪器仪表有限公司),KQ-500db型超声仪(昆山市超声仪器有限公司)。
1.2 方法
1.2.1 糖类成分的含量测定:
① 多糖的含量测定(苯酚-硫酸法):葡萄糖标准曲线的制作[4]:精密称取葡萄糖对照品40.00 mg,置于100 mL容量瓶中,超纯水定容,配成400 μg/mL的储备液。分别精密吸取储备液0.40、0.60、0.80、1.00、1.20、1.40、1.60、1.80 mL置于具塞试管中,加超纯水至2 mL,另取2 mL超纯水作空白对照,然后各加1.00 mL的6%苯酚溶液及5.00 mL浓硫酸,静置10 min,摇匀后室温下静置20 min,冷却后于490 nm波长处以空白对照溶液为参比,测定吸光值,测3次取平均值。以葡萄糖浓度为横坐标,吸光值为纵坐标,绘制葡萄糖标准曲线。
样品溶液的测定:300 mL枣汁旋蒸除去水至浸膏状,加入100 mL无水乙醇,70 ℃超声提取1 h,重复提取3次,除去醇溶性物质,滤渣加入100 mL超纯水完全溶解,加入无水乙醇调至80%乙醇,4 ℃ 醇沉24 h。抽滤得到多糖沉淀(滤液待用),用超纯水溶解并定容至100 mL,得到多糖样品溶液。精密吸取上述样品溶液 30 μL于具塞试管中,按照上述方法测定吸光值,在标准曲线上查出相应的多糖浓度,计算枣汁中的多糖含量,平行测定3次。
② 游离糖的含量测定[高效液相色谱-示差折光检测法(reversed phase high performance liquid chromatography,HPLC-RID)]
标准溶液的配制:单标液的配制:精确称取葡萄糖、果糖、蔗糖标准品各2.0 g,分别用超纯水溶解定容至100 ml,配制成20 mg/mL的标准溶液。分别精密吸取上述葡萄糖标准溶液和果糖标准溶液0.5、1、2.5、5 mL于10 mL容量瓶中,超纯水定容,配制成浓度为1、2、5、10 、20 mg/mL的系列标准溶液。精密吸取20 mg/mL蔗糖标准溶液0.1、0.2、0.3、0.4、0.5 mL于10 mL容量瓶中,超纯水定容,配制成蔗糖浓度为200、400、600、800、1000 μg/mL的系列标准溶液。以上标准溶液经0.45 μm滤膜过滤,待测。混标液的配制:精确称取葡萄糖、果糖、蔗糖标准品各2.0 g,超纯水溶解定容至100 mL,配制成葡萄糖、果糖、蔗糖浓度均为20 mg/mL的混合标准液,精密吸取该混标液2.5 mL于10 mL容量瓶中,超纯水定容,配制成各成分均为5 mg/mL的混标液,经0.45 μm滤膜过滤,待测。
样品溶液的配制:1.2.1项下醇沉后过滤多糖得到的滤液所含即为枣汁中的游离糖,将该滤液旋蒸至尽干,超纯水溶解定容至100 mL。取上述溶液1 mL,超纯水稀释至50 mL,经0.45 μm滤膜过滤,平行测定3次。
色谱条件:色谱柱:美国Bio-Rad伯乐Aminex HPX-87H糖分析柱(300 mm×7.8 mm);流动相:5 mmol硫酸;流速:0.5 mL/min;进样量:10 μL; 柱温:45 ℃;检测器:示差折光检测器(RID)。
1.2.2 氨基酸的含量测定[4-8]:
① 溶液的配制:水解液:6 N HCl溶液,5 N NaOH(含5%SnCl2)溶液;稀释液(pH 2.2的柠檬酸钠缓冲液):称取1.96 g柠檬酸钠(Na3C6H5O7·2 H2O)和1.65 mL浓盐酸加水稀释到100 mL,调节pH至2.2。
② 样品的测定:取5 mL红枣原汁于水解管中,加5 mL 6N HCl水解液后将水解管放入冷冻剂中,冷冻5 min,再接通真空泵抽真空,然后充入高纯氮气;再抽真空充氮气,重复3次后封口,于105 ℃水解24 h。取出冷却至室温,打开水解管,用超纯水多次冲洗水解管,将水解液全部转移到50 mL容量瓶内并用超纯水定容。充分溶解后取2.0 mL于容量瓶中,用真空干燥器在50 ℃干燥,残留物用2 mL超纯水溶解,再干燥,重复操作3次后准确加入2.0 mL稀释液,充分溶解,经0.45 μm滤膜过滤。将上述滤液50 μL输入氨基酸自动分析仪中进行测定,重复测定3次。食物中蛋白质在酸水解过程中,其色氨酸极易被分解,所以采用碱水解方法来测定色氨酸含量:取5 mL红枣原汁于水解管中,加5 mL 6N NaOH(含5%SnCl2)水解液后将水解管放入冷冻剂中,冷冻5 min,再接通真空泵抽真空,然后充入高纯氮气;再抽真空充氮气,重复3次后封口,于105 ℃水解24 h。取出冷却至室温,打开水解管,用超纯水多次冲洗水解管,将水解液全部转移到烧杯内,在冰浴中加入6N HCl 调pH至7,然后转移至50 mL容量瓶内并用超纯水定容,摇匀后经0.45 μm滤膜过滤。将上述滤液50 μL输入氨基酸自动分析仪中进行测定,重复测定3次。将样品测定谱图与已知混合氨基酸标准谱图核对,根据已知浓度标准样的峰面积与谱图峰面积的比,计算出枣汁中各氨基酸的浓度。
1.2.3 矿物质的含量测定[6-9]:量取20 mL枣汁置入100 mL烧杯中,加入2 mL HClO4,盖上表面皿,静置2 h后加入8 mL HNO3,盖上表面皿,电炉加热消化,至溶液无色透明,继续加热至尽干,冷却后用去离子水溶解并转移至25 mL容量瓶,定容,混匀,采用原子吸收分光光度计进行测定(测定时根据需要进行稀释),每个样品重复测定3次。
1.2.4 总酚含量测定(福林-酚法)[10]:
① 没食子酸标准曲线的制作:精密称取没食子酸标准品20 mg,超纯水溶解定容至10 mL,配制成2 mg/mL没食子酸标准溶液。分别准确吸取上述标准溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL刻度比色管中,分别向各比色管中加入0.5 mL福林酚试剂,室温放置5 min,再向比色管中加入1.5 mL 20%碳酸钠溶液,完全混匀后,加超纯水至 10 mL,75 ℃水浴10 min,于760 nm处测定其吸光值,测3次取平均值。以没食子酸浓度为横坐标,吸光值为纵坐标,绘制没食子酸标准曲线。
② 样品溶液中总酚含量的测定:精密吸取红枣原汁0.5 mL 于10 mL刻度比色管中,按1.2.4下①中方法测定吸光度,按标准曲线方程计算枣汁中总酚的含量。
1.2.5 黄酮类的含量测定:
① 总黄酮含量测定(硝酸铝法):芦丁标准曲线的制作:精密称取芦丁标准品20 mg,以50:50甲醇-水溶液溶解并定容至100 mL,得到0.2 mg/mL芦丁对照品溶液。分别准确吸取 0.2 mg/mL芦丁对照品溶液 0.0、0.5、1.0、1.5、2.0、3.0 mL于10 mL刻度比色管中,分别向各个比色管中加入0.3 mL 5%的亚硝酸钠溶液,混合均匀,室温放置6 min,再向比色管中加入 0.3 mL 10%硝酸铝溶液,混合均匀,室温放置6 min,最后向比色管中加入4.0 mL 10%氢氧化钠溶液,加超纯水至10 mL,摇匀,继续放置15 min,于510 nm处测定其吸光值,测3次取平均值。以芦丁浓度为横坐标,吸光值为纵坐标,绘制芦丁标准曲线。
样品溶液中黄酮含量的测定:300 mL枣汁旋蒸至浸膏后,加入50 mL 60%乙醇70 ℃超声提取1 h,重复提取3次。合并3次滤液旋蒸至尽干,用50:50甲醇-水定容至100 mL,制备成样品溶液。取上述样品溶液1 mL,用50:50甲醇-水溶液稀释至10 mL。精密吸取稀释后的样品溶液5.0 mL 于10 mL刻度比色管中,按上述方法测定吸光度,按标准曲线方程计算枣汁中总黄酮的含量。
② 芦丁含量的测定(HPLC-UV法):标准溶液的配制:精密称取10 mg芦丁标准品,甲醇溶解定容至10 mL,配制成2 mg/mL的储备液。分别吸取储备液25、50、100、250、500、1000 μL于10 mL容量瓶中,甲醇定容。配制成浓度分别为5、10、20、50、100、200 μg/mL的系列标准溶液,经0.22 μm有机滤膜过滤,待测。
样品溶液的配制:取1.2.5①中制备的样品溶液,经0.22 μm有机滤膜过滤,重复测定3次。
色谱条件[11]:色谱柱:Phenomenex Luna C18(4.6 mm×15 mm ,5 μm);流动相:50:50:0.05%:甲醇-水-磷酸;流速:0.8 mL/min;进样体积:20 μL 柱温:30 ℃;检测波长:360 nm。
1.2.6 环磷酸苷的含量测定(HPLC-UV法):
① 标准溶液的配制:混标液的配制:精确称取cAMP、cGMP准品各10 mg,超纯水溶解定容至10 mL,配制成 cAMP、cGMP 浓度均为10 mg/mL的混合标准液,分别精密吸取上述混标液50、100、200、500、1000、2000 μL于10 mL容量瓶中,超纯水定容。配制成浓度分别为5、10、20、50、100、200 μg/mL 的系列混标液,经0.45 μm滤膜过滤,待测。
单标液的配制:精确称取cAMP和cGMP 10 mg,分别用超纯水溶解定容至10 mL,稀释成100 μg/mL的标准溶液,经 0.45 μm滤膜过滤,待测。
② 样品溶液的配制:新型乐陵金丝小枣原汁,经 0.45 μm滤膜过滤,重复测定3次。
③ 色谱条件[12]:色谱柱:phenomenex luna C18(4.6 mm×15 mm,5 μm);流动相:20 mmol KH2PO4-甲醇:90:10;流速:1.0 mL/min;进样体积:20 μL;柱温:30 ℃;检测波长:254 nm。
2 结果
2.1 金丝小枣原汁中常规营养成分的组成及含量
2.1.1 金丝小枣原汁中糖类的组成及含量:实验得到游离糖和多糖标准曲线相应回归方程及相关系数(表1)和游离糖分离色谱图(图1)。计算得到金丝小枣原汁中蔗糖、果糖、葡萄糖和多糖平均含量分别为3.85、27.3、32.5、3.6 mg/mL(n=3)。

表1 糖类的回归方程和相关系数

图1 游离单糖对照品(A)和样品溶液(B)的HPLC色谱图1.蔗糖 2.葡萄糖 3.果糖Fig.1 HPLC chromatograms of free sugar standard (A)and sample solutions (B)1. sucrose 2. glucose 3. fructose
2.1.2 红枣原汁中氨基酸组成及含量:采用氨基酸自动分析仪法检测到了红枣原汁中的15种氨基酸,检测结果见表2。氨基酸总量平均值为269.7 μg/mL,其中脯氨酸平均含量最高。

表2 金丝小枣原汁中氨基酸的平均含量(n=3)Tab.2 Amino acid average contents in the jujube juice(n=3)
2.1.3 红枣原汁中矿物质组成及含量:利用原子吸收光谱法检测到了7种矿质元素的含量,其中Ca和Mg平均含量较高,而Fe、Zn、Mn、Cr、Cu平均含量相对较低。见表3。
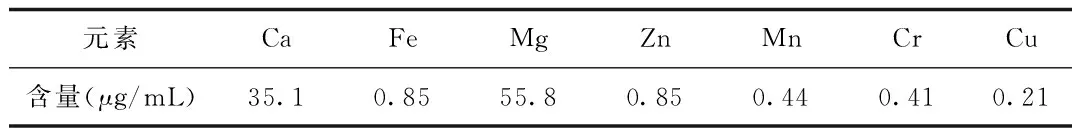
表3 金丝小枣原汁中矿物质的平均含量(n=3)
2.2 红枣原汁中特殊营养成分组成及含量 实验得到各特殊营养成分标准曲线相应回归方程及相关系数(表4)、芦丁色谱图(图2)和环磷酸苷色谱图(图3)。计算得到红枣原汁中总酚平均含量(以没食子酸计)为1.34 mg/mL;总黄酮平均含量(以芦丁计)为157.3 μg/mL;芦丁平均含量为7.15 μg/mL,cAMP、cGMP平均含量分别为19.17和8.11 μg/mL(n=3)。

表4 特殊营养成分的标准曲线回归方程和相关系数Tab.4 Linear regression equations and their correlation coefficients of special nutrients

图2 芦丁对照品(A)和样品溶液(B)的HPLC色谱图。Fig.2 HPLC chromatograms of rutin standard (A)and sample solutions (B)
3 讨论
本研究的生物活性成分分析结果显示该新型乐陵金丝小枣原汁中的碳水化合物包括游离单糖葡萄糖、果糖、蔗糖和水溶性多糖,其中葡萄糖和果糖含量居高,蔗糖含量较少,同时含有一定量的多糖。蔗糖、葡萄糖、果糖都是人体容易吸收的营养物质,特别是果糖不需要胰岛素来代谢。枣多糖多具有提高机体免疫力、抗氧化、抑制癌细胞增殖和保肝护肝等生理活性[1]。
该新型乐陵金丝小枣原汁中含有至少15种氨基酸,种类较齐全,其中包括人体不能合成的丙氨酸、苏氨酸、赖氨酸、缬氨酸,以及儿童体内必需又不能合成的组氨酸和精氨酸。氨基酸是构建生物机体的众多生物活性大分子之一,是构建细胞、修复组织的基础材料,被人体用于制造抗体蛋白以对抗细菌和病毒的侵染,制造血红蛋白以传送氧气,制造酶和激素以维持和调节新陈代谢。
该新型乐陵金丝小枣原汁中含有多种人体所需矿质元素,其中Ca和Mg含量较高,Fe、Zn、Mn、Cr、Cu含量较低。适量的微量元素是人体在生长发育过程中必不可少的重要物质,如果缺乏就会导致相应的疾病,如钙除作为骨质主要构成外,还能增加毛细血管壁致密度,降低其通透性,减少渗出,具有抗炎、消肿、抗组织胺作用;镁可起到解毒的作用[13];铁是人体血液中交换和输送氧所必需的元素,在生物催化、呼吸链上传递电子等方面起着重要作用,缺乏会导致贫血、免疫力下降等[14];锰参与激素、维生素的代谢,还参与激活体内多种酶类,并与人体衰老和疾病的发生密切相关;缺铜的患者常伴有白细胞减少,抵抗力减低,容易感染等症状[15]。
另外,该枣汁中特殊营养成分包括酚类、黄酮和环核苷酸等。酚类有明显的镇静、催眠和降压作用;黄酮类类化合物具有抗氧化、延缓衰老、预防心血管疾病、降血压、降血脂、降血糖等生理活性[16];环磷酸腺苷和环磷酸鸟苷共同参与多种生理过程调节,并参与基因转录,从而影响蛋白质合成;对人体细胞起着重要的生理调节作用,能增加肌力,扩展血管,增加心肌收缩力,改善心肌营养,达到抗癌和消除疲劳的作用[17]。
综上所述,乐陵金丝小枣中的各种营养成分对机体具有保护作用,除了保护肝脏、健脾养胃、抗肿瘤等功效外,对神经系统和心血管的正常活动都有较为明显的作用,可广泛应用于医药、保健品及医用食品,尤其是作为绿色生物医药产品,具有广阔的市场前景和应用价值。本研究测定了新型乐陵金丝小枣原汁中所含游离糖、多糖、氨基酸、矿物质、总酚、总黄酮、芦丁和环磷酸苷的含量,表明该金丝小枣原汁中含有丰富的营养成分,值得进一步开发推广。
[1] 吉爽爽.枣中功能性糖的研究[D].保定:河北农业大学,2012.
[2] 鲁周民,刘坤,闫忠心,等.枣果实营养成分及保健作用研究进展[J].园艺学报,2010,37(12):2017-2024.
[3] 郭文场,杨柏明,赵吉成.乐陵金丝小枣[J].植物杂志,1998,3(3):13-14.
[4] 熊筱娟,邹盛勤.江西黄毛楤木氨基酸及微量元素的测定分析[J].氨基酸和生物资源,2004,26(2):21-22.
[5] 陈宗礼,贺晓龙,张向前,等.陕北红枣的氨基酸分析 [J].中国农学通报,2012,28(13):296-303.
[6] 张艳红,陈兆慧,王德萍,等.红枣中氨基酸和矿质元素含量的测定[J].食品科学,2008,29(1):263-266.
[7] 范润珍,彭少伟,宋文东,等.水浮莲叶氨基酸及微量元素的测定[J].食品科技,2005,12 (12):78-80.
[8] 章广远,陈玉珍,顾景范.氨基酸自动分析仪测定食物中色氨酸[J].营养学报,1990,12(1):91-95.
[9] 刘一兵,董丽花.金丝小枣中微量元素含量的研究[J].社区医学杂志,2006,4(9S):5-6.
[10] Wang BN,Liu HF, Zheng JB,et al.Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].J Agric Food Chem,2011,59(4):1288-1292.
[11] 彭艳芳.枣主要活性成分分析及枣蜡提取工艺研究[D].保定:河北农业大学园艺学院,2008.
[12] 王向红,桑亚新,崔同,等.高效液相色谱法测定枣果中的环核苷酸[J].中国食品学报,2006,5(3):108-112.
[13] 孙磊,贾俊梅.仙鹤草微量元素的测定分析[J].微量元素与健康研究,2000,17(2):42-43.
[14] 李善吉.微量元素与人体健康[J].广东微量元素科学,2001,8(7):4-8.
[15] 孔祥瑞,孔令晓.微量元素与免疫及其分子水平的作用机理[J].中国实用儿科杂志,1995,10(4):239-240.
[16] 张莹辉,刘美艳,覃建民.五种广枣总黄酮提取液抗人红细胞氧化作用的研究[J].中国民族医药杂志,2003,S1(S1):33.
[17] 寇晓虹,吴彩娥.中华大枣的营养食疗价值与开发利用[J].中国果菜,2000,4(4):43-44.
(编校:王俨俨)
Analysis of bioactive components of novel jujube beverage from LaolingZizyphusJujubacv. Jinsixiaozao
YANG Mei1,2, WANG Ying1,2, ZHAO Zhong-xi1,2Δ
(1.School of Pharmaceutical Sciences, Shandong University, Ji’nan 250100, China; 2.Shandong Engineering & Technology Research Center for Jujube Food and Drug, Ji’nan 250012, China)
ObjectiveTo detect the main nutritional components of novel jujube beverage from LaolingZizyphusJujubacv. Jinsixiaozao.MethodsFree monosaccharides in novel jujube juice were determined by the HPLC-RID method while water-soluble polysaccharides were analyzed by UV spectrophotometric method with the phenol-sulfuric acid derivatization. Amino acid and mineral contents were obtained by the automatic amino acid analyzer and atomic absorption photometric methods, respectively. The quantification of total phenolic and flavonoids was accomplished by the UV spectrophotometric method after the respective complexation of the Folin-Ciocalteu reagent and aluminum nitrate. The contents of rutin and cyclic nucleotides were determined by the HPLC-UV method.ResultsThe average contents of sucrose, glucose, fructose and polysaccharides in novel jujube juice were 3.85, 32.5,27.3 and 3.6 mg/mL, respectively. The total amino acid average content was 269.7 μg/mL. The mineral average contents of Ca, Fe, Mg, Zn, Mn, Cr, and Cu were 35.1,0.85, 55.8, 0.85, 0.44, 0.41, 0.21 μg/mL, respectively. The novel jujube juice contained average 1.34 μg/mL rutin equivalents of total phenolics and average 157.3 μg/mL gallic acid equivalents of total flavonoids. Finally, the average amounts of rutin, cAMP and cGMP were 7.15, 19.17 , and 8.11 μg/mL, respectively.ConclusionThe newly developed jujube juice is worthwhile further marketing development attributed to its rich nutritional components and healthy values.
jujube juice; free sugars; polysaccharides; amino acids; minerals; phenolics; flavonoids; cyclic nucleotides
国家重点基础研究发展计划(2012CB126315)
杨梅,女,硕士研究生,研究方向:功能食品开发,E-mail: yangmeilhn@foxmail.com;赵忠熙,通信作者,男,博士,教授,研究方向:新药创制及功能食品开发,E-mail: zxzhao@sdu.edu.cn。
S665.1
A
1005-1678(2015)11-0161-05

