大鼠脑出血后水肿组织中的PN-1、thrombin、PAR-1表达及其作用分析
谭燕萍,朱永坤,姚晖
(1.佛山市禅城区朝阳医院 药剂科,广东 佛山 528000;2.广东省东莞市第三人民医院 药学部,广东 东莞 523326;3.广东省佛山市第二人民医院 药学部, 广东 佛山 528000)
大鼠脑出血后水肿组织中的PN-1、thrombin、PAR-1表达及其作用分析
谭燕萍1Δ,朱永坤2,姚晖3
(1.佛山市禅城区朝阳医院 药剂科,广东 佛山 528000;2.广东省东莞市第三人民医院 药学部,广东 东莞 523326;3.广东省佛山市第二人民医院 药学部, 广东 佛山 528000)
目的 探讨脑出血(intracerebral hemorrhage,ICH)实验大鼠水肿周围脑组织中蛋白酶连接素-1(protease nexin-1,PN-1)、 凝血酶(thrombin)、蛋白酶激活受体-1(protease activated receptor-1,PAR-1)的表达变化及其作用分析。方法 选取成年健康雄性SD大鼠80只,编号后随机分为假手术组、ICH组,各40只。ICH组于右侧尾状核部注射自体动脉血方法制作ICH实验大鼠模型,分别于术后第12、24、120 h对2组大鼠的神经功能障碍程度进行评价;HE染色观察脑组织细胞中形态;Western blot分别于造模后第3、6、10、12、24、48及120 h检测2组大鼠脑组织中PN-1、thrombin、PAR-1实验指标的变化情况。结果 ICH组大鼠的神经功能障碍评分在造模后第12、48、120 h均显著的低于假手术组(P<0.05);ICH组大鼠在造模后第3、6、10、12、24、48及120 h的脑组织中PN-1、thrombin、PAR-1较假手术组均显著的增高(P<0.05);ICH组大鼠的脑组织中PN-1、thrombin、PAR-1在造模后12 h或24 h出现逐渐下降的趋势较造模后10 h或12 h(P<0.05)。结论 ICH实验大鼠血肿周围脑组织中PN-1有抑制thrombin及PAR-1过表达,引起神经损伤的作用。
脑出血;大鼠;脑组织;凝血酶抑制剂
脑出血(intracerebral hemorrhage,ICH)是指非外伤性脑实质内血管破裂引起的出血,占全部脑卒中的20%~30%,相关临床统计分析可见脑出血的发病率呈逐年上升趋势,脑出血可引起患者出现认知功能、语言功能以及中枢神经系统功能障碍,严重降低了脑出血患者的生存质量[1]。目前临床上对于脑出血的内科治疗尚无特效,主要通过脱水等对症处理。但外科治疗的方法和作用仍存在争议[2]。脑出血患者急性期主要表现为脑组织水肿,而出血部分脑组织的水肿程度对于内、外科治疗效果具有极为重要的意义。有研究发现在脑水肿组织周边存在凝血酶的异常表达[3]。本研究重在探讨凝血酶、凝血酶受体以及凝血酶抑制剂在脑出血周边水肿组织内的表达情况,进而揭示凝血酶对于脑出血的诊治意义。
1 材料与方法
1.1 材料
1.1.1 实验动物:选取成年健康雄性SD大鼠80只(8~9周龄),编号后随机分为假手术组、ICH组,各40只,体质量260~300 g,平均体质量(272.4±13.9)g,购自广东中山医科大学动物实验研究中心(许可证号:201500002),饲养于23 ℃~25 ℃、湿度40%~60%、光照12 h、自由进食、进水的环境中。
1.1.2 药品与试剂:Trizol 试剂(Sigma 公司);dNTP、 AMV、0. 22 μm硝酸纤维素膜(郑州宝赛生物科技公司);焦炭酸二已酯、琼脂糖(INVITROGEN 公司);Whaterman 3mm 滤纸、兔多克隆抗 iNOS 抗体(上海生物工程技术服务有限公司);乙二胺四乙酸二钠(EDTA)(上海政祥化学试剂有限公司);三羟甲基氨基甲烷,二硫苏糖醇(Solarbio公司);甘氨酸、十二烷基磺酸钠、考马斯亮蓝 R250、丙烯酰胺、过硫酸铵、溴酚蓝、Tween 20 TEMED(Sigma 公司);DAB试剂盒(浓缩型)(北京中杉金桥生物技术有限公司)。
1.1.3 仪器:电热恒温培养箱JC303A-T型(成都一恒科技有限公司);生物组织包埋机BMJ-1(天津航空机电有限公司);电热恒温水浴箱(杭州蓝天化验仪器厂);大鼠脑立体定位仪(美国STOELTING公司);CUT5062型组织切片机(德国施利精密技术公司);图像分析系统(美国Image-Pro P1us);PV-6000免疫组化二步法检测试剂盒(北京中杉金桥生物技术有限公司)。 OLYMPUS IX71倒置显微镜(日本奥林巴斯公司)。
1. 2 方法
1.2.1 造模方法[4]:大鼠以10%水合氯醛(330 mg/kg)腹腔麻醉后,剪尾取50 μL自体新鲜不凝血,于前囟前0.22 mm、中线向左旁开3 mm处钻孔,在立体定向仪引导下缓慢进针注血。进针深约5 mm(此为左侧尾状核位置),进针时间3 min,留针时间10 min,之后缓慢退针。实验前后各组大鼠均可自由进食水。假手术组除脑内不注入血液外,其余操作同ICH模型组。模型成功的判定标准为术后见明显肢体瘫痪,沿针道冠状面切开脑组织可见血肿形成[5]。实验中2组各有4只大鼠死亡。造模成功率为90%。
1.2.2 观察指标:分别于术后第12、24、120 h对2组大鼠的神经功能障碍程度进行评价(采用Carica等制定的大鼠神经功能障碍评分标准,最高18分、最低分3分,分数越低表示神经功能障碍越严重);分别于造模后第3、6、10、12、24、48及120 h检测2组大鼠脑组织中PN-1、凝血酶(thrombin)、蛋白酶激活受体-1(PAR-1)的变化情况。
1.2.3 HE染色:切片在二甲苯中脱蜡5~10 min。移入二甲苯和纯酒精(1:1)混合液中5 min左右(如经2次二甲苯脱蜡,此步可略)。加入100%、95%、85%、70%酒精,各级为2~5 min。最后经蒸馏水转入染液。苏木精染液染色5~15 min。水洗玻片上多余染液,0.5%~1%盐酸酒精(70%酒精配制)分色片刻。镜检控制,直至细胞核及核内染色质清晰为止,约数10 s。流水冲洗15~30 min,或者在碳酸锂饱和液中短时间碱化或蓝化,即细胞核呈蓝色。蒸馏水短洗。0.1%~0.5%伊红染液染色1~5 min,若着色困难,可在每100 mL染液中加入1~2滴冰醋酸,使易着色且不易脱色。依次经70%、85%、95%、100%酒精脱水,各级为2~3 min,在95%以下浓度的酒精中伊红易脱色,应适当缩短时间。二甲苯透明(2次),共约10 min。封片:擦去切片周围多余二甲苯,切勿干涸,迅速滴加适量中性树胶,再加盖玻片封固
1.2.4 Western blot法:冰上分离出血肿周边脑组织(假手术组为左侧尾状核),置于预冷的研钵中液氮研磨至粉末状。冰上静置1 h,4 ℃下14000 r/min离心30 min,去沉淀组织留上清液.考马斯亮蓝显色法测定蛋白浓度,分装。-70 ℃冻存。按总蛋白80 g计算上样体积,4:1的比例加上样缓冲液,每条泳道加20 μL样品缓冲液,于60 V电压下跑胶,脱脂蛋白封闭2 h,羊抗PN一抗体(1:200)、羊抗凝血酶抗体(1:500)、鼠抗PAR.1抗体(1:150),2 h后加入二抗(兔多克隆抗iNOS 抗体,稀释:1:10)。Image proplus 4.01版本的专业图像分析软件进行图像分析。

2 结果
2.1 2组大鼠不同时间点的神经功能障碍评价 ICH组大鼠的神经功能障碍评分在造模后第12、48、120 h均显著低于假手术组(P<0.05)。见表1。
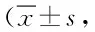
表1 2组大鼠不同时间点的神经功能障碍评分比较分)Tab.1 Comparison of Neurological disorders scores between two groups rats at different time points(±s,scores)
*P<0.05,与假手术组比较,compared with sham operation
2.2 HE染色结果 倒置显微镜下可见假手术组大鼠脑组织结构清晰完整,神经细胞排列整齐,未发现明显的细胞肿胀、细胞核固缩及溶解;ICH组大鼠在造模第12、48、120 h可见明显的细胞排列紊乱、核溶解、固缩,炎症细胞浸润,可见部分脑组织出现液化坏死、呈空腔隙状。见图1。
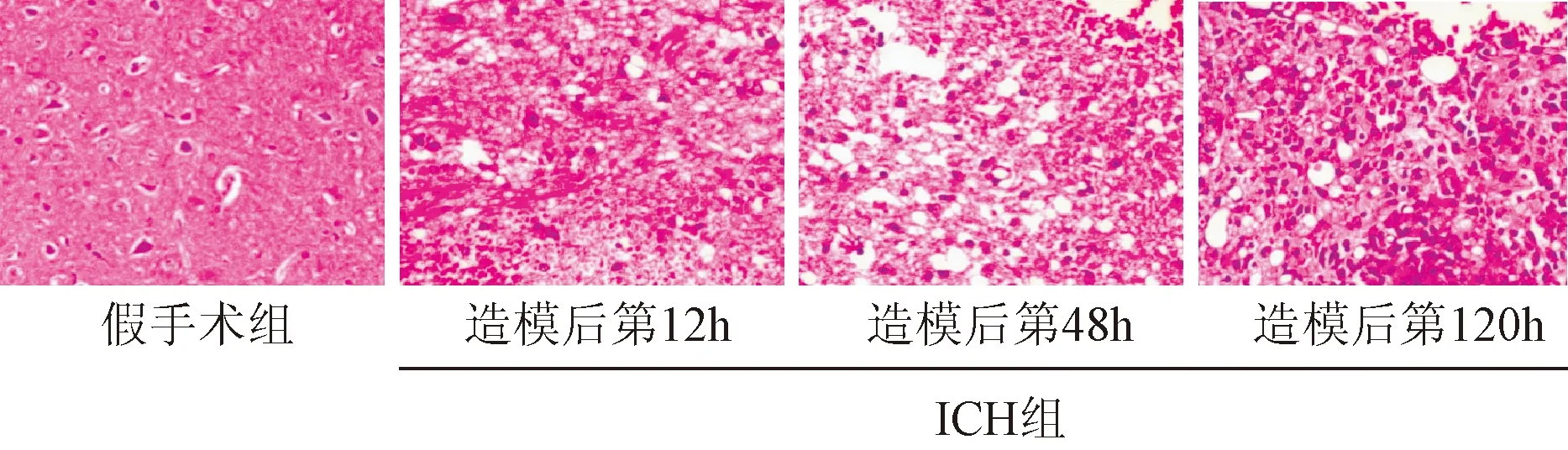
图1 假手术组和ICH组脑出血周围组织病理变化(HE,×400)Fig.1 Sham group and ICH groups around the pathological changes of brain hemorrhage(HE,×400)
2.3 2组大鼠不同时间点的脑组织中PN-1、thrombin、PAR-1变化情况 2组大鼠不同时间点的脑组织中PN-1、Thrombin和PAR蛋白表达见图2。ICH组大鼠在造模后第3 h、6 h、10 h、12 h、24 h、48 h及120 h的脑组织中PN-1、thrombin、PAR-1表达量均较假手术组明显增高(P<0.05);ICH组大鼠的脑组织中PN-1、thrombin、PAR-1在造模后12 h出现逐渐下降的趋势(P<0.05)。见表2、3、4。
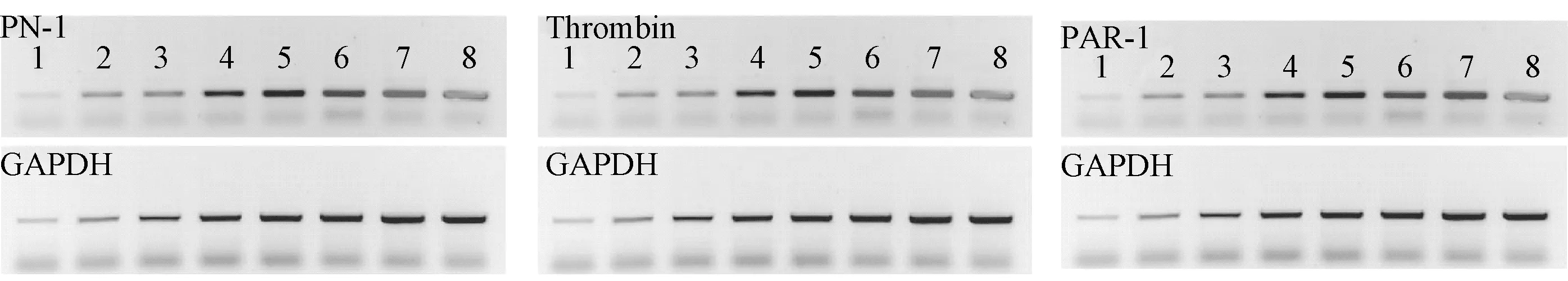
图2 PN-1、Thrombin和PAR蛋白表达的Western blot图1:假手术组;2-8:分别为ICH组造模后第3、6、10、12、24、48及120 h Fig.2 PN-1, Thrombin and PAR protein expression by Western blot1:sham operation group; 2-8: corresponding to 3,6,10,12,24,48 and 120 h of ICH group after modeling

组别只数造模后3h造模后6h造模后10h造模后12h造模后24h造模后48h造模后120h假手术组360.45±0.050.46±0.100.47±0.080.51±0.130.42±0.090.41±0.050.40±0.07ICH组360.88±0.11△0.97±0.09Δ1.29±0.06△1.47±0.12△0.94±0.08△▲0.87±0.06△▲0.82±0.05△▲
△P<0.05,与假手术组比较,compared with sham operation group;▲P<0.05,与造模后第12h比较,compared with 12h after establishment of models
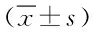
表3 2组间PN-1表达相对量比较
△P<0.05,与假手术组比较,compared with sham operation;▲P<0.05,与造模后第12h比较,compared with 12h after establishment of models
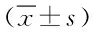
表4 2组间PAR-1表达相对量比较
△P<0.05,与假手术组比较,compared with sham operation;▲P<0.05,与造模后 12h 比较,compared with 12h after establishment of models
3 讨论
脑出血患者经内科治疗或者外科清除血肿后,部分会出现合并不同的神经系统功能损伤,言语、听写以及运动功能损伤较为突出[6]。除了颅内血管出血部位及出血程度的影响,对于脑出血患者脑组织周边水肿程度的分析也利于揭示患者术后出现不同并发症的原因,并有利于预后判断。凝血酶为内源性以及外源性凝血途径的共同作用通路,凝血酶活性或者量的异常对于维持血管内凝血机制具有重要意义。凝血酶的异常表达可能预示弥漫性血管内凝血的凝血状态、疾病转归以及病情程度,而其在脑出血中的研究较少。近年来部分学者发现,在基底节脑出血周边组织中存在凝血酶的异常激活和上调,其受体PAR-1表达也异常增高[7]。正常脑组织中,中枢神经系统的神经元包括大脑皮层扣带回、皮质、下丘脑核团、丘脑腹侧、中脑、海马和小脑的神经元,均存在一定程度的PAR-1的表达,但HE染色多数较弱,蛋白水平表达程度较低,而血管内皮细胞中PAR-1的表达不清[8]。Thrombin抑制剂PN-1通过阻断凝血酶与细胞膜表面的PAR-1的结合,进而降低细胞内三磷酸尿苷以及络氨酸激酶的活性,下调在Xa因子(FXa)因子的作用下通过蛋白裂解的方式产生的凝血活酶,抑制凝血酶对于脑水肿组织的损伤作用[9]。本次研究重在探讨凝血酶、凝血酶抑制剂以及凝血酶受体在大鼠脑出血模型中的表达差异。
2组大鼠造模后可见ICH组的神经系统功能评分明显降低,HE染色可以发现假手术组大鼠脑组织结构清晰完整,神经细胞排列整齐,而ICH组大鼠脑细胞水肿以及坏死较为严重,细胞核崩解、碎裂,周边神经胶质细胞可见部分腔隙样以及液化性坏死,提示了本次造模的成功。本研究发现,PN-1、Thrombin、PAR-1在脑出血大鼠脑组织中异常表达,其表达水平明显高于假手术组,考虑脑出血对于脑组织的损伤不仅通过局部压迫、血液凝固机化的损伤以及牵拉等作用,同时脑出血大鼠中凝血酶以及凝血酶作用受体的表达异常上升,促进神经纤维的细胞毒性损伤作用,而凝血酶抑制剂PN-1也继发性显著表达。时间特异度分析可见,在脑出血大鼠水肿吸收恢复期,凝血酶以及PAR-1、PN-1等呈现了下降的趋势,脑出血后12h内,凝血酶对于出血脑血管通透性的改变促进了PAR-1对于水肿部位脑组织的损伤,而造模后12h,由于脑水肿部分水通道的关闭,凝血酶以及PAR-1对于受损部位神经纤维的水通道开放作用减弱,表达水平降低。凝血酶抑制剂PN-1通过特异性抑制凝血酶对于炎症因子以及小胶质细胞富集作用,进而降低脑水肿程度[10]。本研究中并未发现PN-1与脑组织的水肿程度或者病情的恢复具有显著的相关关系,考虑PN-1作为神经系统内存在的特异性较高的凝血酶抑制剂,可以与凝血酶的非催化中心位点结合,形成十二烷基磺酸盐复合物,与损伤的神经纤维表面糖蛋白结合[11],通过低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein,LRP)或者细胞膜的胞饮作用进入细胞内被降解或清除,减轻了凝血酶以及PAR-1对于脑水肿细胞的损伤[12]。
综上所述,ICH实验证实大鼠水肿周围脑组织中PN-1与Thrombin、PAR-1异常表达,其中Thrombin、PAR-1与脑水肿损伤有关,而PN--1可减轻凝血酶对于脑出血周边神经细胞的损伤作用,PN-1的这一作用揭示其可以作为脑出血患者内科治疗的新途径,通过在脑出血急性期外源性注射PN-1细胞因子,进而减轻脑出血水肿细胞损伤,改善临床预后。
[1] 吴燕, 李淮玉, 李虎. 1298例自发性脑出血流行病学与临床特点分析[J]. 中国循证医学杂志,2010,10(11):1256-1258.
[2] 袁葛,赵继宗. 脑出血的病因学和外科治疗[J].国外医学脑血管疾病分册,2004,12(5):337-340.
[3] 王亮,张建富,刘海珠. 凝血酶在脑出血中的作用研究现状[J]. 山东医药,2014,54(15):95-97.
[4] Durukank,Tatlisuma KT.Preconditioning-induce dischemicto-erance:awindow intoendo erance:awind owintoend ogenous gearing for cerebrop rot ection[J].Exp Transl Stroke Med,2010,2(1):2.
[5] 崔景军, 何娇君, 李晶,等. 大鼠大脑中动脉梗死模型的评价标准探讨[J]. 天津中医药,2013,30(1):33-35.
[6] 杨伟东. 脑出血后脑组织凝血酶的表达与颅内压和预后的关系[D].天津:天津医科大学,2007.
[7] 肖兵,胡长林. 脑出血后凝血酶的神经毒性作用[J]. 国外医学(脑血管疾病分册),2004,12(12):911-913.
[8] 舒鑫. 亚低温对脑出血大鼠HIF-1α、SOCS-3、Caspase-3表达影响的实验研究[D]. 泸州:泸州医学院,2013.
[9] 胡枢坤. 凝血酶在脑出血后脑损伤和脑康复过程中不同作用的机制研究[D].上海:复旦大学,2011.
[10] 刘飞飞. 蛋白酶激活受体在凝血酶诱导脑损伤及神经再生中的作用[D].杭州:浙江大学,2013.
[11] 陈秀,李作孝,佟琳,等. 实验性脑出血血肿周围脑组织自由基含量变化研究[J]. 泸州医学院学报,2005,28(5):417-419.
[12] 郑国庆,黄汉津,王小同. 脑出血后凝血酶的作用与抗凝血酶治疗[J]. 国外医学(脑血管疾病分册),2005,13(3):199-202.
(编校:王冬梅)
Expression and role of PN-1, thrombin and PAR-1 in rats brain edema tissue after intracerebral hemorrhage
TAN Yan-ping1Δ, ZHU Yong-kun2, YAO Hui3
(1. Department of Pharmacy, Foshan Chancheng Chaoyang Hospital, Foshan 528000, China; 2. Department of Pharmacy, Dongguan the Third People’s Hospital of Guangdong Province, Dongguan 523326, China; 3. Department of Pharmacy, Foshan People’s Hospital of Guangdong Province,Foshan 528000,China)
ObjectiveTo investigate expression and role of protease catenin-1(PN-1), thrombin(thrombin), protease activated receptor-1(PAR-1) in rats brain edema tissue after intracerebral hemorrhage(ICH).MethodsAdult male SD rats 80 were randomly divided into sham group,ICH group after number, 40 in each group, ICH group autologous arterial method of making a rat model of experimental ICH in the right caudate nucleus unit injection. The degree of neurological dysfunction between 2 groups was evaluated at 12 h,24 h and 120 h after post-operation. Observed the morphology of brain cells by HE staining. Changes of PN-1,thrombin, PAR-1 index in rat brain tissue at 3,6,10,12,24,48 and 120 h were detected by Western blot.ResultsNeurological dysfunction score ICH rats after modeling 12,48,120 h were significantly lower than the sham group(P<0.05); ICH in rats after modeling 3,6,10,12,24,48 and 120 h of brain tissue PN-1, thrombin, PAR-1 compared with sham-operated group were significantly increased(P<0.05); ICH rat brain tissue PN-1, thrombin, PAR-1 appeared in 12 h after modeling shwed a gradual downward trend(P<0.05).ConclusionICH hematoma surrounding brain tissue in rats PN-1 has the effect of inhibiting thrombin and PAR-1 overexpression, cause nerve damage.
intracerebral hemorrhage; rat; brain; thrombin inhibitors
广东省中医药管理局中医药强省课题(20121088)
谭燕萍,通信作者,女,硕士,副主任中药师,研究方向:中药药学及临床研究,E-mail:15212782883@qq.com。
R743.34
A
1005-1678(2015)11-0022-04

