国产乌司他丁对丝氨酸蛋白酶抑制效果的体外研究
陈健文,张仁伟,温炜杰,黎思彤,刘翠,刘培庆,李民
(中山大学 药学院 新药筛选中心,广州 510006)
国产乌司他丁对丝氨酸蛋白酶抑制效果的体外研究
陈健文,张仁伟,温炜杰,黎思彤,刘翠,刘培庆,李民Δ
(中山大学 药学院 新药筛选中心,广州 510006)
目的 系统比较国产乌司他丁对凝血和抗凝血系统中的凝血因子10、纤溶酶、凝血酶、激肽原酶以及多形核粒细胞弹性蛋白酶活性的抑制效果,为临床研究的剂量选择提供依据。方法 设计合成生色底物,分别采用灵敏的荧光检测方法,优化反应过程酶和底物的浓度。采用多点法测定并计算乌司他丁对各种丝氨酸蛋白酶的半数抑制率。结果 乌司他丁可以明显抑制多型核粒细胞弹性蛋白酶(polymorphonuclear leukocyte elastase,PMNE)和纤溶酶,IC50均低于100 U/mL。对凝血因子Xa以及激肽原酶抑制均高于1000U/mL,但对凝血酶无抑制作用。结论 国产乌司他丁对PMNE的抑制效果最强,与日本同类产品对这几种丝氨酸蛋白酶的抑制效果相似,为其在抗炎、抗凝、促凝及抗休克效果中选择合适的剂量区间提供了可靠数据。
乌司他丁;抗凝血;丝氨酸蛋白酶;荧光检测
在哺乳类动物里面,丝氨酸蛋白酶扮演着很重要的角色,特别是在消化,凝血和补体系统方面。凝血因子X(Factor Xa),是参与内源性和外源性凝血途径的一种耐贮存因子。缺乏可致系统性凝血障碍。凝血第11因子,即是血浆凝血酶活酶前质作用于内源性凝血途径的一种稳定因子,缺乏这种因子会引起系统性血凝缺陷。凝血酶来自凝血酶原,可促使纤维蛋白原变为纤维蛋白的酶。纤维蛋白溶酶是溶解纤维蛋白或血凝块系统的有效部分,是对纤维蛋白有高度特异性的蛋白分解酶,对已经形成的纤维蛋白凝块有特别的溶解力,对其他血浆蛋白、凝固因子和一般蛋白质也有类似作用[1-3]。急性胰腺炎是胰酶大量释放激活并诱导细胞因子释放,进而导致胰腺组织的自身严重破坏,并可能危及其他重要器官的一种疾病。休克或体外循环手术等循环障碍时,机体产生大量内毒素,大量巨噬细胞和中性粒细胞聚集,细胞溶酶体膜被破坏,释放大量蛋白酶,如中性粒细胞弹性蛋白酶、各种组织蛋白酶、胶原酶、血浆酶原激活因子、类胰蛋白酶等,具有很强的损坏作用,乌司他丁可以抑制上述蛋白酶的活性,因此在生理上和药理上都有重要意义[4-6]。
乌司他丁为新鲜人尿中提取的一种能抑制多种蛋白水解酶活力的酸性糖蛋白。含有143个氨基酸,分子量约67 000道尔顿。乌司他丁存在2个Kunitz结构域,对丝氨酸蛋白酶有抑制作用,参与凝血、纤维蛋白溶解、补体激活、炎症反应及组织重建过程。Kunitz结构域可抑制弹性蛋白酶、凝血因子V、VIII、XIII、Xa、纤溶酶、激肽原酶等活性[7-8]。乌司他丁除对多种蛋白酶、糖和脂水解酶有抑制作用外,还能改善休克时的循环状态,对溶酶体膜有稳定作用,抑制炎症介质的释放等功能。大量的临床研究表明乌司他丁在治疗急性胰腺炎、脓毒症、减少体外循环并发症、减轻手术对器官的损伤、预防肿瘤化疗引起肾毒性等方面显示出极好的疗效和较强的脏器功能保护作用[9-11]。
本研究旨在通过体外测定国产乌司他丁对多形核粒细胞弹性蛋白酶、凝血因子Xa、纤溶酶、凝血酶、激肽原酶的IC50,了解乌司他丁对这些丝氨酸蛋白酶的抑制能力差异,为该药物在抗炎、抗凝/促凝及抗休克效果的剂量区间以及动物研究和临床研究剂量提供参考。
1 材料与方法
1.1 实验材料 凝血酶(Thrombin, bovine)购自上海经科化学科技有限公司(货号JK-034-1000U);纤溶酶(Plasmin, human)购自Biovision(货号4089-1000);凝血因子X(Factor Xa)购自艾德豪克国际技术有限公司(货号AG00-0121);激肽原酶(Kallikrein)购自生工生物工程上海有限公司(货号KB0545);多形核粒细胞弹性蛋白酶(Polymorphonuclear leukocyte elastase,PMNE)购自Innovative Research(货号IHNE);多肽S-2266(货号P130514-MY352502)、S2238(货号P130514-MY352505)、S2765(货号P130514-MY302220)、S2251(货号P130514-MY245955)均购自吉尔生化(上海)有限公司;MeOSuc-AAPV-AMC购自Enzo life sciences(货号BML-P224-0005);注射用乌司他丁由广东天普生化医药股份有限公司提供(冻干粉,10万U/瓶,批号021110031);DMSO购自MP Biomedicals(货号196055)。其他相关试剂均购自生工生物工程上海有限公司。
1.2 实验仪器 酶学反应检测采用多功能酶标仪工作站Tecan Infinite2000(Tecan,瑞士);96孔白板(Corning,美国)。溶液配制用水使用纯水机Millipore-Q-Synthesis(Millipore Ltd.,法国);恒温采用金属浴水立方(金银杏生物科技有限公司,北京)。
1.3 方法
1.3.1 溶液配制:反应缓冲体系为Tris buffer(Tris 50 mM,NaCl 150 mM,pH 8.0)。各蛋白酶和乌司他丁均用此溶液配制。母液配制浓度分别为:乌司他丁母液为100 U/μL;凝血酶母液为1.25 IU/mL;凝血因子Xa母液为1.25 U/mL;激肽原酶母液为10 mg/mL;纤溶酶母液为2 mg/mL;PMNE母液1 μg/mL。各多肽生色底物采用DMSO溶解配制,母液为10 mM。
1.3.2 反应条件的优化:本实验反应采用2种基于不同96孔板的方法测定。一种为针对凝血因子X、凝血酶、纤溶酶、激肽原酶在405 nm波长下的吸收值变化,采用底部透明的96孔板;另一种为针对弹性蛋白酶和PMNE的荧光检测,激发波长380 nm,发射波长460 nm,采用白色不透明96孔板。反应体系均为200 μL/孔。实时检测荧光变化,根据反应结束时的OD在10000~2000之间,确定底物浓度。固定浓度的底物再与蛋白酶孵育反应,根据达到最大反应效果的时间约30 min,确定蛋白酶的浓度。
1.3.3 酶反应的测定:根据所确定的反应条件,各蛋白酶与乌司他丁在37 ℃混合孵育20 min,然后加入底物,连续读取荧光变化。截取20 min内的线性部分计算酶反应的斜率,以抑制前后的斜率变化百分比作为抑制率,进而计算乌司他丁抑制不同蛋白酶的效果(IC50)。所有蛋白酶的抑制测定均按照如上步骤进行。抑制剂乌司他丁为100000 U/mL,反应最终体积均为200 μL。各类蛋白酶的测定均重复3次,用于结果计算。

2 结果
2.1 各蛋白酶与底物反应浓度的确定 通过检测最大荧光吸收即OD405 nm在1.0~1.5之间,确定了凝血因子X、凝血酶、纤溶酶、激肽原酶对应的底物浓度。见表1。通过检测最大荧光强度,确定在20000左右,采用激发波长为380 nm,发射波长为460 nm,得到PMNE的最适反应底物浓度。在37 ℃反应条件下,各反应最适条件总结见表1。
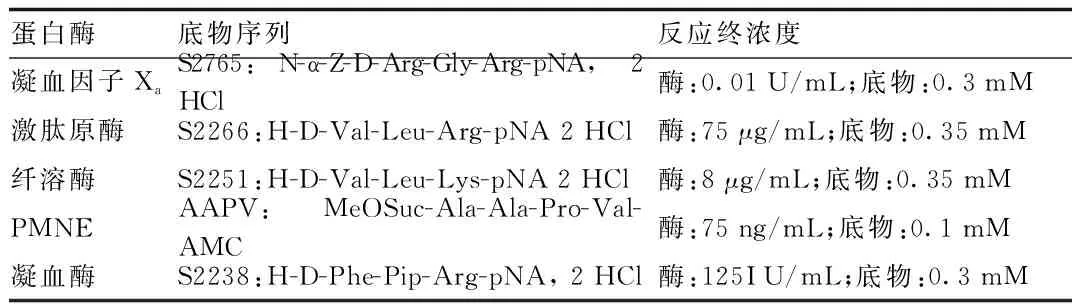
表1 各蛋白酶与其底物的最适反应条件Tab.1 Optimum concentration for each enzymes and substrates
2.2 乌司他丁对凝血因子Xa活性的抑制效果 在预实验中得到凝血因子Xa的最佳作用底物浓度和蛋白浓度分别为底物0.3 mM,酶0.01 U/mL(见表1)。在此条件下改变抑制剂乌司他丁的浓度(0~5000 U),根据单位时间的荧光变化计算反应速率。测得乌司他丁对凝血因子10的半数抑制浓度IC50为310 U(见图1),即1550 U/mL。

图1 乌司他丁抑制凝血因子Xa的IC50测定Fig.1 IC50 measurement of Ulinastatin on inhibition of Factor Xa
2.3 乌司他丁对激肽原酶活性的抑制效果 在预实验中得到激肽原酶的最佳作用底物浓度和蛋白浓度为底物0.35 mM,酶75 μg/mL(见表1)。在此条件下改变抑制剂乌司他丁浓度(0~15000 U),计算反应速率。测得乌司他丁对激肽原酶的半数抑制浓度IC50为2010 U(见图2),即10050 U/mL。
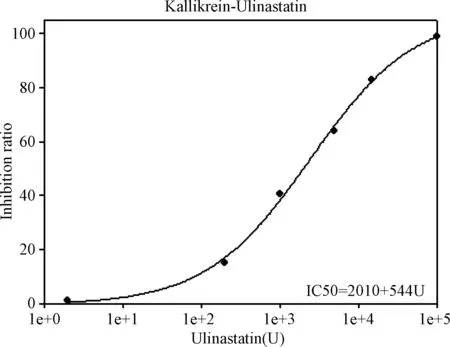
图2 乌司他丁抑制激肽原酶的IC50测定Fig.2 IC50 measurement of Ulinastatin on inhibition of kallikrein
2.4 乌司他丁对纤溶酶活性的抑制效果 在预实验中得到纤溶酶的最佳作用底物浓度和蛋白浓度为底物0.35 mM,酶8 μg/mL(见表1)。在此条件下改变抑制剂乌司他丁浓度(0~1000 U),计算反应速率。测得乌司他丁对纤溶酶的半数抑制浓度IC50为14.1 U(见图3),即70.5 U/mL。

图3 乌司他丁抑制纤溶酶的IC50测定Fig.3 IC50 measurement of Ulinastatin on inhibition of plasmin
2.5 乌司他丁对PMNE以及弹性蛋白酶活性的抑制效果 在预实验中得到PMNE的最佳作用底物浓度和蛋白浓度为底物0.1 mM,酶75 ng/mL(见表1)。在此条件下改变抑制剂乌司他丁浓度(0~20 U),计算反应速率。测得乌司他丁对PMNE的半数抑制浓度IC50为0.53 U(见图4),即2.65 U/mL。
图4 乌司他丁抑制PMNE的IC50测定Fig.4 IC50 measurement of Ulinastatin on inhibition of PMNE
2.6 乌司他丁对凝血酶活性的抑制效果 选择凝血酶非特异性抑制剂PMSF进行对照,检验反应体系的抑制效率,可以测得PMSF对凝血酶的半数抑制IC50为0.46 mM(见图5),表明反应体系可靠。在相同实验条件下,配制乌司他丁最大浓度在15000 U,即75000 U/mL时,对凝血酶抑制率仅为98%,由于用量超出给药范围,因此无法计算IC50。即乌司他丁对凝血酶无抑制作用。

图5 PMSF抑制凝血酶的IC50测定Fig.5 IC50 measurement of Ulinastatin on inhibition of thrombin
2.7 比较国产和日产乌司他丁对酶的抑制能力 在本实验条件下,乌司他丁可以明显抑制多型核粒细胞弹性蛋白酶(PMNE)和纤溶酶,IC50均低于100 U/mL。对凝血因子X以及激肽原酶抑制均高于1000 U/mL,但对凝血酶没有抑制作用。与日本持田公司同类产品(Miraclid)对各丝氨酸蛋白酶的抑制趋势相似[18],即不同来源乌司他丁均对PMNE表现出最强的的抑制效果(见表2)。

表2 乌司他丁对不同丝氨酸蛋白酶的抑制能力Tab.2 Comparation of the inhibitory effect of different Ulinastatin products against serine proteases
3 讨论
凝血过程包括内源性凝血途径和外源性凝血途径,其中凝血因子X激活为Xa是内外源性凝血的共同途径,抑制凝血因子X的激活能同时抑制内外源性凝血[12]。激肽原酶裂解激肽原,形成缓激肽和胰激肽,使血管扩张,血压下降。有研究提示乌司他丁可能通过抑制激肽释放酶,使血压回升[13]。体内凝血和纤溶两系统是相互依存紧密相联的。机体一旦产生凝血反应,也几乎同时激活了纤溶系统,使体内多余的血栓移去,从而避免纤维蛋白的过多凝聚。纤溶过程中,最关键的环节是纤溶酶原被激活为纤溶酶,作用于凝血块中的纤维蛋白,使其溶解[14]。体内粒细胞弹性蛋白酶及其内源性抑制剂的平衡失调可导致组织基质降解和炎症的恶化。基础和临床研究提示,乌司他丁可抑制中性粒细胞弹性蛋白酶活性,减轻炎症反应和组织损伤[15-16]。凝血酶的生理功能与其丝氨酸蛋白酶的活性有关,能裂解纤维蛋白原而形成纤维蛋白凝块,从而促进血液凝块的形成。凝血酶在体内以凝血酶原形式存在。在凝血过程中凝血酶原复合物将其激活而转变为有丝氨酸蛋白类水解活性的凝血酶[17]。本研究系统检测了国产乌司他丁对凝血和抗凝血系统关键丝氨酸蛋白酶的抑制作用。实验采用的是生色底物方法,此方法灵敏度高,特异性好,操作方便,同时也便于在同一反应条件下比较抑制效率。由于日本同类产品的IC50未标明具体底物和方法,暂无法横向比较不同来源的乌司他丁对同一蛋白酶的效果。本研究为确定国产乌司他丁抗炎、抗凝、促凝及抗休克效果的剂量区间,进而为动物研究和临床研究剂量选择提供了可靠数据。
[1] Meister A,Davie EW,Fujikawa K,et al.Advances in Enzymology and Related Areas of Molecular Biology Volume 48 [M].Wiley,2006:125-301.
[2] Hedstrom L.Serine protease mechanism and specificity [J].Chem Rev,2002,102 (2):4501-4524.
[3] 李民,杨青,包永明,等.蛇毒类凝血酶的研究进展[J].生命科学研究,2002,6(S1):61-66.
[4] Inoue K,Takano H.Urinary trypsin inhibitor as a therapeutic option for endotoxin-related inflammatory disorders [J].Expert Opin Investig Drugs,2010,19(4):513-520.
[5] 上海乌司他丁临床试验协作组.国产乌司他丁治疗急性胰腺炎的多中心临床研究[J].中华消化杂志,2001,21(5):293-296.
[6] 徐震,王卓强,刘秀珍,等.乌司他丁对人凝血功能影响的体外观察[J].解放军医学杂志,2009,34(12):1445-1447.
[7] 曾文红,白国强.乌司他丁研究进展[J].中华肝胆外科杂志,2001,7(1):52-54.
[8] 张廷伟.乌司他丁的药理作用及临床应用进展[J].中国药房,2007,18(35):2788-2789.
[9] Luo GJ,Yao WF,He Y,et al.Ulinastatin prevents acute lung injury led by liver transplantation [J].J Surg Res,2015,193(2):841-848.
[10] Karnad DR,Bhadade R,Verma PK,et al.Intravenous administration of ulinastatin (human urinary trypsin inhibitor) in severe sepsis:a multicenter randomized controlled study [J].Intensive Care Med,2014,40(6):830-838.
[11] Zhang L,Wang N,Zhou S,et al.Preventive effect of ulinastatin on postoperative complications,immunosuppression,and recurrence in esophagectomy patients [J].World J Surg Oncol,2013,11(1):84-90.
[12] 陈浩,王永庆,孟玲,等.凝血因子Xa抑制剂研究进展[J].药学与临床研究,2013,21(6):655-659.
[13] 陈思伊,庄贞静,许瑞安.Kallistatin 结构功能与信号通路[J].中国生物化学与分子生物学报,2012,28(3):197-202.
[14] 李陆,阎嘉,刘佳,等.凝血因子及血浆蛋白类制品的研究现状及发展前景[J].现代生物医学进展,2009,14(18):3578-3580.
[15] Cao YZ,Tu YY,Chen X,et al.Protective effect of Ulinastatin against murine models of sepsis:Inhibition of TNF-α and IL-6 and augmentation of IL-10 and IL-13 [J].Exp Toxicol Pathol,2012,64(6):543-547.
[16] 邓振,何庆丰,彭礼飞.中性粒细胞丝氨酸蛋白酶及其抑制剂与炎症[J].中国药理学通报,2014,30(3):314-317.
[17] 赖翼,刘阳,林方昭,等.凝血酶研究概况[J].血栓与止血学,2009,15(3):142-144.
[18] 江田兼弘,加藤克明,長尾祐二,等.抗変形性関節症薬の作用機序の検討[J].日药理志,1992,99(2):93-107.
(编校:吴茜,谭玲)
《中国生化药物杂志》 2015年全体编委会会议纪要
《中国生化药物杂志》2015年编委会于2015年7月29日在北京顺利召开。包括主编和9位副主编在内的57位编委成员和《中国生化药物杂志》编辑部全体成员出席会议。
本次会议由《中国生化药物杂志》主编詹启敏院士主持。大家听取了编辑部主任黄景新对《中国生化药物杂志》2014年复刊以来的工作的总结;责任编辑吴茜演示了官网审稿流程;编委们对《中国生化药物杂志》编委会章程草案进行了简单讨论;对如何更好地提高《中国生化药物杂志》刊物质量,以及争取早日重返我国核心期刊名单,入选CSCD数据库等展开了热烈讨论。与会编委一致认为:清晰、独特的杂志定位与获取高质量的稿件是杂志未来发展的关键,大家就如何更好地丰富期刊内容、形成自身特色、拓宽优秀稿源途径等提出大量很好的意见和建议。
主编詹启敏院士在总结发言中充分肯定了编辑部的工作,并对各编委提出的意见和建议给予了高度评价。他明确指出:杂志的发展不能仅仅依靠编辑部,还要借助编委会专家团队的力量,多方形成合力,才能起到强有力的推动作用。詹院士坦言,尽管已经取得了一定进步,但杂志质量还有很大的提升空间,做杂志就是建设一个系统工程,每一个环节都至关重要。他明确表示:愿意跟大家一起,共同努力,将《中国生化药物杂志》办好,力争将其办成领域内的、未来在国际上有一定影响力的杂志。与会编委亦纷纷表示,要积极参与编辑部的审稿和组稿工作,尽心尽力为杂志的发展贡献力量。
In vitro study of inhibitory effect of Ulinastatin against serine protease activity
CHEN Jian-wen, ZHANG Ren-wei, WEN Wei-jie, LI Si-tong, Liu Cui, LIU Pei-qing, LI MinΔ
(Center for Drug Screening, School of pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China)
ObjectiveTo study inhibitory effect of serine protease activity by Ulinastatin in vitro.MethodsDifferent chromogenic peptides were designed and synthesized.Highly sensitive fluorescence detection was performed to optimize the concentration of each serine proteases and their chromogenic substrates.Multi-point method was used for the calculation of half maximal inhibitory concentration of Ulinastatin.ResultsUlinastain could inhibit Polymorphonuclear leukocyte elastase (PMNE) and plasmin with IC50 lower than 100 U/mL.For factor Xa, and Kallikrein, the IC50 of Ulinastatin was higher than 1000U/mL.No thrombin IC50 could be calculated at the present experiments.ConclusionSimilar to Ulinastatin injection from Japan, domestic Ulinastatin shows the strongest inhibitory effects on PMNE among those serine proteases.As important references, this study gives reliable data for dose range of domestic Ulinastatin in anti-inflammation, coagulation/anti-coagulation and anti-shock therapy.
Ulinastatin; anti-coagulant; serine protease; fluorescence detection

陈健文,男,硕士,主管技师,研究方向:药理毒理与药效评价,E-mail: 573016880@qq.com;通讯作者,李民,男,博士、副教授,研究方向:药物筛选与药物评价,E-mail:limin65@mail.sysu.edu.cn。
R965
A
1005-1678(2015)08-0015-04

