养殖可口革囊星虫纤溶酶分离纯化及酶学特性研究
蔡彬新,周逢芳,3,阮少江,黄伟卿,3,刘聪颖,苏 愉
( 1.宁德师范学院 生命科学学院,福建 宁德 352100; 2.海西海洋特色生物种质资源与生物制品开发公共服务平台,福建 宁德 352100; 3.闽东水产品精深加工福建高校工程研究中心,福建 宁德 352100 )
血管内血栓是心脏血管疾病的主要原因,严重危害人体健康[1]。在某些特定的生理条件下,机体纤溶作用效率低,血管内纤维蛋白积聚,阻碍血液流动[2]。目前临床使用的抗血栓药物主要有抗血小板药物、抗凝剂和溶栓剂等[3-4]。然而,这些药物成本高、作用时间短、缺乏特异性、具有毒性及其他各种副作用[5-6]。因此,人们正在积极寻找各种来源的新型纤溶酶。据报道,目前已从海洋动物[7-9]、微生物[10-11]中分离出纤溶酶。
海洋作为人类药物的重要宝库,海洋药物具有结构新颖、活性高、副作用低等优点。海洋底栖动物可口革囊星虫(Phasclosomaesculenta)被称为海洋“冬虫夏草”,具有活血强身及补肾益智等功效[12-13]。Ge等[8,14-15]研究发现,可口革囊星虫肠内存在纤溶酶,具有开发前景。由于野生可口革囊星虫日趋减少,而对表达出的星虫纤溶酶蛋白活性不理想[16],限制了星虫纤溶酶的开发。随着星虫养殖技术的突破,星虫资源充足,研究养殖可口革囊星虫体内纤溶酶活性有重要意义。笔者自养殖的可口革囊星虫体内分离纯化纤溶酶,进一步研究其酶学特性,为养殖可口革囊星虫纤溶酶的开发应用提供参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
养殖可口革囊星虫来自宁德宏远水产有限公司星虫养殖场。
凝血酶、纤维蛋白原、尿激酶购于Sigma公司;Q-Sepharose Fast Flow、Sephcry1 S-100购于GE公司;Bradford试剂盒购于碧云天公司;蚓激酶购于长春国奥药业公司;其余药品为分析纯,购于国药试剂公司。
1.1.2 仪器
AKTA蛋白层析系统(美国GE公司);FDU-2110冷冻离心机(日本东芝公司);Varioskan LUX酶标仪(美国Thermo公司);冻干机FDU-1200(日本东京理化);3-16PK高速冷冻离心机(德国Sigma公司);电泳装置(美国Bio-Rad公司)。
1.2 方法
1.2.1 纤溶酶活性测定
参照文献[17]纤维蛋白平板法测定纤溶酶活性。以标准尿激酶活性的对数为横坐标,以溶圈面积的对数为纵坐标,制作纤溶酶活性标准曲线,计算纤溶酶的活性。
1.2.2 蛋白质含量测定
参照试剂盒采用Bradford法测定蛋白质含量。
1.2.3 星虫纤溶酶活性部位筛选
将星虫洗净剖开取食道、肠、体液3部分,冷冻干燥。用Tris缓冲液(0.02 mol/L,pH 7.5)配成10 mg/mL的液体,取10 μL于平板内进行活性检测,阴性对照为Tris缓冲液,阳性对照为10 mg/mL的蚓激酶,确定星虫纤溶酶活性部位。
1.2.4 星虫纤溶酶分离纯化
1.2.4.1 硫酸铵盐析
取肠组织,加入一定体积的Tris缓冲液,匀浆,4 ℃、10 000 r/min(离心半径13.5 cm)离心10 min,取上清液,平均分为9份,每份10 mL,加入不同质量的固体硫酸铵,饱和度分别至10%、20%、30%、40%、50%、60%、70%、80%和90%,缓慢搅拌均匀,4 ℃静置过夜,离心收集沉淀,用截留分子质量为5 ku的透析袋透析除盐,测定纤溶酶活性和蛋白质含量,确定最佳硫酸铵盐析质量分数。
1.2.4.2 Q-Sepharose Fast Flow层析
取最佳范围盐析所得粗酶,用Tris缓冲液配成10 mg/mL的溶液,加载到Q-Sepharose Fast Flow柱上(1.5 mm×20 cm),Tris缓冲液平衡,分别用浓度为0.1、0.2、0.3、0.5 mol/L NaCl的Tris缓冲液洗脱结合蛋白,流速为1 mL/min,收集蛋白洗脱峰,测定纤溶酶活性和蛋白质含量。
1.2.4.3 Sephcry1 S-100凝胶层析
将Q-Sepharose Fast Flow分离出活性较高的酶,加载到Sephcry1 S-100柱上(1.0 mm×40 cm),用Tris缓冲液洗脱,洗脱速度1 mL/min,收集蛋白洗脱峰,测定纤溶酶活性和蛋白含量。
1.2.5 相对分子质量及MALDI-TOF MS测定
采用SDS-PAGE电泳法测定星虫纤溶酶的纯度及相对分子量。分离胶含量12%,浓缩胶含量5%,上样量为20 μL,浓缩胶电压100 V,分离胶电压120 V。纯化得到纤溶酶PK,经切胶,送上海鹿明生物科技有限公司进行MALDI-TOF质谱鉴定,检索美国国立生物技术信息中心数据库。
1.2.6 星虫纤溶酶酶学性质研究
用Tris缓冲液(0.02 mol/L,pH 7.5)配置10 mg/mL纤溶酶溶液,考察pH、温度、金属离子对酶活性的影响。在pH 3、4、5、6、7、8、9、10及37 ℃条件下孵育1 h,孵育后将所有样品的pH均调为7.5,测残余纤溶酶活性。将10 mg/mL纤溶酶分别于4、37、50、60、70 ℃下孵育1、2、3、4、5 h后,测残余纤溶酶活性。于10 mg/mL纤溶酶溶液中加入Na+、K+、Ca2+、Mg2+、Fe2+、Cu2+、Al3+,使其含有0.15 mol/L的金属离子。以不加金属离子的纤溶酶溶液作为对照组,37 ℃孵育1 h后,测残余纤溶酶活性。
1.2.7 星虫纤溶酶对体外凝血块的溶解作用
小鼠断头取血,体外制备血凝块。称量质量后放入试管中,随机分为9组,以生理盐水为阴性对照组,蚓激酶(10 mg/mL)为阳性对照组,10 mg/mL星虫纤溶酶为试验组,每组反应1、2、3 h。按血凝块质量分别加入等质量溶液,置37 ℃水浴,轻轻振荡,定时观察凝血块溶解现象,计算溶解率(R,%)。
R=(m1-m2)/m1×100%
式中,m1为试验前血块质量(g),m2为试验后血块质量(g)。
2 结果与分析
2.1 纤溶酶活性标准曲线
以标准尿激酶活性对数为横坐标,溶圈面积对数为纵坐标作图(图1)。标准曲线方程为:y=0.3118x+1.8346,r2=0.9973,依此方程计算纤溶酶活性。
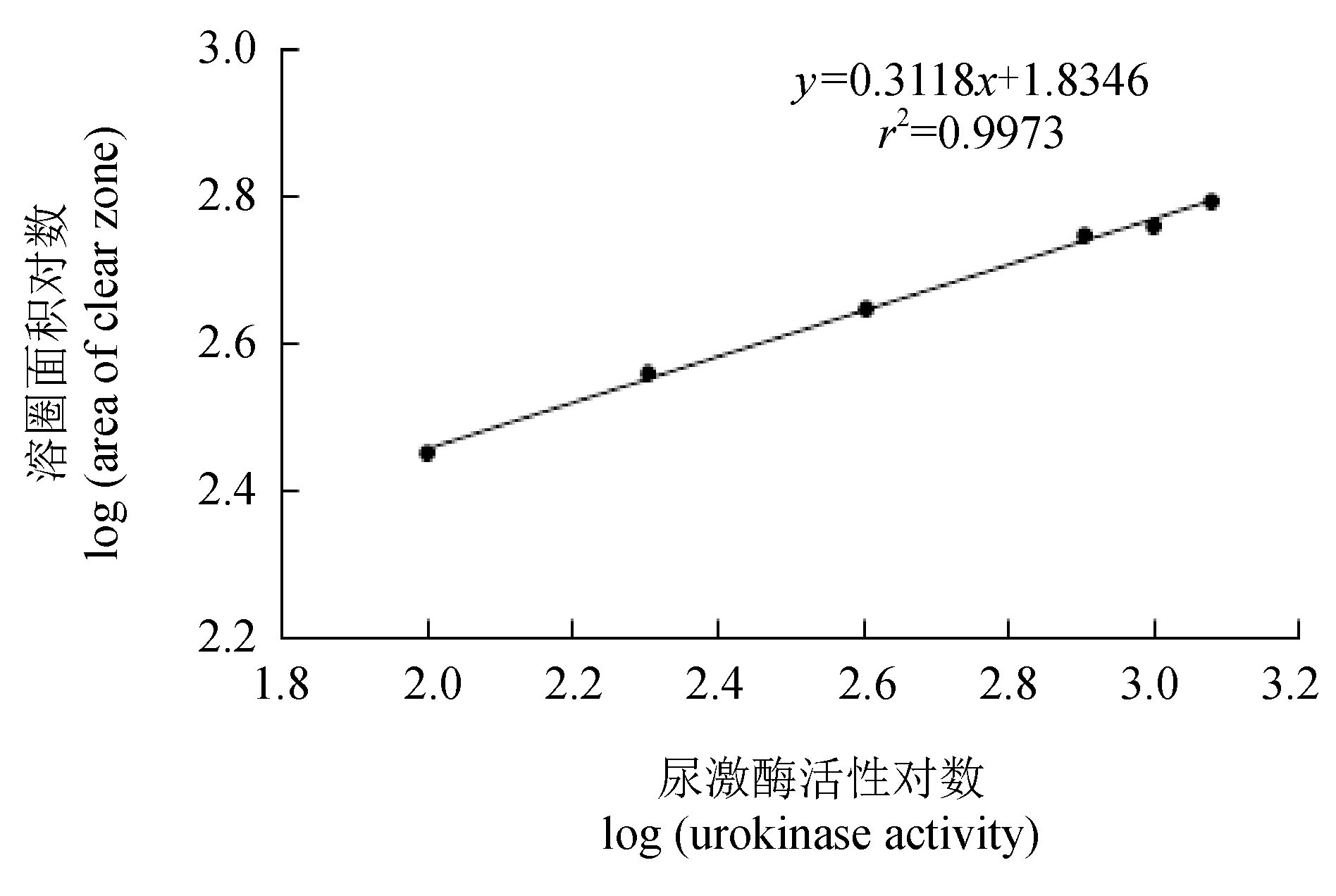
图1 尿激酶标准曲线Fig.1 The standard curve of urokinase
2.2 不同部位匀浆液纤溶酶活性
用纤维蛋白平板检测不同部位匀浆液纤溶酶活性,结果见图2。体液、肠和食道3个部位中,肠匀浆液中溶圈最大,表明肠组织中纤溶酶活性最强,纤溶酶主要存在于星虫的肠部位中。

图2 可口革囊星虫不同部位纤溶酶活性Fig.2 Fibrinolytic activity of different parts of sipunculid P. esculenta1.阴性对照; 2.阳性对照; 3.体腔液; 4.肠; 5.食道.1.negative control; 2.positive control; 3. coelomic fluid; 4.intestine; 5.esophagus.
2.3 星虫纤溶酶分离纯化
星虫纤溶酶初提液经10%~90%饱和度硫酸铵盐析,沉淀的纤溶酶活性见图3。硫酸铵饱和度小于20%时,沉淀的纤溶酶活性很小;饱和度在40%~70%时,沉淀的纤溶酶活性随着饱和度的增加而快速增加;饱和度大于70%时,纤溶酶活性开始减弱。因此,确定用40%~70%的饱和度硫酸铵进行盐析。
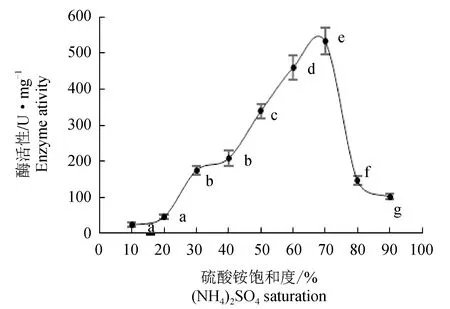
图3 纤溶酶盐析曲线Fig.3 Salting out curve of the fibrinolytic enzyme
盐析出的粗酶液经Q-Sepharose Fast Flow层析的结果见图4。4个洗脱峰中,第4峰具有较大纤溶活性。收集第4峰活性峰,经S-100凝胶层析结果见图5。2个洗脱峰中,第1峰具有纤溶活性,收集活性的峰1,为纤溶酶。根据尿激酶标准曲线,计算酶活性,结果见表1。从肠匀浆液分离出的纤溶酶,酶活性为4343.12 U/mg,是粗提物酶活性的13.82倍,但总酶活性回收率只有3.83%。
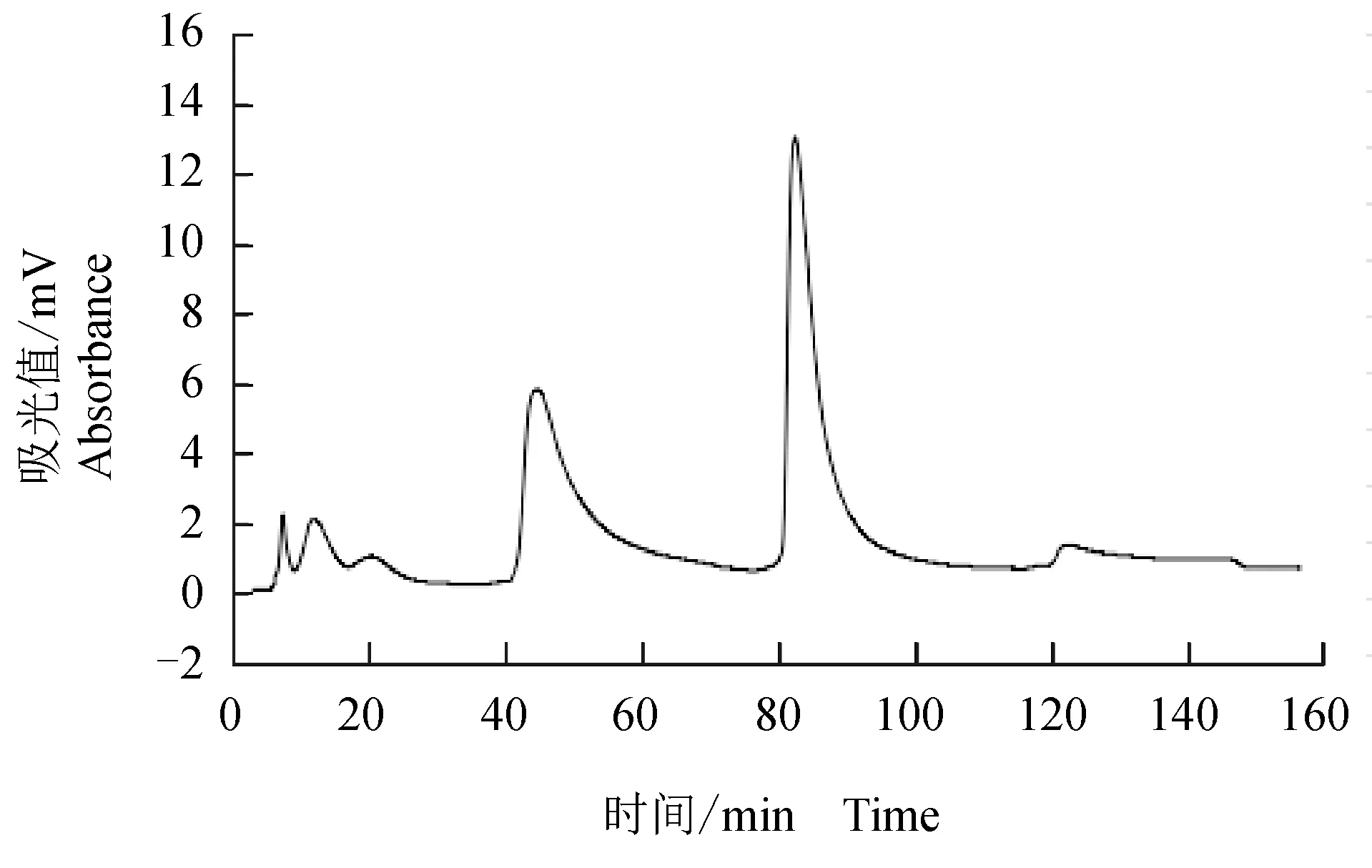
图4 Q-Sepharose FF交换层析 Fig.4 Lon-exchange chromatography on Q-Sepharose FF
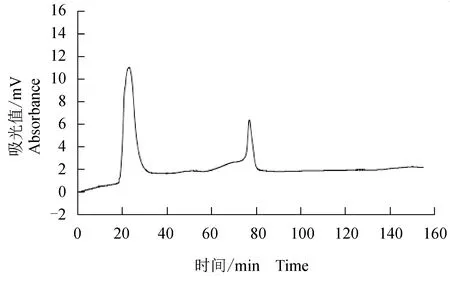
图5 Sephcry1 S-100凝胶过滤层析Fig.5 Gel chromatography on Sephcry1 S-100
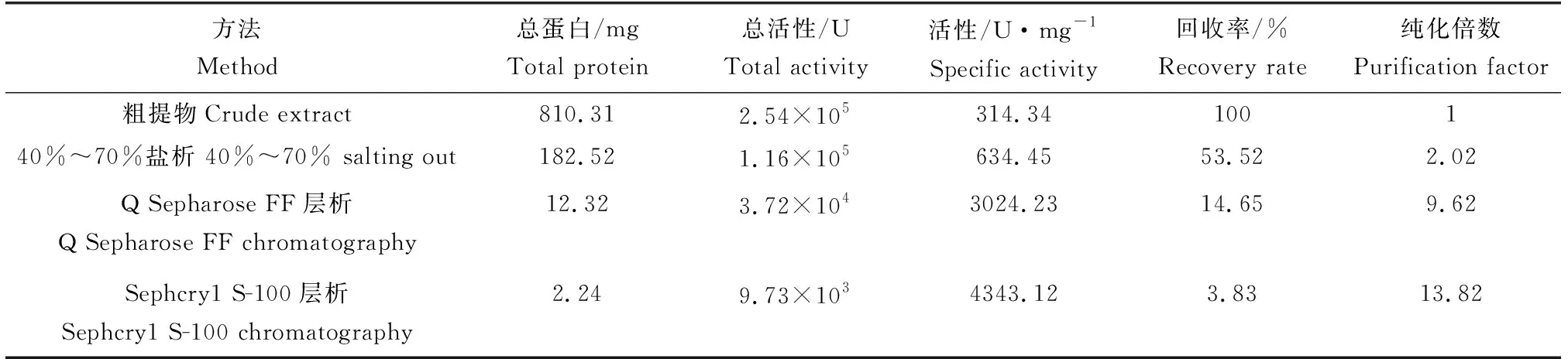
表1 可口革囊星虫纤溶酶分离纯化结果
2.4 纤溶酶纯度及相对分子质量测定
纤溶酶分离纯化的各组分经SDS-PAGE电泳,结果见图6。40%~70%饱和度硫酸铵盐析后的蛋白条带较多,Q-Sepharose Fast Flow层析后有3个明显的条带,而经Sephacryl S-100 凝胶层析后只剩1个条带,分子质量为32 ku。纯化到的纤溶酶经MALDI-TOF质谱分析和美国国立生物技术信息中心数据库比对,未找到相似的蛋白酶。

图6 不同分离组分电泳Fig.6 Electrophoretogram of different components1.maker; 2.S-100层析; 3.QS-FF层析; 4.盐析; 5.粗提物.1.maker; 2.S-100 chromatography; 3.QS-FF chromatography; 4.salting out; 5.crude extract.
2.5 星虫纤溶酶的酶学性质
2.5.1 温度对星虫纤溶酶活性的影响
纤溶酶PK在4 ℃和37 ℃保温5 h,酶的活性基本保持不变(P>0.05)(图7);在50 ℃时,随着保温时间的延长,残余的酶活性显著降低(P<0.05),5 h后仅剩23.12%;在60 ℃保温1 h后,残余酶活性只剩27.41%;70 ℃时酶几乎完全失活。说明该纤溶酶有一定的热稳定性,但对高温较敏感。

图7 温度对纤溶酶PK活性的影响Fig.7 Effect of temperature on activity of fibrinolytic emzyme PK柱状图上不同字母表示差异显著(P<0.05),下同.Different letters in the same column indicate significant differences (P<0.05), et sequentia.
2.5.2 pH对星虫纤溶酶活性的影响
该纤溶酶活性在pH 6~9保持相对稳定,残留酶活性在90%以上,最适pH为7(图8)。当pH小于6或大于9酶活性均显著下降(P<0.05);当pH为3时,相对酶活性降至10.2%,当pH为10时,酶完全失活,说明该酶在碱性环境下更易失活。

图8 pH对纤溶酶PK活性的影响Fig.8 Effect of pH on activity of fibrinolytic emzyme pK折线图上不同字母表示差异显著(P<0.05).Different letters in the same column indicate significant differences (P<0.05).
2.5.3 金属离子对星虫纤溶酶活性的影响
Mg2+能提升该纤溶酶的活性(P<0.05),Fe2+、Cu2+、Al3+显著抑制该酶的活性(P<0.05),其他离子没有明显的促进或抑制作用(P>0.05)(图9)。

图9 金属离子对纤溶酶PK活性的影响Fig.9 Effect of metal-ions on activity of fibrinolytic emzyme pK
2.6 星虫纤溶酶体外溶解血凝块
生理盐水组各时间点血凝块溶解率无显著变化(P>0.05),阳性对照组和纤溶酶组随着时间的增长,血凝块溶解率增大,阳性对照组在3 h时溶解率达到100%,而纤溶酶组最大为88.09%(图10)。阴性和阳性对照组溶液呈鲜红色,而纤溶酶组呈暗红色(图11)。
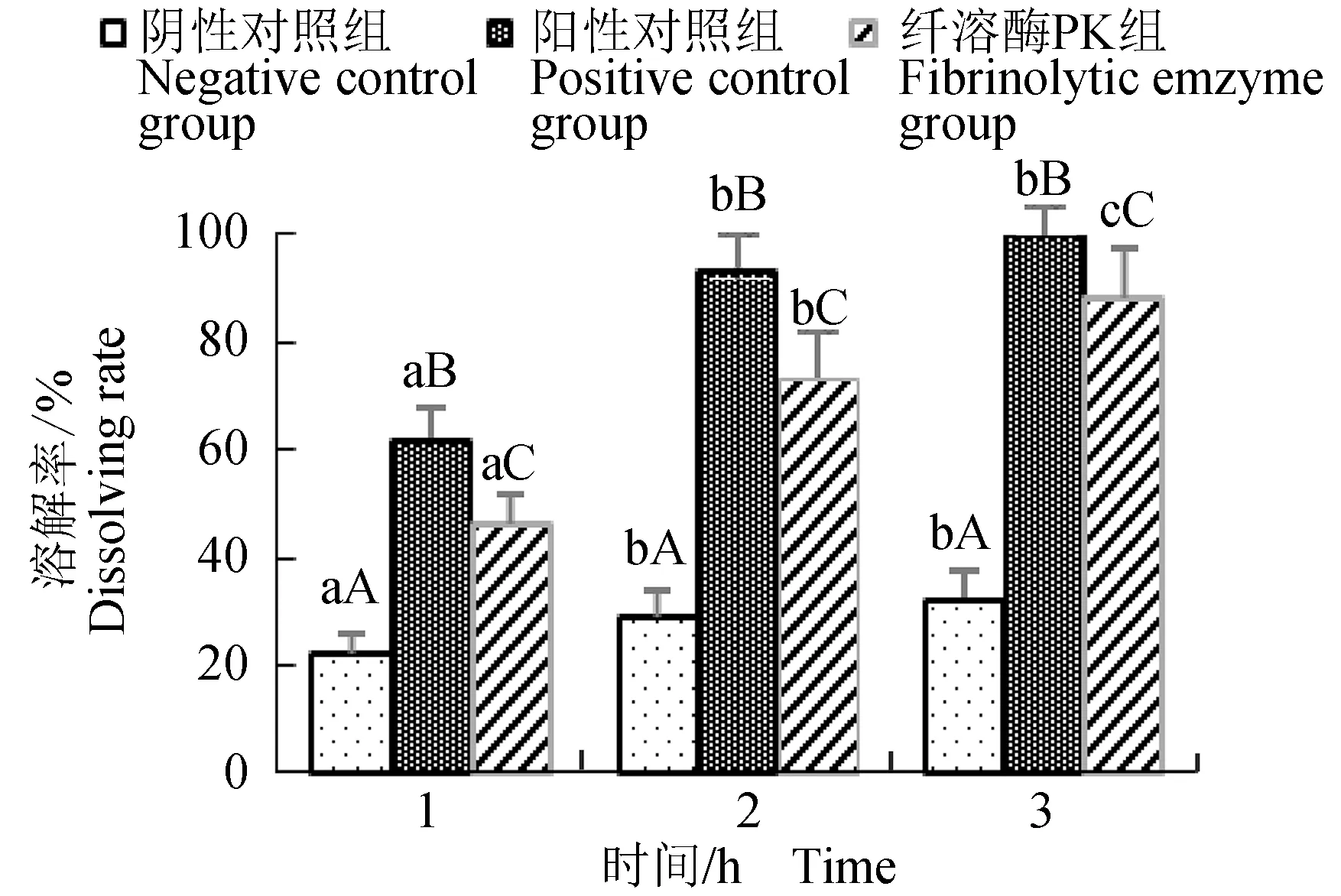
图10 纤溶酶PK体外溶解血凝块结果Fig.10 Effects of thrombolysis of fibrinolytic emzyme PK in vitro柱状图上不同小写字母表示同一组不同时间差异显著(P<0.05);不同大写字母表示不同组别同一时间差异显著(P<0.05).Different letters in the same column indicate significant differences in the same group at different time (P<0.05). differentt capital letters in the same column indicate significant differences in the different groups at the same time (P<0.05).

图11 星虫纤溶酶PK体外溶解血凝块现象Fig.11 The phenomenon of thrombolysis in fibrinolytic emzyme PK of sipunculid in vitroa.阴性对照组; b.阳性对照组; c.纤溶酶PK组.a.negative control group; b.positive control group; c.fibrinolytic emzyme PK group.
3 讨 论
3.1 星虫纤溶酶活性部位选取
自然界中存在着许多具有溶栓效应的天然活性物质。溶栓药蚓激酶上市以来,人们不断在寻找纤溶活性强、药理作用广、稳定性好、副作用小的溶栓药。海洋作为人类药物的重要宝库,目前已从可口革囊星虫[14-16]、裸体方格星虫(Sipunculusnudus)[17-19]等海洋生物中分离出纤溶酶。但野生星虫等海洋生物资源有限,过度采挖,资源已经越来越少。目前可通过蛋白表达技术产生大量目标蛋白酶,但研究发现,原核表达的纤溶酶没有活性,而真核系统表达的酶活性很小[16],只能以养殖星虫为原料提取纤溶酶。本试验中,养殖可口革囊星虫不同组织中肠组织纤溶酶活性最强,食道提取液活性较小,因此纤溶酶主要存在肠道中,可能与肠是主要的消化器官且内含丰富的消化酶有关。
3.2 星虫纤溶酶纯化工艺
为得到高纯度的纤溶酶,以纯化步骤少、操作过程低温为原则,采用盐析、Q-Sepharose Fast Flow阴离子和Sephcryl S-100凝胶层析组合的分离方法,从养殖可口革囊星虫肠中分离到纤溶酶。在盐析过程中,要边加硫酸铵边搅拌,以免硫酸铵沉淀及局部盐度升高使酶失活。盐析的关键是盐含量区间的设置,既要考虑蛋白的回收率,也要考虑酶的高活性。本试验中,硫酸铵饱和度40%~70%沉淀区间,纤溶酶活性急剧上升,此区间为盐析目的酶的最优区间。马伏宁等[9]用30%~70%饱和度的硫酸铵从方格星虫中盐析出纤溶酶;李冠龙等[20]用40%~70%饱和度的硫酸铵从茶树菇子实体中盐析出纤溶酶,可以看出,纤溶酶的来源不同,但盐析的区间较为一致,这可能与纤溶酶蛋白的特性相关。
离子交换层析是蛋白纯化常用的方法,影响纯化效果的因素主要有填料类型、缓冲液的含量及pH等。本试验中,笔者采用Q-Sepharose Fast Flow强离子吸附剂填料。已报道的纤溶酶蛋白等电点在4~7间,因此用pH 8.5的缓冲液进行洗脱,通过Q-Sepharose Fast Flow分离,取得了较好的分离效果。此步骤酶总活性回收率为14.65%,损失较多,可能是纤溶酶蛋白未完全吸附到填料上,直接洗脱流失,还有可能是洗脱出的目标峰溶液经过脱盐处理后流失,后期可进一步优化缓冲液pH和洗脱流速等参数。凝胶层析作为蛋白分离纯化的精细步骤,Sephcryl S-100分离后,回收率为3.83%。经过上述纯化工艺路线,得到的活性为4343.12 U/mg,比肠匀浆原液酶的活性提高了13.82倍,与牛荣丽等[14]研究相比,总酶活性回收率偏低。这可能是由纯化时原样品总量较少,且盐析含量范围选择的不够宽及离子层析参数不够恰当等导致,后期需进一步优化。
3.3 星虫纤溶酶特性及溶血能力
牛荣丽等[14,21-23]从不同动物中纯化得到的纤溶酶,其分子质量为32~35 ku,与本试验分离到的纤溶酶分子质量32 ku相似。虽然纤溶酶蛋白分子质量与其他学者研究的相似,但通过MALDI-TOF质谱分析和美国国立生物技术信息中心数据库比对,未找到相似的蛋白,因此后续试验要进一步确定蛋白的序列。研究发现,纤溶酶在pH 6~9时,稳定性较好;pH超过9时,酶活性快速下降。常温下酶活性相对稳定,但不耐高温,与之前研究过的动物纤溶酶的pH相当[14],适用于人体。反应体系中含有Mg2+时,纤溶酶的酶活性表现为激活作用,而在张雪等[24]的研究中,Mg2+对豆豉纤溶酶起抑制作用。可见,同一种金属离子对不同的纤溶酶会产生不同的作用。体外溶解血凝块发现,分离到的纤溶酶溶解血凝块的能力与蚓激酶相当,但溶解出的血液颜色变深,原因待后续进一步探究。本试验中,从养殖可口革囊星虫肠组织中纯化出的纤溶酶,与从野生星虫等其他动物中分离出的具有同等性质及功效,为养殖可口革囊星虫纤溶酶的开发应用,提供了丰富的原料资源。
4 结 论
自可口革囊星虫肠中分离出1种纤溶蛋白酶,其分子质量约32 ku,活性为4343.12 U/mg;该酶在37 ℃以下及pH 6~9,酶稳定性较好;Mg2+能提升该纤溶酶的活性,Fe2+、Cu2+、Al3+可抑制酶活性;该酶对体外血凝块溶解率达到88.09%。

